
- •Часть II
- •Раздел IV. Химическая кинетика и катализ
- •Двусторонние и односторонние (обратимые и необратимые) реакции
- •Кинетическая классификация реакций. Молекулярность и порядок реакций
- •Необратимые реакции первого порядка
- •Необратимые реакции второго порядка
- •Необратимые реакции n-го порядка
- •Реакции нулевого порядка
- •Сложные реакции: обратимые, параллельные, последовательные
- •Обратимые реакции первого порядка
- •В момент равновесия скорости прямой и обратной реакций одинаковы:
- •Обратимые реакции второго порядка
- •В общем виде
- •Параллельные реакции
- •Последовательные реакции
- •Методы определения порядка реакций
- •Влияние температуры на скорость реакции
- •Применение теории столкновений к бимолекулярным реакциям. Расчет константы скорости
- •Типы бимолекулярных реакций
- •Теория активного комплекса (переходного состояния)
- •Обрыв цепи
- •Длина цепи и ветви
- •Кинетика неразветвленных цепных реакций
- •Разветвленные цепные реакции
- •Тепловой взрыв
- •Сопряженные реакции
- •Основные законы фотохимии. Квантовый выход
- •Основные типы фотохимических процессов
- •Зависимость скорости фотохимических реакций от температуры
- •Мономолекулярные и тримолекулярные реакции. Реакции в растворах Мономолекулярные реакции в газовой фазе
- •Тримолекулярные реакции в газовой фазе
- •Реакции в растворах
- •Методы изучения кинетики сложных реакций
- •Общие сведения о катализе. Гомогенный катализ. Катализ кислотами и основаниями Общие сведения о катализе
- •Гомогенные каталитические реакции
- •Общая схема расчета кинетики гомогенных каталитических реакций
- •Катализ кислотами и основаниями
- •Активационный процесс в гетерогенных реакциях
- •Активированная адсорбция
- •Кинетика гетерогенных каталитических реакций
- •Истинная и кажущаяся энергия активации гетерогенных химических реакций
- •Теория активных центров в гетерогенном катализе Отравление катализатора
- •Роль поверхности и пористость катализатора
- •Связь между энергией активации и предэкспоненциальным множителем
- •Недостаточность модели однородной поверхности в катализе и адсорбции
- •Мультиплетная теория катализа
- •Теория активных ансамблей
- •Электронные представления в гетерогенном катализе
- •Раздел V. Электрохимия
- •Предмет электрохимии
- •Проводники первого и второго рода
- •Электрохимические реакции
- •Законы электролиза (законы Фарадея)
- •Теория электролитической диссоциации Аррениуса
- •Недостатки теории Аррениуса
- •Причины диссоциации. Сольватация и гидратация Теплоты сольватации (гидратации)
- •Экспериментальные теплоты гидратации ионов
- •Модельные методы расчета энергии гидратации ионов
- •Энтропия сольватации ионов
- •Состояние ионов в растворах. Число сольватации
- •Распределение ионов в растворе
- •Теория электролитов Дебая и Гюккеля
- •Сопоставление теории Дебая – Гюккеля с опытом
- •Дальнейшее развитие теории
- •Удельная и эквивалентная электропроводность
- •Влияние природы растворителя на электропроводность
- •Подвижность ионов
- •Подвижность ионов гидроксония и гидроксила
- •Связь между подвижностью ионов и их концентрацией
- •Зависимость подвижности ионов от температуры
- •Числа переноса ионов
- •Диссоциация воды. РН растворов
- •Диссоциация слабых электролитов
- •Гидролиз солей
- •Буферные растворы
- •Амфотерные электролиты
- •Произведение растворимости
- •Гальванические элементы. Эдс
- •Термодинамика гальванического элемента
- •Измерение эдс
- •Строение границы электрод-раствор. Двойной электрический слой
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
- •Электродный потенциал
- •Стандартный электродный потенциал
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Определение коэффициентов активности электролитов
- •Определение рН раствора
- •Произведение растворимости
- •Потенциометрия
- •Ионоселективные электроды
- •Кинетика электрохимических процессов
- •Концентрационная поляризация
- •Электрохимическое перенапряжение
- •Напряжение разложения
- •Закономерности перенапряжения выделения водорода
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Теории водородного перенапряжения
- •Теория замедленной рекомбинации
- •Теория замедленного разряда
- •Электроосаждение металлов
- •Анодное растворение и пассивность металлов
- •Коррозия металлов. Борьба с коррозией
- •Кондуктометрия
- •Электроанализ и кулонометрия
- •Вольтамперометрические методы
- •Полярография. Нестационарная вольтамперометрия Классическая полярография
- •Следовательно, изменение приложенной извне разности потенциалов при выполнении измерений указанным образом равно изменению потенциала капельного электрода.
- •Теория метода
- •Твердые электроды в полярографии
- •Разновидности полярографических методов
- •Импульсная полярография
- •Осциллографическая полярография
- •Основные формулы и законы Формальная кинетика
- •Зависимость скорости реакции от температуры
- •Применение теории активных столкновений и теории активного комплекса к расчету констант скоростей реакций
- •Фотохимия
- •Ионное равновесие в растворах электролитов
- •Неравновесные явления в растворах электролитов: миграция и диффузия
- •Термодинамика гальванического элемента
- •Классификация электродов
- •Классификация электрохимических цепей
- •Аккумуляторы
- •Законы электролиза
- •Неравновесные электродные процессы
- •Оглавление
- •Физическая химия Курс лекций
- •Часть 2
- •Химическая кинетика, электрохимия
Неравновесные явления в растворах электролитов: миграция и диффузия
Миграция представляет собой передвижение ионов (или других заряженных частиц) под действием градиента электрического поля dU/dx , возникающего в электролите при прохождении тока через электрохимическую систему. Явление миграции лежит в основе электропроводности электролитов.
Различают удельную, эквивалентную и мольную электропроводность электролитов.
Электропроводность К величина, обратная электрическому сопротивлению R. Так как
R = , то К = = ,
где удельное электрическое сопротивление; l расстояние между электродами; S площадь электрода; удельная электропроводность.
Удельная электропроводность жидкости это электропроводность одного кубического сантиметра раствора, заполняющего пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Кубический сантиметр раствора должен находиться вдали от границ электрода. = Ом–1 см–1.
Физический смысл : по закону Ома R = U/I , K = I/U ; I = i S (i плотность тока, или ток, приходящийся на 1 см2 поверхности электрода; S площадь электрода); U = E l (Е напряженность поля, или падение напряжения на 1 см расстояния; l расстояние между электродами). Тогда
= ; i = E .
При Е = 1 В/см i = .
I = ; i = .
Таким образом, это количество электричества, которое проходит в единицу времени через единицу поперечного сечения проводника при напряженности электрического поля 1 В/см.
Кривая зависимости удельной электропроводности растворов от концентрации обычно имеет максимум, четко выраженный для сильных электролитов и сглаженный для слабых.
Удельная электропроводность зависит от температуры. Зависимость дается эмпирическим уравнением
t = 18 1 + (t – 18) ,
где температурный коэффициент электропроводности ( 0); 18 (25) стандартное значение. Коэффициент зависит от природы электролита; он равен для сильных кислот 0,0164, для сильных щелочей 0,0190, для солей 0,0220. В случае слабых электролитов больше, чем для сильных. Следует отметить, что температурные коэффициенты электропроводности водных растворов и вязкости воды близки по своей величине, но обратны по знаку. Это свидетельствует о том, что увеличение удельной электропроводности с ростом температуры связано, главным образом, с уменьшением вязкости раствора.
Эквивалентная электропроводность в см2/(г-эквОм) это электропроводность такого объема ( см3) раствора, в котором содержится 1 г-экв растворенного вещества; раствор заполняет пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Величина , равная 1000/с см3/г-экв, называется разведением.
= ; = .
Мольная электропроводность электролита это произведение эквивалентной электропроводности на число грамм-эквивалентов в 1 моль диссоциирующего вещества.
Зависимость эквивалентной электропроводности от концентрации: для сильных электролитов в области малых концентраций соблюдается медленное линейное уменьшение с увеличением , что соответствует эмпирической формуле Кольрауша (закону квадратного корня):
= А ,
где предельная эквивалентная электропроводность при бесконечном разведении: с 0 , . А – эмпирическая постоянная. При несколько более высоких концентрациях сильных электролитов лучшее согласие с опытом дает уравнение, известное под названием закона кубического корня:
= А .
Для разбавленных растворов слабых электролитов вышеприведенные законы не соблюдаются.
Влияние природы растворителя на электропроводность: электропроводность растворов электролитов зависит, в первую очередь, от природы электролита и растворителя. Основными свойствами растворителя, обусловливающими характер изменения электропроводности, являются его вязкость и диэлектрическая проницаемость.
Повышение вязкости снижает электропроводность. Количественное выражение этого эффекта дается правилом Вальдена – Писаржевского:
оо = const ,
о – мольная электропроводность электролита, экстраполированная до нулевой концентрации; о – вязкость чистого растворителя. Правило Вальдена – Писаржевского приближенно и оправдывается лишь для растворителей с близкими величинами диэлектрических проницаемостей.
Скорости движения катиона u и аниона v (см/с) зависят от природы ионов, напряженности электрического поля U/l , концентрации, Т, вязкости среды и т.п. Скорость ионов пропорциональна приложенной силе, то есть напряженности поля
u = u , v = v ,
где u, v скорости ионов в стандартных условиях, при напряженности поля, равной 1 В/см; они называются абсолютными подвижностями ионов и измеряются в см2/(сВ).
uF и vF это скорости движения ионов, выраженные в электростатических единицах; они называются ионными электропроводностями (или просто подвижностями ионов):
uF = + , vF = – .
Для сильных электролитов = + + – ,
для слабых = (+ + –) .
При бесконечном разведении ( , 1)
= о+ + о–
как для сильных, так и для слабых электролитов. Величины о+ и о– являются предельными электропроводностями (предельными подвижностями) ионов. Они равны эквивалентным электропроводностям катиона и аниона при бесконечном разведении и измеряются в тех же единицах, что и и , то есть в см2/(Омг-экв). Вышеприведенное уравнение является выражением закона Кольрауша: эквивалентная электропроводность при бесконечном разведении равна сумме предельных подвижностей ионов.
Для всех электролитов можно записать
с = с , с = с / .
+ и – зависят от концентрации (разведения), особенно для сильных электролитов; о+ и о– табличные величины.
Влияние природы иона (его радиуса и заряда) на величину подвижности иона отражено в формуле Стокса
u
=
![]() ,
,
где е заряд электрона; z число элементарных зарядов иона; r эффективный радиус иона (радиус гидратированного иона); коэффициент вязкости.
Уменьшение подвижности ионов и эквивалентной электропроводности сильных электролитов с увеличением концентрации объясняется, по теории Дебая и Гюккеля, наличием ионной атмосферы. Из-за наличия ионной атмосферы при движении иона возникают два тормозящих эффекта: электрофоретический, обусловленный движением ионной атмосферы в сторону, противоположную направлению движения иона, и эффект релаксации, обусловленный асимметрией ионной атмосферы.
Онзагер вывел теоретическое уравнение, которое количественно связывает эквивалентную электропроводность с концентрацией и позволяет вычислить электрофоретический и релаксационный эффекты. Уравнение Онзагера имеет следующий вид:
с = – (a + b) ,
где первое слагаемое в скобках характеризует электрофоретический эффект, второе слагаемое характеризует эффект релаксации; a и b зависят от заряда ионов, Т, диэлектрической проницаемости растворителя D и вязкости растворителя . Для 1-1 валентного электролита
с = – + .
По виду уравнение совпадает с эмпирическим законом квадратного корня Кольрауша. Оно позволяют теоретически предсказать численное значение константы А уравнения Кольрауша. Формула Онзагера согласуется с опытными данными в той области концентраций, где приложим закон квадратного корня. При увеличении концентрации сходимость с опытом уменьшается.
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов:
t+ = , t– = , t+ + t– = = 1 ;
I+ = , I– = , I = I+ + I– = ;
t+ = = = , t– = = = .
Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона. Так как подвижности катиона и аниона изменяются с концентрацией и температурой в общем случае неодинаково, то и числа переноса зависят от концентрации и температуры, хотя эта зависимость более слабая. Приведенные соотношения позволяют вычислить числа переноса, если известны значения подвижностей ионов. С другой стороны, опытное определение чисел переноса дает возможность вычислить подвижности.
Экспериментально числа переноса определяются по изменению концентрации ионов у электродов (метод Гитторфа):
= = .
Числа переноса определяются из соотношений
t+ = = , t– = = ,
где ск – убыль электролита у катода, а са – убыль электролита у анода в ходе электролиза.
Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса; они не являются истинными, так как этот метод не учитывает сольватации ионов. Измеряемые в методе Гитторфа концентрации определяются не только количеством катионов и анионов, но и количеством растворителя, перенесенного этими ионами в виде сольватных оболочек. Оболочки ионов разных знаков неодинаковы по величине.
Молекулярная диффузия представляет собой перемещение частиц под действием градиента химического потенциала d/dx , или приближенно – градиента концентрации dc/dx , возникающего в растворе в результате его качественной или количественной неоднородности. Молекулярная диффузия описывается законами Фика. Первый закон Фика описывает стационарную диффузию незаряженных частиц:
d
ni
= – Di
S
![]() d
t
,
d
t
,
где ni – число частиц, диффундирующих через поперечное сечение S; ci – концентрация частиц; Di – коэффициент диффузии – число i-х частиц, диффундирующих за единицу времени через единичное сечение, размерность коэффициента диффузии – м2/с.
Di
=
![]() ,
,
где ki – коэффициент трения, откуда получаем, при использовании закона Стокса, уравнение Эйнштейна – Смолуховского:
Di
=
![]() ,
,
где ri – радиус диффундирующей частицы (иона).
В соответствии с гидродинамической теорией электропроводности,
vi
=
![]() , ui
=
, ui
=
![]() =
=
![]() ,
,
i
= ui
F
=
![]() =
=
![]() ,
,
где vi – скорость движения иона (см/с); ui – абсолютная подвижность иона; i – подвижность иона (ионная электропроводность).
Связь между подвижностью ионов и их коэффициентами диффузии устанавливается уравнением Нернста – Эйнштейна:
Di
=
![]() ui
,
ui
,
аналогичное уравнение передает зависимость между ионными электропроводностями и коэффициентами диффузии:
Di
=
![]() i
.
i
.
Оба уравнения относятся к бесконечно разбавленным растворам.
Диффузионный потенциал на границе двух жидких растворов для практически наиболее важных простых частных случаев можно рассчитать по следующим формулам (по методам Планка и Гендерсона):
1. Растворы одного и того же электролита МА, но разной концентрации:
D
= –
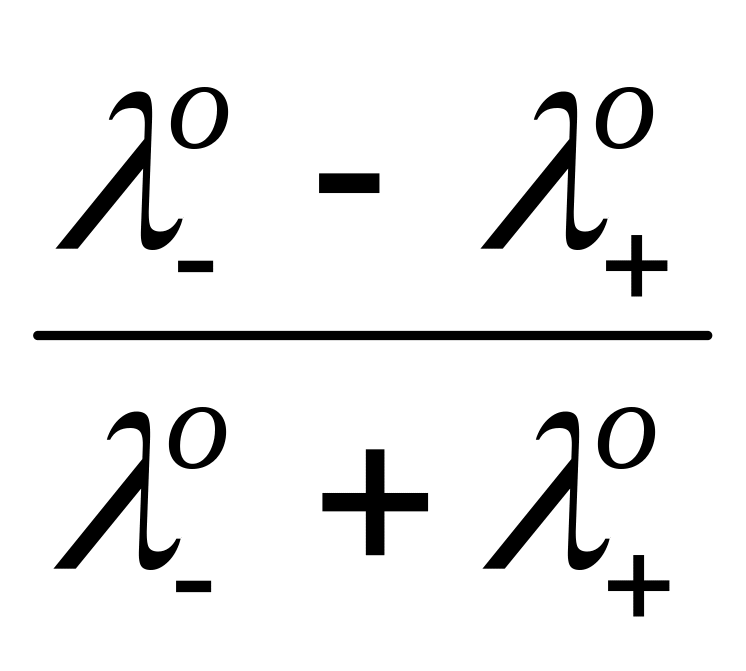 ln
ln
![]() .
.
Если вместо концентраций подставить активности, то это уравнение можно применить и для концентрированных растворов
D
= –
![]() ln
ln
![]() ,
,
где подвижности ионов – и + должны соответствовать их активностям в растворах I и II.
2. Растворы двух различных электролитов с одним общим ионом (например, типа МА и МА), причем концентрации электролитов одинаковы:
D
=
ln
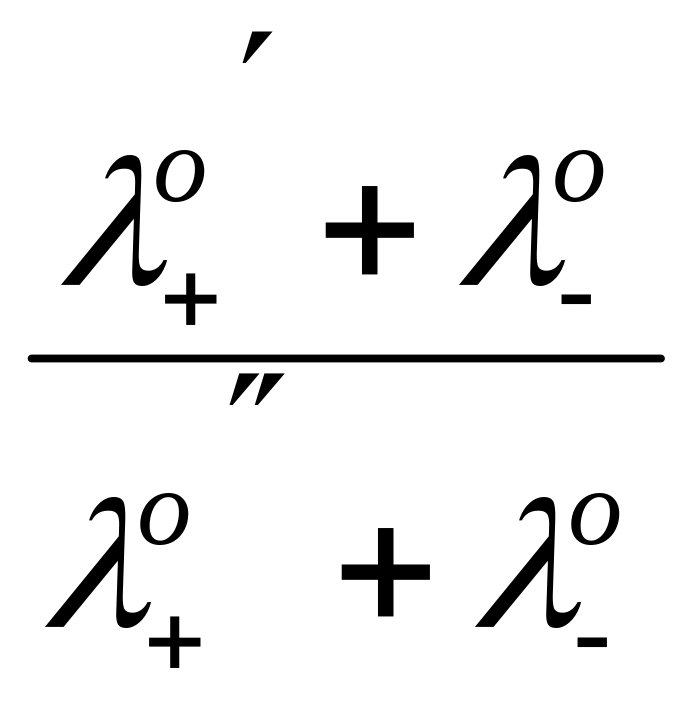 =
ln
=
ln
![]()
(учитывая, что +о + –о = о ).
