
- •Часть II
- •Раздел IV. Химическая кинетика и катализ
- •Двусторонние и односторонние (обратимые и необратимые) реакции
- •Кинетическая классификация реакций. Молекулярность и порядок реакций
- •Необратимые реакции первого порядка
- •Необратимые реакции второго порядка
- •Необратимые реакции n-го порядка
- •Реакции нулевого порядка
- •Сложные реакции: обратимые, параллельные, последовательные
- •Обратимые реакции первого порядка
- •В момент равновесия скорости прямой и обратной реакций одинаковы:
- •Обратимые реакции второго порядка
- •В общем виде
- •Параллельные реакции
- •Последовательные реакции
- •Методы определения порядка реакций
- •Влияние температуры на скорость реакции
- •Применение теории столкновений к бимолекулярным реакциям. Расчет константы скорости
- •Типы бимолекулярных реакций
- •Теория активного комплекса (переходного состояния)
- •Обрыв цепи
- •Длина цепи и ветви
- •Кинетика неразветвленных цепных реакций
- •Разветвленные цепные реакции
- •Тепловой взрыв
- •Сопряженные реакции
- •Основные законы фотохимии. Квантовый выход
- •Основные типы фотохимических процессов
- •Зависимость скорости фотохимических реакций от температуры
- •Мономолекулярные и тримолекулярные реакции. Реакции в растворах Мономолекулярные реакции в газовой фазе
- •Тримолекулярные реакции в газовой фазе
- •Реакции в растворах
- •Методы изучения кинетики сложных реакций
- •Общие сведения о катализе. Гомогенный катализ. Катализ кислотами и основаниями Общие сведения о катализе
- •Гомогенные каталитические реакции
- •Общая схема расчета кинетики гомогенных каталитических реакций
- •Катализ кислотами и основаниями
- •Активационный процесс в гетерогенных реакциях
- •Активированная адсорбция
- •Кинетика гетерогенных каталитических реакций
- •Истинная и кажущаяся энергия активации гетерогенных химических реакций
- •Теория активных центров в гетерогенном катализе Отравление катализатора
- •Роль поверхности и пористость катализатора
- •Связь между энергией активации и предэкспоненциальным множителем
- •Недостаточность модели однородной поверхности в катализе и адсорбции
- •Мультиплетная теория катализа
- •Теория активных ансамблей
- •Электронные представления в гетерогенном катализе
- •Раздел V. Электрохимия
- •Предмет электрохимии
- •Проводники первого и второго рода
- •Электрохимические реакции
- •Законы электролиза (законы Фарадея)
- •Теория электролитической диссоциации Аррениуса
- •Недостатки теории Аррениуса
- •Причины диссоциации. Сольватация и гидратация Теплоты сольватации (гидратации)
- •Экспериментальные теплоты гидратации ионов
- •Модельные методы расчета энергии гидратации ионов
- •Энтропия сольватации ионов
- •Состояние ионов в растворах. Число сольватации
- •Распределение ионов в растворе
- •Теория электролитов Дебая и Гюккеля
- •Сопоставление теории Дебая – Гюккеля с опытом
- •Дальнейшее развитие теории
- •Удельная и эквивалентная электропроводность
- •Влияние природы растворителя на электропроводность
- •Подвижность ионов
- •Подвижность ионов гидроксония и гидроксила
- •Связь между подвижностью ионов и их концентрацией
- •Зависимость подвижности ионов от температуры
- •Числа переноса ионов
- •Диссоциация воды. РН растворов
- •Диссоциация слабых электролитов
- •Гидролиз солей
- •Буферные растворы
- •Амфотерные электролиты
- •Произведение растворимости
- •Гальванические элементы. Эдс
- •Термодинамика гальванического элемента
- •Измерение эдс
- •Строение границы электрод-раствор. Двойной электрический слой
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
- •Электродный потенциал
- •Стандартный электродный потенциал
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Определение коэффициентов активности электролитов
- •Определение рН раствора
- •Произведение растворимости
- •Потенциометрия
- •Ионоселективные электроды
- •Кинетика электрохимических процессов
- •Концентрационная поляризация
- •Электрохимическое перенапряжение
- •Напряжение разложения
- •Закономерности перенапряжения выделения водорода
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Теории водородного перенапряжения
- •Теория замедленной рекомбинации
- •Теория замедленного разряда
- •Электроосаждение металлов
- •Анодное растворение и пассивность металлов
- •Коррозия металлов. Борьба с коррозией
- •Кондуктометрия
- •Электроанализ и кулонометрия
- •Вольтамперометрические методы
- •Полярография. Нестационарная вольтамперометрия Классическая полярография
- •Следовательно, изменение приложенной извне разности потенциалов при выполнении измерений указанным образом равно изменению потенциала капельного электрода.
- •Теория метода
- •Твердые электроды в полярографии
- •Разновидности полярографических методов
- •Импульсная полярография
- •Осциллографическая полярография
- •Основные формулы и законы Формальная кинетика
- •Зависимость скорости реакции от температуры
- •Применение теории активных столкновений и теории активного комплекса к расчету констант скоростей реакций
- •Фотохимия
- •Ионное равновесие в растворах электролитов
- •Неравновесные явления в растворах электролитов: миграция и диффузия
- •Термодинамика гальванического элемента
- •Классификация электродов
- •Классификация электрохимических цепей
- •Аккумуляторы
- •Законы электролиза
- •Неравновесные электродные процессы
- •Оглавление
- •Физическая химия Курс лекций
- •Часть 2
- •Химическая кинетика, электрохимия
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение
высшего профессионального образования
«Пермский государственный университет»
А.Б.Шеин, М.А.Виноградова
ФИЗИЧЕСКАЯ ХИМИЯ
Курс лекций
Часть II
Химическая кинетика, электрохимия
ПЕРМЬ 2010
УДК 541
ББК 24.5
Ш 39
Шеин, А.Б.
Ш39 Физическая химия: курс лекций. Ч. 2: Химическая кинетика, электрохимия: учеб. пособие / А.Б.Шеин, М.А.Виноградова; Перм. гос. ун-т. – Пермь, 2010. – 404 с.: ил.
ISBN
Издание представляет собой курс лекций по физической химии, включающий разделы «Химическая кинетика» и «Электрохимия», читаемый студентам химического факультета Пермского государственного университета.
Подробно излагаются основы формальной кинетики, теория цепных и фотохимических реакций, различные подходы к раскрытию природы каталитических реакций. В разделе «Электрохимия» рассматриваются не только теоретические вопросы данной науки (включая историю развития взглядов на основные проблемы электрохимии), но и практическое применение электрохимических методов в физико-химическом анализе.
Предназначено для студентов 3 курса химического факультета, изучающих дисциплину «Химическая кинетика и электрохимия». Может быть использовано студентами биологического и геологического факультетов при изучении дисциплины «Физическая и коллоидная химия».
Табл. 8. Ил. 42. Библиогр. 16 назв.
Печатается по решению ученого совета химического факультета Пермского государственного университета
Рецензент: д-р хим. наук, проф. А.Е.Леснов (Институт технической химии УрО РАН); кафедра физической и коллоидной химии ГОУ ВПО «Пермская государственная фармацевтическая академия»
УДК 541
ББК 24.5
ISBN Шеин А.Б., Виноградова М.А.,
2010
Пермский государственный
университет, 2010
Раздел IV. Химическая кинетика и катализ
Лекция 30
Скорость химической реакции. Двусторонние и односторонние (обратимые и необратимые) реакции. Молекулярность и порядок реакции. Кинетическая классификация реакций
Химическая кинетика раздел физической химии, посвящённый закономерностям протекания химических процессов во времени. Одной из задач химической кинетики является количественное описание протекания химических реакций во времени при постоянной температуре в зависимости от концентраций реагирующих веществ. Этот раздел химической кинетики называется формальной кинетикой.
В общем виде химическую реакцию можно записать следующим образом:
1 А1 + 2 А2 + ... + n An = 1A1 + 2A2 + ... + nAn .
Скоростью химической реакции называется количество молекул данного сорта, реагирующих в единицу времени в единице объёма. Для определения скорости химической реакции достаточно знать изменение во времени количества одного из участвующих в реакции веществ (исходного или конечного), так как изменение количества всех остальных веществ можно определить из уравнения реакции.
Химические реакции редко протекают в одну стадию, так как их принято записывать. Запись уравнения реакции можно рассматривать как символическое выражение материального баланса (закона сохранения вещества). В действительности подавляющая часть химических реакций протекает через ряд промежуточных стадий, и в большинстве случаев детальный механизм протекания реакции нам неизвестен из-за больших трудностей выявления промежуточных продуктов. Скорость суммарной реакции определяется скоростью наиболее медленной стадии, которая называется лимитирующей.
Еще в самом начале исследований по химической кинетике было сделано физически очевидное предположение, что реагируют только те молекулы, которые сталкиваются. Как известно, число столкновений прямо пропорционально числу молекул, поэтому скорость реакции должна быть пропорциональна концентрации реагирующих веществ. В общем случае можно принять, что скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в некоторых степенях:
v
= k
![]() , v
= моль/(м3с)
или
молекул/(м3с)
;
, v
= моль/(м3с)
или
молекул/(м3с)
;
k константа скорости химической реакции, k зависит от природы реакции и является функцией температуры;
ni порядок реакции по данному веществу; в общем случае порядки реакции по веществам никак не связаны со стехиометрическими коэффициентами i этих веществ в уравнении реакции, и только в тех случаях, когда реакция протекает в одну стадию, порядок реакции ni по данному веществу совпадает со стехиометрическим коэффициентом i данного вещества в химическом уравнении.
Вышеприведенное выражение называют основным постулатом химической кинетики.
Физический
смысл коэффициента k
: v
= k
, если
![]() , то есть константа скорости химической
реакции есть скорость реакции при
условии, что концентрации реагирующих
веществ равны 1; k
иногда называют удельной
скоростью химической реакции.
Размерность константы скорости зависит
от порядка реакции.
, то есть константа скорости химической
реакции есть скорость реакции при
условии, что концентрации реагирующих
веществ равны 1; k
иногда называют удельной
скоростью химической реакции.
Размерность константы скорости зависит
от порядка реакции.
Скорость реакции является функцией времени, так как количества реагирующих веществ меняются во времени. Введем понятие средней скорости реакции:
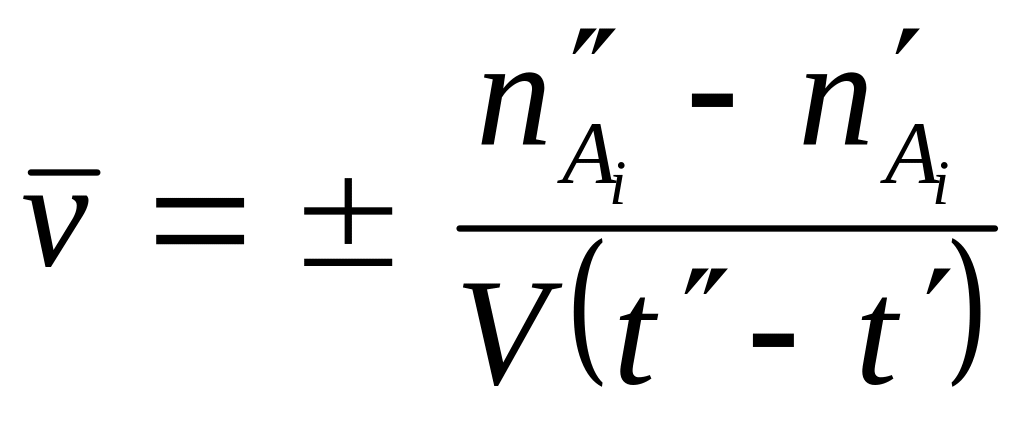 ,
,
![]() и
и
![]()
число молей одного из веществ в начальный
t
и конечный
t
моменты времени; V
объем системы. Знак «»
в выражении стоит тогда, когда мы следим
за ходом реакции по изменению количества
одного из исходных веществ, поскольку
в этом случае
,
а скорость реакции может быть только
положительной величиной. Знак «+»
используют, если скорость реакции
определяют по ее продукту.
число молей одного из веществ в начальный
t
и конечный
t
моменты времени; V
объем системы. Знак «»
в выражении стоит тогда, когда мы следим
за ходом реакции по изменению количества
одного из исходных веществ, поскольку
в этом случае
,
а скорость реакции может быть только
положительной величиной. Знак «+»
используют, если скорость реакции
определяют по ее продукту.
Если tt 0 , то получим истинную скорость v реакции (скорость реакции в данный момент времени):
v
=
![]() .
.
Если
V
= const,
то v
=
![]() .
.
Этим уравнением удобно пользоваться при рассмотрении реакций в растворах, так как изменением объема раствора в результате реакции во многих случаях можно пренебречь.
Для реакций, протекающих в газовой фазе, скорость можно определять также через парциальные давления веществ.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора.
Следует иметь в виду, что при вышеприведенном определении скорости химической реакции (число молекул, реагирующих в единицу времени в единице объема) числовое значение величины скорости реакции будет зависеть от того, какое вещество из участвующих в реакции мы выбрали, чтобы следить за ее скоростью, так как стехиометрические коэффициенты разных участников реакции могут отличаться друг от друга. Например, в реакции синтеза бромоводорода
Н2 + Br2 = 2HBr
за одно и то же время образуется в 2 раза большее число молей HBr, чем прореагирует молей Н2 и Br2 , и, следовательно, скорость реакции, определенная по бромоводороду, будет в 2 раза выше, чем скорость, определенная по водороду либо по брому:
![]() .
.
Чтобы устранить эту неопределенность, скорость реакции рассчитывают на единицу стехиометрического коэффициента, и тогда ее величина не зависит от того, по какому веществу ее определяют:
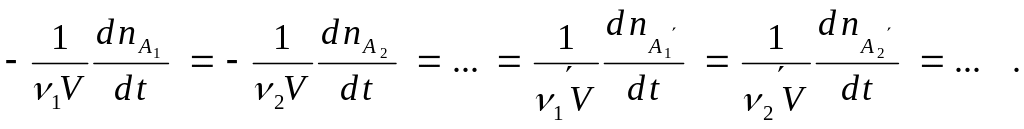
В общем виде можно записать
![]()
где
![]()
