
- •Часть II
- •Раздел IV. Химическая кинетика и катализ
- •Двусторонние и односторонние (обратимые и необратимые) реакции
- •Кинетическая классификация реакций. Молекулярность и порядок реакций
- •Необратимые реакции первого порядка
- •Необратимые реакции второго порядка
- •Необратимые реакции n-го порядка
- •Реакции нулевого порядка
- •Сложные реакции: обратимые, параллельные, последовательные
- •Обратимые реакции первого порядка
- •В момент равновесия скорости прямой и обратной реакций одинаковы:
- •Обратимые реакции второго порядка
- •В общем виде
- •Параллельные реакции
- •Последовательные реакции
- •Методы определения порядка реакций
- •Влияние температуры на скорость реакции
- •Применение теории столкновений к бимолекулярным реакциям. Расчет константы скорости
- •Типы бимолекулярных реакций
- •Теория активного комплекса (переходного состояния)
- •Обрыв цепи
- •Длина цепи и ветви
- •Кинетика неразветвленных цепных реакций
- •Разветвленные цепные реакции
- •Тепловой взрыв
- •Сопряженные реакции
- •Основные законы фотохимии. Квантовый выход
- •Основные типы фотохимических процессов
- •Зависимость скорости фотохимических реакций от температуры
- •Мономолекулярные и тримолекулярные реакции. Реакции в растворах Мономолекулярные реакции в газовой фазе
- •Тримолекулярные реакции в газовой фазе
- •Реакции в растворах
- •Методы изучения кинетики сложных реакций
- •Общие сведения о катализе. Гомогенный катализ. Катализ кислотами и основаниями Общие сведения о катализе
- •Гомогенные каталитические реакции
- •Общая схема расчета кинетики гомогенных каталитических реакций
- •Катализ кислотами и основаниями
- •Активационный процесс в гетерогенных реакциях
- •Активированная адсорбция
- •Кинетика гетерогенных каталитических реакций
- •Истинная и кажущаяся энергия активации гетерогенных химических реакций
- •Теория активных центров в гетерогенном катализе Отравление катализатора
- •Роль поверхности и пористость катализатора
- •Связь между энергией активации и предэкспоненциальным множителем
- •Недостаточность модели однородной поверхности в катализе и адсорбции
- •Мультиплетная теория катализа
- •Теория активных ансамблей
- •Электронные представления в гетерогенном катализе
- •Раздел V. Электрохимия
- •Предмет электрохимии
- •Проводники первого и второго рода
- •Электрохимические реакции
- •Законы электролиза (законы Фарадея)
- •Теория электролитической диссоциации Аррениуса
- •Недостатки теории Аррениуса
- •Причины диссоциации. Сольватация и гидратация Теплоты сольватации (гидратации)
- •Экспериментальные теплоты гидратации ионов
- •Модельные методы расчета энергии гидратации ионов
- •Энтропия сольватации ионов
- •Состояние ионов в растворах. Число сольватации
- •Распределение ионов в растворе
- •Теория электролитов Дебая и Гюккеля
- •Сопоставление теории Дебая – Гюккеля с опытом
- •Дальнейшее развитие теории
- •Удельная и эквивалентная электропроводность
- •Влияние природы растворителя на электропроводность
- •Подвижность ионов
- •Подвижность ионов гидроксония и гидроксила
- •Связь между подвижностью ионов и их концентрацией
- •Зависимость подвижности ионов от температуры
- •Числа переноса ионов
- •Диссоциация воды. РН растворов
- •Диссоциация слабых электролитов
- •Гидролиз солей
- •Буферные растворы
- •Амфотерные электролиты
- •Произведение растворимости
- •Гальванические элементы. Эдс
- •Термодинамика гальванического элемента
- •Измерение эдс
- •Строение границы электрод-раствор. Двойной электрический слой
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
- •Электродный потенциал
- •Стандартный электродный потенциал
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Определение коэффициентов активности электролитов
- •Определение рН раствора
- •Произведение растворимости
- •Потенциометрия
- •Ионоселективные электроды
- •Кинетика электрохимических процессов
- •Концентрационная поляризация
- •Электрохимическое перенапряжение
- •Напряжение разложения
- •Закономерности перенапряжения выделения водорода
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Теории водородного перенапряжения
- •Теория замедленной рекомбинации
- •Теория замедленного разряда
- •Электроосаждение металлов
- •Анодное растворение и пассивность металлов
- •Коррозия металлов. Борьба с коррозией
- •Кондуктометрия
- •Электроанализ и кулонометрия
- •Вольтамперометрические методы
- •Полярография. Нестационарная вольтамперометрия Классическая полярография
- •Следовательно, изменение приложенной извне разности потенциалов при выполнении измерений указанным образом равно изменению потенциала капельного электрода.
- •Теория метода
- •Твердые электроды в полярографии
- •Разновидности полярографических методов
- •Импульсная полярография
- •Осциллографическая полярография
- •Основные формулы и законы Формальная кинетика
- •Зависимость скорости реакции от температуры
- •Применение теории активных столкновений и теории активного комплекса к расчету констант скоростей реакций
- •Фотохимия
- •Ионное равновесие в растворах электролитов
- •Неравновесные явления в растворах электролитов: миграция и диффузия
- •Термодинамика гальванического элемента
- •Классификация электродов
- •Классификация электрохимических цепей
- •Аккумуляторы
- •Законы электролиза
- •Неравновесные электродные процессы
- •Оглавление
- •Физическая химия Курс лекций
- •Часть 2
- •Химическая кинетика, электрохимия
Теория метода
Рассмотрим более подробно явление концентрационной поляризации на капельном ртутном катоде при разряде ионов металла, например кадмия. При разряде ионов металла происходит образование амальгамы кадмия. Потенциал амальгамного электрода
Е
= Ео
+
![]() ln
ln
![]() ,
,
где c(s) – концентрация ионов кадмия в растворе около электрода, с(Ме) – концентрация амальгамы кадмия вблизи поверхности электрода.
Таким
образом, чтобы найти уравнение
концентрационной поляризации на
капельном ртутном электроде, необходимо
определить величины c(s)
и с(Ме)
в зависимости от протекающего тока.
Процесс диффузии к растущей сферической
поверхности значительно сложнее процесса
диффузии к неподвижному твердому
электроду. Так как поверхность капли
непрерывно увеличивается за период ее
существования и, следовательно, сила
тока, текущего через каплю в раствор,
растет, то вводится понятие средней за
период образования капли силы тока
![]() .
Как показывает точный расчет, величина
среднего тока диффузии на капельном
ртутном электроде
.
Как показывает точный расчет, величина
среднего тока диффузии на капельном
ртутном электроде
= 0,627 nFD1/2 m2/3 1/6 (co – c(s) ) = (co – c(s) ) , (1)
co и c(s) – концентрация ионов кадмия в объеме раствора и вблизи поверхности электрода соответственно, моль /см3;
n – число электронов, участвующих в электродной реакции;
D – коэффициент диффузии;
m – скорость вытекания ртути, мг/с;
– период выпадения капли, с;
– коэффициент, постоянный при данном режиме работы электрода.
Когда концентрация восстанавливающихся частиц у поверхности ртутной капли c(s) станет равной 0, диффузионный ток будет равен предельному диффузионному току. Средний предельный ток диффузии выражается уравнением
Д = co . (2)
Уравнения (1) и (2) носят название уравнений Ильковича и используются при количественном полярографическом анализе. Из уравнений можно определить значение c(s) :
c(s)
=
![]() (
Д
–
)
.
(3)
(
Д
–
)
.
(3)
Уравнения Ильковича позволяют также определять число электронов n, участвующих в электродной реакции, коэффициенты диффузии D, делать заключение о природе лимитирующей стадии и решать другие проблемы, относящиеся к области электрохимической кинетики.
Так как на поверхности ртути образуется амальгама, то в самой капле возникает ток от поверхности в глубь капли. Величина среднего диффузионного тока внутри ртути определяется уравнением, совпадающим по форме с уравнением (1):
= 0,627 nFDМе1/2 m2/3 1/6 c(Ме) = Ме c(Ме) , (4)
где DМе и c(Ме) относятся к атомам металла, растворенного в ртути.
Подставив (3) и (4) в выражение для Е, получим выражение для концентрационной поляризации на капельном ртутном электроде (уравнение Гейровского-Ильковича):
Е
= Е1/2
+
![]() ln
ln
![]() (5)
(5)
или для величины средней силы тока
=
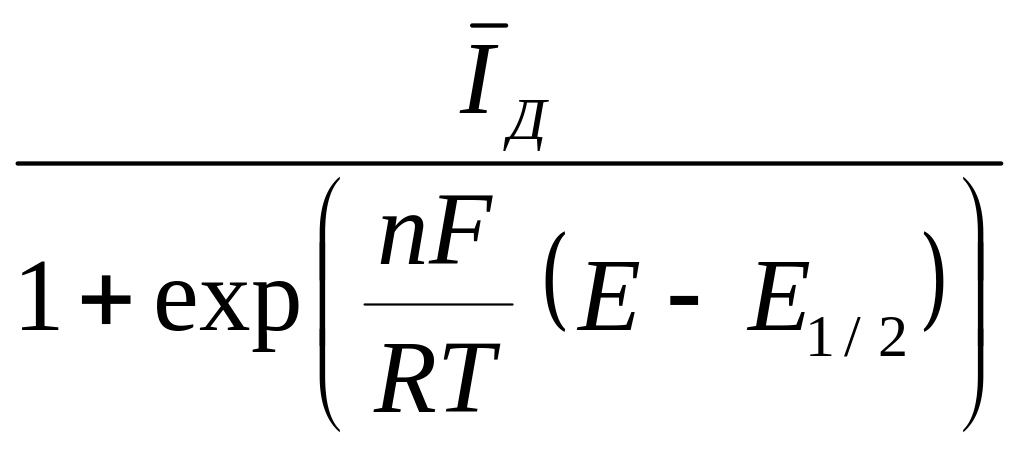 , (6)
, (6)
где
Е1/2
= Ео
+
ln
![]() = Ео
+
ln
= Ео
+
ln
![]() .
.
Как видно, величина Е1/2 – потенциал полуволны – зависит только от величины стандартного потенциала электрода и отношения коэффициентов диффузии атомов металла в амальгаме и ионов металла в растворе, то есть является величиной, зависящей лишь от природы реагирующего иона.
