
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Некоторые макроскопические свойства
1. Масса m, кг (г).
Аддитивность:
m
=
![]() для системы (однокомпонентной) , (1.26)
для системы (однокомпонентной) , (1.26)
m
=
![]() для многих компонентов , (1.27)
для многих компонентов , (1.27)
2. Объем V, м3, см3
V
=
![]() , (1.28)
, (1.28)
V
=
![]() . (1.29)
. (1.29)
3. Число молей nk (характеризует количество вещества).
![]() (1.1)
и
(1.1)
и
![]() .
(1.8)
.
(1.8)
На практике применяют уравнение (1.8), так как можно измерить массу компонента.
Суммируя по компонентам, получаем
![]() . (1.30)
. (1.30)
4. Удельный и мольный объемы чистого вещества
Vok
(т) =
![]() =
Vok
уд, (1.31)
=
Vok
уд, (1.31)
где Vok уд – удельный объем компонента k (чистого вещества), м3/кг, м3/г):
![]() , (1.32)
, (1.32)
Vok моль – мольный объем чистого вещества, м3/моль:
![]() ,
,
где mk = Mk nk , (1.33)
Vok моль = Vok (уд) Mk. (1.34)
Выражение для удельного и мольного объемов вещества можно получить, также используя понятие плотность экстенсивного свойства (массы). Плотность массы
=
![]() (1.35)
(1.35)
Плотность чистого вещества – ok , кг/м3 (г/см3) .
ok = mk/Vok , (1.36)
Плотность () – интенсивное свойство. В неоднородном поле оно имеет разные значения. В однородном поле – это постоянная средняя величина.
Тогда, используя прежнюю запись для удельного объема
Vok
(уд) =
![]() и ok
=
и ok
=
![]() ,
,
можно записать еще одно выражение для удельного объема чистого вещества
Vok (уд) = 1/ok . (1.37)
Можно записать также новые выражения для мольного объема чистого вещества
Vok
(моль)
=
 (1.38)
(1.38)
Vok (моль) = Mk Vok (уд) . (1.39)
Уравнение (1.39) – это уравнение связи между мольными и удельными объемами.
5. Удельный и мольный объемы многокомпонентной системы, мольная масса многокомпонентной системы:
аддитивные
свойства (1.40)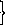
![]()
![]()
Отсюда
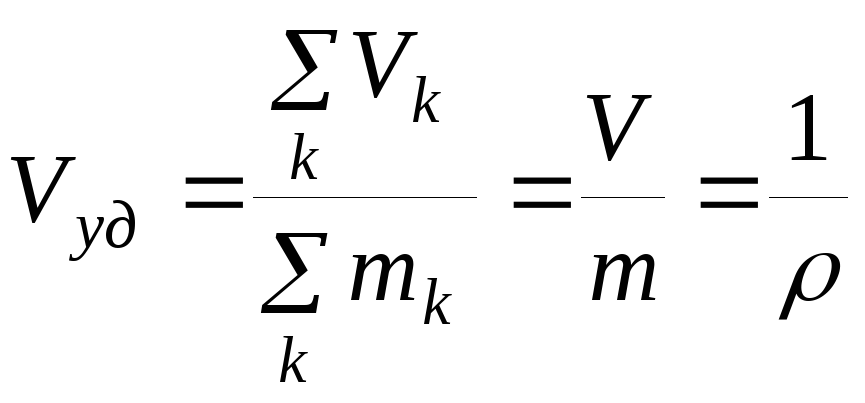 , (1.41)
, (1.41)
где – плотность системы.
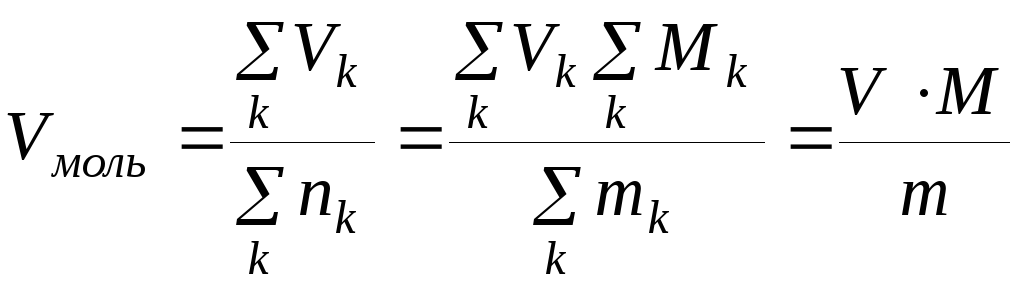 , (1.42)
, (1.42)
где М – мольная масса многокомпонентной системы
Мольная масса:
для чистого вещества
Mk = mk / nk, (1.43)
- для многокомпонентной системы
 ,
(1.44)
,
(1.44)
 (1.45)
(1.45)
Мольная доля компонента k:
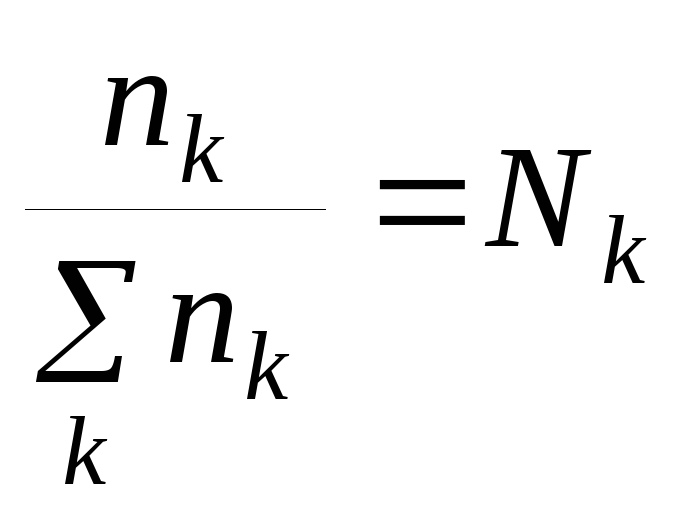 (1.46)
(1.46)
Тогда (1.45) с учетом (1.46) преобразуем в
![]() ,
(1.47)
,
(1.47)
где М – мольная масса многокомпонентной системы.
Поэтому с учетом (1.47) мольный объем можно записать в виде
![]() (1.48)
(1.48)
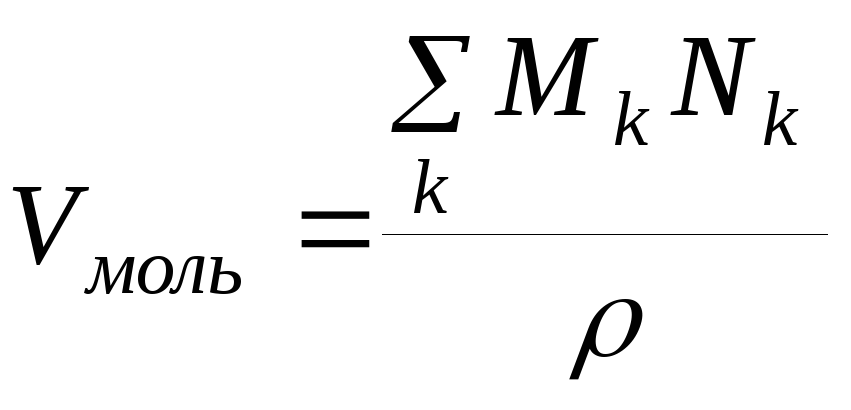 . (1.49)
. (1.49)
КОНТРОЛЬНЫЕ ВОПРОСЫ
Глава 2. Методы исследования строения вещества
2.1. КЛАССИФИКАЦИЯ МЕТОДОВ ИССЛЕДОВАНИЯ
Различают химические и физические методы исследования строения вещества. Химические методы основаны на процедурах анализа, синтеза и разложения веществ. Несмотря на их распространенность, они, однако, не позволяют узнать тонкие особенности строения молекул. Кроме того, они не всегда достаточно точны и экспрессны. Физические методы основаны на анализе взаимодействия вещества с внешними полями, средами, потоками элементарных частиц. В настоящее время это основные методы исследования.
Физические методы исследования целесообразно разделить на две группы:
эмпирические методы, методы I группы;
методы теретически обусловленные, методы II группы (рис. 2.1).
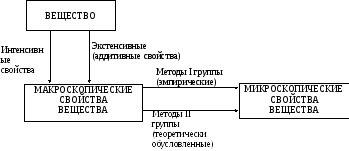
Рис. 2.1. Схема изучения свойств вещества физическими методами.
Поскольку, как уже говорилось, на практике приходится иметь дело не с отдельными частицами, а с большим их числом, на первом этапе исследований строения вещества изучаются макроскопические свойства. При этом непосредственному, прямому, измерению подвергаются экстенсивные (аддитивные) свойства, а интенсивные свойства измеряются – опосредованно (косвенно) через аддитивные. Второй этап исследования связан с расчетом микроскопических свойств на базе полученных сведений о макроскопических свойствах. Различают две группы методов определения микроскопических свойств. Первая группа методов обусловлена наличием связи эмпирического типа между макро– и микроскопическими свойствами. Вторая группа объединяет методы, которые основаны на наличии теоретически обусловленных связей первого типа. При изучении макроскопических свойств необходимо учитывать межмолекулярные взаимодействия.
2.2. МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ
Установлено, что между частицами компонентов имеется взаимодействие, которое называют межмолекулярным (ван-дер-ваальсовским). Силы Ван-дер-Ваальса являются весьма дальнодействующими силами (несколько Ǻ) и имеют электростатическую природу.
Различают несколько видов межмолекулярного взаимодействия.
1. Ориентационное взаимодействие (диполь-дипольное) – взаимодействие между двумя диполями (эффект Кьезома).
2. Индукционное взаимодействие – взаимодействие между наведенными диполями (эффект Дебая). Взаимодействие постоянного диполя одной молекулы и наведенного диполя второй молекулы понижает потенциальную энергию системы из двух диполей на величину Eинд – называемую энергией индукционного взаимодействия.

3. Дисперсионное взаимодействие (эффект Лондона) – это взаимодействие между мгновенными диполями.




неполярная частица – неполярная частица
При взаимодействии молекул движения электронов взаимосогласованы (частота осцилляций т. е. колебаний электронной плотности), в результате чего мгновенные диполи взаимодействуют и частицы притягиваются друг к другу. Взаимодействие в неполярных средах полностью обусловлено дисперсионными силами Лондона.
Т
Еотт
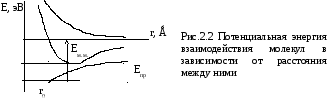
Несмотря на сходство кривых потенциальных энергий межатомного (рис. 1.2) и межмолекулярного (рис. 2.2) взаимодействий, между ними имеются существенные различия. Прежде всего, это касается равновесных расстояний, характеризующихся наибольшей энергией взаимодействий. Если образование химической связи происходит на коротких (ближних) расстояниях (rе 1Ǻ), то образование ассоциатов молекул – на более дальних расстояниях (r0 3 – 5 Ǻ и более). Это и понятно, поскольку образование химической связи сопровождается перекрыванием электронных облаков отдельных атомов, а образование ассоциатов сводится к дальнему взаимодействию. Глубина потенциальной ямы в случае межмолекулярных ван-дер-ваальсовых взаимодействий (Ем.м) значительно ниже по величине (примерно в 100 раз) энергии химической связи Есв. Для сравнения Есв имеет порядок величин 100 – 500 кДж/моль, а Ем.м 1 – 5 кДж/моль.
Однако «китайской стены» между химическим и физическим ван-дер-ваальсовым взаимодействием нет, поскольку природа взаимодействия одна и та же, электрическая. Иллюстрацией этого тезиса может служить водородная связь.
Это одна из разновидностей донорно-акцепторной связи, осуществляющейся между молекулами различных веществ, в состав которых входит водород. Точнее, это промежуточное взаимодействие между ван-дер-ваальсовым и донорно-акцепторным.
........... Н – x ........... Н – x ........... Н – x ........... Н – x ...........
(точечный пунктир – водородная связь).
В качестве х можно взять атомы с высокой электроотрицательностью (F, O, N, Cl и др.).
F
+
F
Н





 донор
акцептор
донор
акцептор
В
результате поляризации протона он
оголяется и вследствие своего ничтожно
малого размера поляризованного атома
водорода глубоко внедряется в электронную
оболочку соседнего отрицательно
поляризованного иона.
о
В то же время эта общая электронная пара находится, как бы на свободной 1S-ячейке водорода временно. Поэтому водородная связь – это связь слабая (Ев.св. 8 – 10 кДж/моль), и значительно уступает энергии химической связи, но в то же время она намного больше энергии ван-дер-ваальсового взаимодействия. Соответственно длина водородной связи составляет около 1,610-10 – 1,810-10 м (1,6 – 1,8 Å). Из этого следует, что при образовании водородной связи молекулы сближаются теснее, чем при действии сил Ван-дер-Ваальса.
Пример: структура воды
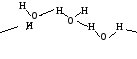
Рис.2.3 Водородные связи между молкулами воды
Водородная связь играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, в процессах жизнедеятельности. Такие вещества, как вода, лед, жидкий аммиак, органические кислоты, спирты, фенолы, ассоциированы в димеры, тримеры, полимеры и т. д.
Интенсивность межмолекулярных взаимодействий в большой степени зависит от агрегатного состояния вещества. Самой малой интенсивностью межмолекулярного взаимодействия обладают молекулы вещества в газообразном состоянии. Для разбавленных (идеальных газов) этими взаимодействиями обычно пренебрегают. При переходе вещества в конденсированное жидкое агрегатное состояние интенсивность межмолекулярного взаимодействия усиливается. При этом частицы вещества удерживаются на достаточно близком расстоянии друг от друга, колеблясь около равновесного положения в упорядоченном состоянии. Наконец, при переходе к твердому состоянию упорядоченность молекул вещества увеличивается (вплоть до образования кристаллических решеток), а межмолекулярные взаимодействия характеризуются высокой интенсивностью и действуют, как правило, наряду с химическими взаимодействиями.
2.3. МЕТОДЫ IГРУППЫ
Одна из наиболее распространенных методик этой группы основана на использовании приблизительно аддитивных свойств, т. е. свойств, которые претерпевали бы закономерные суммарные изменения при изменении структуры молекул вещества.
