- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
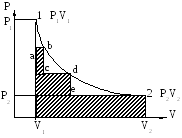
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Глава 6. Второе начало термодинамики
6.1. Самопроизвольные и несамопроизвольные
процессы
Процессы, в том числе и химические, подразделяют на обратимые и необратимые. Обратимые процессы характеризуются тем, что при протекании их в обратном направлении:
– система приобретает тот же ряд значений переменных, определяющих ее состояние, но в обратном порядке;
– обмен системы с окружающей средой координатами состояния происходит в обратном порядке, а параметры процесса имеют обратные знаки.
Таким образом, обратимый процесс - это процесс, идущий в прямом и обратном направлениях с одинаковыми, но противоположными изменениями без всяких потерь, независимо от отдельных состояний системы.
Рассмотрим в качестве примера механическую систему (см. рис.4.3). Если в начальном состоянии давление в системе Р1 больше давления в среде Р2, то при отключении стопора (включение механической степени свободы) поршень начнет двигаться слева направо до тех пор, пока давления в системе и среде не выравняются (Р1 = Р2) и система придет в состояние равновесия. При этом совершается работа по расширению газа. Если теперь провести процесс в обратном направлении, т.е. совершить работу по сжатию газа до начального давления Р1, то, казалось бы, можно получить обратимое изменение при условии, что поршень не испытывает трения со стенками цилиндра при своем движении - т.е. при создании "идеального поршня". На самом деле, для реального процесса работа сжатия газа больше работы его расширения на величину работы трения.
Подобная картина наблюдается и при расширении других систем (см. рис. 4.4 – 4.6), снабженных различными вентилями для регулирования интенсивности взаимодействия с окружающей средой. Процессы переноса обобщенных координат через вентили являются типично необратимыми, поскольку часть энергии при этом аккумулируется в вентилях, принадлежащих вместе с изолирующей оболочкой к окружающей среде, и, кроме того, сопровождаются увлечением других координат состояния.
Таким образом, все реальные процессы, происходящие в природе и технике, являются необратимыми. Обратимые процессы следует рассматривать как идеализированный предельный случай, к которому реальные процессы могут приближаться при соответствующих условиях.
Другое деление процессов – на равновесные и неравновесные, также в достаточной степени условно. Равновесным процессом принято считать обратимый процесс, проходящий через последовательный ряд равновесных состояний. Реальный процесс приближается к равновесному при условии достаточно медленного его проведения. Равновесный процесс можно определить как процесс, проходящий через бесконечно малые изменения параметров системы с бесконечно малой скоростью.
Покажем различия между равновесным и неравновесным процессами на примере закрытых механических систем (см. рис. 4.3). Допустим, что мы имеем сравнительную систему из двух цилиндров с поршнями, на одном из которых поставлены в качестве стопора гири, а на другом насыпан песок с той же массой. Объемы газа (одного и того же) одинаковы. При последовательном снятии гирь с поршня в первом цилиндре давление газа уменьшается на некоторую фиксированную величину и на пропорциональную величину возрастает объем газа. Соответствующая графическая зависимость давления газа от его объема будет представлять ломаную линию 1-а-b-c-d-e-2 (см. рисунок).