
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Меры количества компонентов в системе
За меру количества принимают число частиц компонента.
![]() (k
= 1,...,k)
– число частиц k-компонентов
от 1 до k.
(k
= 1,...,k)
– число частиц k-компонентов
от 1 до k.
![]() (k
= 1) – число
частиц компонента k.
(k
= 1) – число
частиц компонента k.
На практике обычно приходится иметь дело с большими числами частиц компонентов, порядка 1023 единиц. Их оценку удобно производить более крупной мерой, чем одна единица. Роль такой меры играет 1 моль = 6,021023 единиц (частиц). Число единиц (частиц) в 1 моле называется числом Авогадро (NА). NА = 6,0231023 моль-1.
Эталоном для воспроизводства 1 моля служит число ядер в 0,012 кг (12 г) чистого изотопа С12.
Очевидно,
что количество компонента «k»
nk,
выраженное в молях, или число молей
данного компонента связано с числом
его частиц
![]() соотношением:
соотношением:
![]() . (1.1)
. (1.1)
Отметим, что 1 моль может служить мерой количества не только компонентов, но и совокупности любых других частиц (например, ядер, электронов и др.) а также всяких дискретных объектов, актов (например, элементарных электрических зарядов, элементарных актов химических реакций и т. д.)
Другая мера количества k-компонента – масса mk k-го компонента:
![]() , (1.2)
, (1.2)
где mk – масса компонента «k»;
![]() –масса
всех частиц компонента «k»;
–масса
всех частиц компонента «k»;
![]() –масса
одной частицы;
–масса
одной частицы;
![]() –число
всех частиц.
–число
всех частиц.
Мольная масса компонента Mk в кг/моль в единицах СИ соответственно равна
![]() (1.3)
(1.3)
Из уравнения (1.2) получим массу одной частицы:
![]() . (1.4)
. (1.4)
В то же время из уравнения (1.3) следует, что
![]() . (1.5)
. (1.5)
Совместное решение уравнений (1.4) и (1.5) позволяет получить уравнение связи между массой mk компонента и его мольной массой Mk:
![]() (1.6)
(1.6)
то
есть ![]() и
и
![]() . (1.7)
. (1.7)
Тогда число молей компонентов может быть определено (в дополнение к уравнению (1.1)) из уравнения:
![]() . (1.8)
. (1.8)
Для характеристики массы отдельных частиц введена внесистемная углеродная единица (у. е.), равная 1/12 массы чистого изотопа С12:
1
у.е. =
![]() = 1,6604410-24
г = 1,660410-27
кг.
= 1,6604410-24
г = 1,660410-27
кг.
Углеродная единица массы и число Авогадро выбраны таким образом, что мольная масса компонента (г/моль) равна массе отдельной его частицы, выраженной в углеродных единицах. Например:
М(С6Н6)
=
![]() (С6Н6)
(С6Н6)![]() = (6
= (6![]() С
+ 6
С
+ 6![]() H)
H)
![]() = 78 у.е.
6,0231023
моль-1
1,6604 10-27
г/у.е.
= 78 г/моль
= 78 у.е.
6,0231023
моль-1
1,6604 10-27
г/у.е.
= 78 г/моль
Частицы компонентов состоят из еще более мелких частиц, или субчастиц. Совокупность таких мельчайших частиц одного и того же вида называют субкомпонентом системы. Если роль компонентов играют множества одинаковых частиц атомной или молекулярной природы, то субкомпонентами могут служить, например, множества электронов и одинаковых ядер, входящих в состав упомянутых частиц. Приведенные выше соотношения для компонентов распространяются и на субкомпоненты.
Частицы, составляющие компоненты, – химические частицы (молекулы). Таким образом, химические частицы – это ансамбли физических частиц (атомных ядер, электронов) и т. д. Частицы могут быть простыми и сложными (одно- и многоядерными).
Классы химических частиц
Валентно-насыщенные молекулы (Н2 , СО2 , Н2О и др.).
Молекулой называется наименьшая нейтральная частица данного вещества, обладающая его химическими свойствами и способная к самостоятельному существованию. Различают одно- и многоатомные молекулы.
2. Ионы (катионы, анионы).
Ион – заряженная частица, представляющая собой атом или группу химически связанных с избытком электронов (анионы) или с недостатком электронов (катионы). В веществе положительные ионы существуют вместе с отрицательными. Так как электростатические силы, действующие между ионами, велики, то невозможно создать в веществе сколько-нибудь значительный избыток ионов одного знака.
3. Радикалы.
Свободными радикалами называются частицы, обладающие ненасыщенными валентностями (например, СН3 или NH2)

В обычных условиях свободные радикалы, как правило, не могут существовать длительное время. Другими словами – свободные радикалы – это частицы, обладающие высокой реакционной способностью и содержащие неспаренные электроны.
1.2. МИКРОСКОПИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА
Признаки, характеризующие объект (компонент системы) с качественной и количественной стороны называют его свойствами.
Признаки, характеризующие отдельные черты объекта называются микроскопическими свойствами. Для компонентов – это черты, характеризующие строение вещества, т. е. распределение масс и зарядов для частиц атомно-молекулярной природы в пространстве. Эти свойства определяются строением отдельных атомов и характером их взаимодействия при образовании химической связи. К числу наиболее важных микроскопических свойств следует отнести:
межъядерное расстояние;
валентные углы (углы связи);
моменты инерции молекул;
дипольный момент;
энергию связи.
Химическая связь в основном осуществляется так называемыми валентными электронами. У s- и p-элементов валентными являются электроны внешнего слоя, а у d-элементов – электроны s-состояния внешнего слоя и d-состояния предвнешнего слоя. Как показывает экспериментальные данные, при химическом связывании атомов состояние электронов внутренних слоев практически не меняется.
Химическая связь образуется только в том случае, когда при сближении атомов (двух или большего числа) полная энергия системы (сумма кинетической и потенциальной энергий) понижается. Важнейшие сведения о строении молекул вещества дают зависимости потенциальной энергии системы от расстояния между составляющими ее атомами.
На рис.1.1 в качестве примера приведена кривая (1) потенциальной энергии для системы из двух атомов водорода. По оси абсцисс отложено расстояние между ядрами водорода r, а по оси ординат – потенциальная энергия системы Е.
Характер кривой можно объяснить следующим образом. По мере сближения атомов водорода между ними возникают электростатические силы двух типов – силы притяжения между ядром одного атома и электроном другого и силы отталкивания между ядрами и электронами разных атомов. На больших расстояниях начинают действовать в большей степени силы притяжения и потенциальная энергия системы понижается. Это понижение продолжается до некоторого расстояния re. При дальнейшем уменьшении расстояния между атомами начинают действовать силы отталкивания, которые достигают значительной величины при малых (меньше re) расстояниях между атомами.
Е,
кДж/моль
-400
1
2
3






800
Отталкивание
400
0
r, Å
Притяжение



Eсв
re
Рис. 1.1 Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами:
1 – ;
2 - ;
3 - .
Минимум на кривой потенциальной энергии отвечает наиболее устойчивому состоянию системы из двух атомов водорода – равновесному межъядерному расстоянию re, равному 0,74Ǻ, т. е. образованию молекулы Н2. Указанное расстояние между ядрами водорода в молекуле Н2 заметно меньше суммы радиусов двух свободных атомов водорода (1,06Ǻ). Объясняется это тем, что возникновение молекулы водорода из атомов водорода сопровождается перекрыванием атомных электронных облаков с образованием молекулярного облака, которое окружает два положительно заряженных ядра. Расстояния между центрами ядер re атомов в каждой отдельной молекуле вещества представляет собой вполне определенные величины – это те равновесные расстояния, на которых силы притяжения между ядрами уравновешиваются силами отталкивания.
Мерой прочности связи в молекуле может служить как количество энергии, затрачиваемой на ее разрыв, так и величина, которая при суммировании по всем связям дает энергию образования молекулы из атомов.
Для двухатомных молекул энергия связи равна величине энергии диссоциации молекул на атомы и имеет положительные значения. Энергия образования связи Есв по величине та же, но имеет отрицательный знак, поскольку образование молекулы вещества сопровождается выигрышем энергии. Последнее наглядно иллюстрируется на рис.1.1, из которого видно, что на кривой потенциальной энергии имеет место минимум энергии, соответствующий равновесному межъядерному расстоянию.
Геометрическая характеристика двухсторонней молекулы определяется межъядерным расстоянием. Для многоатомной молекулы равновесную конфигурацию можно описать межъядерным расстоянием и углами между связями (валентными связями).
Углы связи – определяются электронным строением атомов и их взаимным расположением.
Пример: молекула Н2О
О

 8 Н1
8 Н1
2P

2S

1S
Рис 1.2
При взаимодействии двух атомов кислорода и одного атома водорода образуется молекула воды
+
+
Н
Н
О
104,5о








Рис. 1.3
В процессе возникновения связи первоначальная форма электронных облаков изменяется и образуются новые орбитали одинаковой формы. Это явление носит название гибридизации электронных орбиталей. Угол при гибридизации близок к 109О. Для молекулы воды НОН = 104,5о.
Обобщенной геометрической характеристикой двухатомных и многоатомных молекул служат моменты инерции молекул, которые характеризуют распределение масс отдельных ядер молекул в пространстве.
В общем случае молекула может иметь несколько ядер (несколько субкомпонентов) с массами ms, удаленными от оси вращения на расстояния rs, причем полное вращение можно разложить на вращения вокруг трех взаимно перпендикулярных осей (x,y,z). Тогда момент инерции относительно каждой оси.
![]() (1.9)
(1.9)
Момент инерции Je данной молекулы остается постоянным, независимо от скорости и энергии вращения, если пренебречь колебательным движением ядер атомов (модель жесткого ротатора).
Если начало координат совпадает с центром тяжести молекулы О/, то моменты инерции Jx, Jy, Jz, называются главными моментами инерции.
Т а б л и ц а 1.1
Классификация многоатомных молекул по моментам инерции
|
|
Тип молекулы |
Момент инерции |
Примеры |
|
I |
Линейная |
Jx=0; Jy=Jz |
CO, BrCl, NaCl многоат. HCN, N2O, CO2 |
|
II |
Сферический волчок |
Jx=Jy=Jz |
CH4, CCl4 – тетраэдр, SF6 –октаэдр |
|
III |
Симметричный волчок |
Jx= Jy Jz |
NH3, PCl3, CHCl3, CH3Cl, C6H6,CH3C CH |
|
IV |
Асимметричный волчок |
Jx Jy Jz |
H2O, SO2, CH3OH, C2H3Cl, SO3, CH2O, CH2Cl2 |
I. К первому типу относятся молекулы, содержащие некоторые элементы II группы (например, BeCl2, ZnBr2, CdJ2). Такой же конфигурацией обладают некоторые молекулы с неодинаковыми межъядерными расстояниями (в частности HCN).
II. Тетраэдрическое строение типично для углерода и его аналогов по IV группе. Октаэдрическая структура – SF6, HF6.
III. Пирамидальной формой обладает NH3, PCl3 и другие соединения p–элементов V группы.
IV. Многие соединения p–элементов VI группы (SO2,, H2O и др.). H2S, H2Se, H2Te.
Рассмотрим выше перечисленные типы молекул подробнее.
Линейные молекулы. Наиболее простые выражения моментов инерции получаются для двухатомных молекул. Для двухатомных молекул имеются два равных по величине момента инерции относительно двух взаимно перпендикулярных осей z и y, не совпадающих с осью молекулы: Jz=Jy. Момент инерции Jx равен нулю из–за чрезвычайно малых собственных размеров ядер.
Гомоядерная двухатомная молекула (симметричная).
Пример: молекула H2


r1 = r2 , (1.10)
re = rH-H = r1 + r2 , (1.11)
Je = 2mH r12 , (1.12)
(
Je=
mH
(re/2)2
+ mH
(re/2)2
= 1/2 mHre2
Гетероядерная двухатомная молекула (асимметричная).
Пример: молекула СО

Центр тяжести расположен так, что
r1 m1 = r2m2 . (1.14)
Так как re = r1 + r2 , то легко видеть, что
r1 = m2/(m1 + m2) re , (1.15)
r2 = m1/(m1 + m2) re . (1.16)
Момент инерции Jе для двухатомной молекулы определяется по уравнению:
Je = ms rs2 = m1r12 + m2r22 . (1.17)
П
Je
= re2/(1/m1+1/m2)
=
re2
, , (1.18)
где – приведенная масса молекулы
= m1m2/(m1+m2) (1.19)
или
1/ = 1/m1 + 1/m2 .
Приведенная масса есть такая эквивалентная масса, которая, будучи помещена на расстоянии re от оси вращения, приводит к той же величине момента инерции, что и две массы m1 и m2 на расстоянии re.
Смысл приведенной массы поясняет рисунок




Для практических расчетов удобно пользоваться формулой:
1 у. е.
= 1,6610-27
А1А2/(А1+А2)
, (1.20)
= 1,6610-27
А1А2/(А1+А2)
, (1.20)
где - приведенная масса, кг;
А1 и А2 – атомные массы ядер;
1,6610-27 – численный коэффициент – атомная единица (углеродная единица) массы в кг.
Можно выразить Je через приведенную массу, и для гомоядерной двухатомной молекулы получаем
Je= 1/2 m re2 = re2 . (1.21)
Молекулы типа сферического волчка. Для этих молекул главные моменты инерции относительно трех пространственных осей равны Jx = Jy = Jz. Сюда относятся молекулы тетраэдрического строения.
П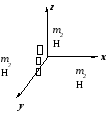 ример:
молекула (СН4)
ример:
молекула (СН4)
 Тетраэдр
Тетраэдр
 Jx
= Jy
= Jz
= 8/3 mH
r2C-H
Jx
= Jy
= Jz
= 8/3 mH
r2C-H
угол при С – 109о28
r1-2
