
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
4.3. Особенности энтропии как обобщенной координаты
Единственной обобщенной координатой, для которой не выполняются равенства (4.8) и (4.9), а в уравнении баланса (4.7) слагаемое digm, обусловленное процессами внутри системы, не равно нулю, является энтропия (S). Гипотеза, согласно которой на энтропию не распространяется закон сохранения обобщенных координат, занимает одно из центральных мест среди исходных положений термодинамики.
По определению (Больцман, 1896 г.) энтропия системы является мерой вероятности ее состояния. Наблюдаемое состояние системы (макроскопическое) может существовать при различном распределении частиц компонентов в пространстве и различных величинах энергии каждой конкретной частицы атомно-молекулярной природы, т.е. оно реализуется разными микросостояниями. Исходя из этого, энтропии можно дать также определение меры числа микросостояний макроскопической системы.
Говоря о вероятности того или иного состояния системы, следует помнить, что термодинамическое понятие вероятности отличается от математического. Термодинамической вероятностью называют число микросостояний, соответствующих данному макросостоянию. Формула для расчета термодинамической вероятности выведена в комбинаторной алгебре:
= N! / N1! . N2! . ... . Ni! , (4.10)
где N (N = 1, ..., Ni) - число частиц в отдельных областях системы (в подсистемах), а знак факториала означает произведение N! = 1.2.3. ... .N (0!= 1).
Для иллюстрации рассмотрим два макросостояния системы из шести различных по своей природе компонентов системы, которые могут распределяться по трем подсистемам:
Первый вариант - все шесть частиц компонентов находятся в одной подсистеме.

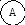
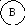
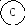
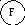
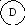
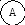
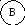
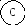
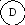
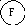
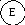

Второй вариант - частицы компонентов распределены равномерно по всем трем подсистемам, например:

Число микросостояний, соответствующих первому варианту макросостояния, равно единице ( = 6! / 6! . 0! . 0! = 1). Для второго макросостояния расчет дает = 6! / 2! . 2! . 2! = 720 / 8 = 90.
Из расчетов следует, что для шести частиц компонентов равномерное их распределение в объеме системы в 90 раз более вероятно, чем крайнее неравномерное. При большем числе частиц различия еще сильнее. Так, для N = 9 и i = 3 вероятность равномерного распределения = 1680.
Между термодинамической вероятностью и энтропией имеется связь, постулированная Больцманом:
S = k ln , (4.11)
где k - постоянная Больцмана, равная отношению R / NA;
R - универсальная газовая постоянная;
NA - число Авогадро.
Уравнение (4.11) показывает, что возрастание энтропии соответствует переходу системы к состоянию с большей вероятностью (и наоборот). При взаимодействии системы с окружающей средой энтропия может изменяться как за счет теплообмена системы с окружающей средой (следствие изменения теплового броуновского движения частиц), так и за счет физических и химических процессов внутри системы (следствие изменения числа взаимодействий частиц компонентов). При изоляции системы от окружающей среды deS = 0 (отсутствует тепловое взаимодействие со средой); при протекании процессов, связанных с изменение числа частиц и их взаимодействий, diS 0. Таким образом, из самого определения энтропии, данного Больцманом, вытекает условие несохраняемости энтропии как обобщенной координаты.
4.4. Виды взаимодействий системы с окружающей средой
Механическое взаимодействие. Этим термином обычно называют деформационное взаимодействие между объектами, выражающееся в сжатии одного из них и расширении другого. Обобщенной координатой в этом виде взаимодействия является объем V. Это позволяет толковать данное взаимодействие как перенос объема от среды к системе или наоборот. Объему присущи все признаки обобщенных координат - аддитивность и сохраняемость. Роль обобщенного потенциала играет давление P. Оба эти сопряженные свойства системы относятся к измеряемым на опыте величинам.
Массовое взаимодействие. Оно известно также под названием массообмена. Этот вид взаимодействия выражается в переносе массы от одного объекта к другому. Таким образом, обобщенной координатой массового взаимодействия является масса m. Она относится к измеряемым на опыте свойствам объектов; ее аддитивность и сохраняемость имеют надежное экспериментальное подтверждение.
При массообмене между системой и окружающей средой, а также между областями системы, носителями массы служат частицы компонентов. При этом каждый компонент ведет себя как независимый участник массообмена. Отсюда массовое взаимодействие реализуется в виде совокупности независимых процессов переноса массы отдельными компонентами, а роль координат играют массы компонентов mk (k = 1, ..., K).
Величина
mk
определяется суммой масс mk'
всех
![]() частиц, образующих данный компонент,
частиц, образующих данный компонент,
mk
=
![]() mk'
= mk'
mk'
= mk'![]() =mkNAnk
(4.12)
=mkNAnk
(4.12)
с учетом выражения
nk
=
![]() /NA,
/NA,
где nk - число молей компонента; NA - число Авогадро.
Масса одного моля частиц вида k равна
Mk = mk' NA (4.13)
и называется мольной массой k-го компонента.
Ясно, что
mk = Mk nk . (4.14)
Дифференциальное балансовое уравнение для mk имеет вид
dmk = demk + dimk (4.15)
подобно уравнению (4.7).
Сумма масс всех компонентов, составляющих систему, всегда равна массе системы:
m = mk . (4.16)
Уравнение (4.16) является еще одним свидетельством аддитивности массы. Принимая во внимание закон сохранения массы системы (сохраняемость массы), получаем:
dm = dem = demk ; (4.17)
dim = dimk = 0. (4.18)
Равенство (4.18) свидетельствует, что химическое превращение внутри системы не изменяет общей массы системы; оно приводит лишь к ее перераспределению между компонентами.
Согласно равенству (4.14) масса любого компонента прямо пропорциональна его числу молей (коэффициент пропорциональности - мольная масса данного компонента). Благодаря этому имеется возможность использовать в термодинамических уравнениях вместо масс компонентов число их молей. Однако это качественно разные понятия. Особенно ярко их различие проявляется в способности к сохранению. Общее число молей системы n в противоположность массе m не обладает способностью оставаться неизменным в изолированной системе (din 0).
Как независимый участник массового взаимодействия каждый компонент помимо массы mk характеризуется массовым потенциалом к,уд, называемым часто удельным химическим потенциалом. Массовые потенциалы принадлежат к неизмеряемым на опыте свойствам объектов и рассчитываются как парциальные величины. Если для описания массового взаимодействия привлекается число молей компонентов nk, то с ним в паре используется обобщенная координата к,моль, называемая мольным химическим потенциалом.
Физический смысл химического потенциала можно определить как способность данного компонента выйти из фазы (раствора). Чем сильнее компонент связан в системе, тем ниже его химический потенциал, т.е. меньше приращение числа молей данного компонента в процессе массообмена.
Электрическое взаимодействие – перенос электрического заряда от одного объекта к другому. Следовательно, свойством объектов, играющих роль обобщенной координаты данного взаимодействия, является электрический заряд g. Он является измеряемой на опыте величиной; его аддитивность и сохраняемость подтверждены всеми без исключения наблюдениями, проводившимися до сих пор.
Среди известных обобщенных координат электрический заряд является единственным, который проявляет себя в двух формах - положительной и отрицательной. Кроме того, электрический заряд отчетливо обнаруживает свою дискретность, состоящую в том, что он является кратным некоторой постоянной величине е, получившей название элементарного электрического заряда, или кванта заряда. Как показывает опыт, абсолютные значения величины разноименных элементарных зарядов равны, т.е. |e+| = |e-| , это равенство выполняется с точностью до 10-20|e |.
Подобно массе, электрический заряд жестко связан с его носителем – частицами компонента или субкомпонента. Электрическое взаимодействие подобно массовому взаимодействию реализуется в виде независимых друг от друга процессов переноса электрического заряда отдельными компонентами. Поэтому его описание требует введения для каждого компонента k электрического заряда gk, который определяется как сумма электрических зарядов gk' всех частиц вида k:
gk
=
![]() gk'
= gk'
gk'
= gk'![]() . (4.19)
. (4.19)
С учетом двух форм электрического заряда и его дискретности имеем:
для положительно заряженного компонента k+
gk+
= gk+'
![]() = e+Zk+
= e+Zk+
![]() ;
(4.20)
;
(4.20)
для отрицательно заряженного компонента k-
gk-
= gk-'
![]() = e-Zk-
= e-Zk-
![]() ;
(4.21)
;
(4.21)
для электронейтрального компонента
gk0
= gk0'
![]() '
= 0,
(4.22)
'
= 0,
(4.22)
где Zk+ и Zk- - числа(оба положительные и целые) элементарных электрических зарядов у частиц видов k+ и k- соответственно.
В дальнейшем для сокращения записи знаки зарядовых чисел указывать не будем:
gk
= e
zk
![]() .
(4.23)
.
(4.23)
Переходя от числа частиц данного компонента к его числу молей и массе, получаем
gk = FZknk = F(Zk/Mk)mk , (4.24)
где величина F = eNА представляет собой электрический заряд одного моля элементарных зарядов (мольный электрический заряд) и называется числом Фарадея.
Уравнение (4.24) дает возможность находить электрический заряд любого компонента по числу молей или массе данного компонента.
Баланс величины gk определяется дифференциальным уравнением:
dgk = degk + digk , (4.25)
где в соответствии с уравнением (4.24)
degk = Fzkdenk = F(Zk/Mk)demk ; (4.26)
digk = Fzkdink = F(Zk/Mk)dimk . (4.27)
Электрический заряд системы в целом благодаря своей аддитивности равен сумме электрических зарядов компонентов:
g
=
![]() gk
= F
gk
= F![]() Zknk
= F
Zknk
= F![]() (Zk/Mk)mk
. (4.28)
(Zk/Mk)mk
. (4.28)
Отсюда с учетом закона сохранения электрического заряда системы имеем:
dg
= deg
=
![]() degk
= F
degk
= F![]() Zkdenk
= F
Zkdenk
= F![]() (Zk/Mk)demk
; (4.29)
(Zk/Mk)demk
; (4.29)
dig
=
![]() digk
= F
digk
= F![]() Zkdink
= F
Zkdink
= F![]() (Zk/Mk)dimk
= 0. (4.30)
(Zk/Mk)dimk
= 0. (4.30)
Как видно, процессы внутри системы, включая химические превращения, способны привести лишь к перераспределению электрического заряда между компонентами, не изменяя его величины.
Для каждого компонента как независимого носителя электрического заряда следовало бы ввести в качестве обобщенного потенциала свой электрический потенциал к. Однако величины типа к не обладают той индивидуальностью, какая присуща массовым потенциалам к,уд и к,моль. Их поля в совокупности образуют единое поле электрического потенциала , в одинаковой мере принадлежащего всем компонентам.
Таким образом, роль обобщенного потенциала электрического взаимодействия по любому компоненту играет один и тот же электрический потенциал . Он относится к измеряемым на опыте свойствам. Среди известных обобщенных потенциалов он является единственным, выступающим в двух противоположных формах - положительной и отрицательной. Таким образом, оба сопряженных свойства электрического взаимодействия g и могут принимать как положительные, так и отрицательные значения.
Термическое взаимодействие. Роль обобщенной координаты данного вида взаимодействия играет энтропия S. Таким образом, термическое взаимодействие выражается в переносе энтропии от одного объекта к другому. В отличие от массы m и заряда g, при взаимодействии системы с окружающей средой ее передача возможна без переноса частиц компонентов через разделяющую контрольную поверхность.
Баланс величины S определяется дифференциальным соотношением:
dS = deS + diS . (4.31)
При отсутствии процессов внутри системы (diS = 0) все изменение энтропии связано лишь с переносом этой обобщенной координаты через контрольную поверхность: dS = deS. Тогда в качестве обобщенного потенциала термического взаимодействия между системой и окружающей средой выступает температура Т. В отличие от энтропии, температура принадлежит к измеряемым на опыте величинам.
4.5. Степени свободы. Модели систем
Условимся, что каждому взаимодействию между системой и окружающей средой соответствует такого же вида степень свободы системы. Например, механическому взаимодействию отвечает механическая степень свободы системы, термическому взаимодействию – термическая степень свободы и т.д.
Наличие и отсутствие у системы каких-либо степеней свободы часто указывается с помощью специальных терминов. Так, если система обладает только термической и механической степенями свободы, то она называется термомеханической. Система, лишенная всех степеней свободы, как указывалось ранее, называется изолированной. При отсутствии у системы массовой степени свободы ее принято называть закрытой.
Характер изменений, происходящих во взаимодействующих объектах, существенно зависит от интенсивности процессов переноса обобщенной координаты от одного из них к другому. Поэтому важно как с теоретической, так и с практической точки зрения располагать средствами регулирования интенсивности взаимодействий между объектами. Такие средства известны под названием вентилей и изоляций. Каждому виду взаимодействия соответствует свой вентиль и изоляция.
Предполагается, что обобщенные координаты и потенциалы могут выступать в двух противоположных формах - положительной и отрицательной. Условимся считать, что если самопроизвольный перенос обобщенной координаты происходит в сторону убывания абсолютной величины сопряженного с ней обобщенного потенциала, то координата и потенциал имеют одинаковые знаки. Это соглашение назовем правилом направления самопроизвольного переноса обобщенных координат, кратко – правилом переноса. Оно позволяет установить, в одинаковых или разных формах выступает координата и сопряженный с ней потенциал.
Механическая степень свободы. Система полностью изолирована от окружающей среды, за исключением возможности механического взаимодействия. Механический вентиль, регулирующий интенсивность такого взаимодействия, представлен на рис. 4.3. Его примером является поршень в цилиндре, снабженный регулирующим тормозным устройством (цилиндр и поршень изготовлены из нетеплопроводного материала).
 Как
сопряженные свойства механического
взаимодействия объемV
(обобщенная координата) и давление P
(обобщенный потенциал) проявляют себя
лишь в одной из своих форм, причем
самопроизвольный перенос объема
происходит всегда в сторону возрастания
абсолютной величины давления (чем больше
давление, тем меньше объем). Это позволяет
заключить, опираясь на правило переноса,
что их формы противоположны. Мы будем
придерживаться варианта с положительным
объемом и отрицательным давлением. Для
обозначения давления как потенциала
механического взаимодействия в его
отрицательной форме обычно употребляют
символ - P
(где P
- абсолютная величина давления).
Как
сопряженные свойства механического
взаимодействия объемV
(обобщенная координата) и давление P
(обобщенный потенциал) проявляют себя
лишь в одной из своих форм, причем
самопроизвольный перенос объема
происходит всегда в сторону возрастания
абсолютной величины давления (чем больше
давление, тем меньше объем). Это позволяет
заключить, опираясь на правило переноса,
что их формы противоположны. Мы будем
придерживаться варианта с положительным
объемом и отрицательным давлением. Для
обозначения давления как потенциала
механического взаимодействия в его
отрицательной форме обычно употребляют
символ - P
(где P
- абсолютная величина давления).

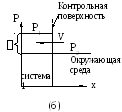
Рис. 4.3. Модель механического взаимодействия (а) и схема переноса обобщенной координаты V (б):
1 – изоляция; 2 – цилиндр; 3 – поршень; 4 – стопор
В приложении к давлению неравенство (4.4) приобретает вид Р 0 и соответствует необходимому условию механического взаимодействия, а равенство (4.5) - в виде Р = 0 соответствует условию отсутствия такого взаимодействия.
Термическая степень свободы. Выступая в роли сопряженных свойств термического взаимодействия системы с окружающей средой, энтропия S и температура Т проявляют себя только в одной из своих форм, причем самопроизвольный перенос энтропии происходит в сторону убывания абсолютной величины температуры.
(а) В
качестве вентиля, регулирующего это
взаимодействие, могут, например, выступать
пластины с различной теплопроводностью
(рис. 4.4).
В
качестве вентиля, регулирующего это
взаимодействие, могут, например, выступать
пластины с различной теплопроводностью
(рис. 4.4).
Рис. 4.4. Модель термического взаимодействия (а) и схема переноса обобщенной координаты S (б):
1 – теплопроводящие пластины; 2 – изоляция
Массовая степень свободы. В качестве массового вентиля по какому-нибудь электронейтральному компоненту выступает набор взаимозаменяемых мембран, проницаемых только для данного компонента и имеющих разную массопроводность по этому компоненту за счет различий в их толщине и размерах пор.
Сопряженные свойства этого взаимодействия - химический потенциал уд и масса компонента m имеют, подобно сопряженным свойствам термического взаимодействия, одинаковые знаки, поскольку перенос массы компонента происходит в направлении убывания абсолютной величины химического потенциала (рис. 4.5).
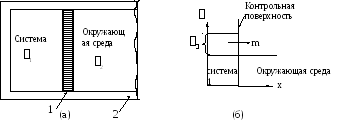
Рис. 4.5. Модель массового взаимодействия (а) и схема переноса обобщенной координаты m (б): 1 – полупроницаемая мембрана, 2 - изоляция
Электрическая степень свободы. В качестве электрического вентиля могут выступать полупроницаемые мембраны, позволяющие проникать через них какому-нибудь заряженному компоненту. Перенос обобщенной координаты - заряда g становится возможным при возникновении градиента электрического потенциала, для чего полупроницаемая мембрана помещается в электрическое поле (рис. 4.6).

Рис. 4.6. Модель электрического взаимодействия (а) и схема переноса обобщенной координаты q (б): 1 – мембрана, 2 - изоляция
В заключение приведем сводку сопряженных свойств обобщенных координат и потенциалов для различных видов взаимодействий (см. таблицу).
Сопряженные свойства различных видов взаимодействий
|
|
Виды взаимодействия | |||
|
механическое |
термическое |
массовое |
электрическое | |
|
Обобщенные потенциалы |
-Р (0) Па, Н/м2, Дж/м3 |
Т (0), К |
к уд (0), Дж/кг к моль (0), Дж/моль |
( ), B |
|
Обобщенные координаты |
V (0), м3 |
S (0), Дж/К |
mk (0), кг nk (0), моль |
g ( ), Кл |
4.6. Эффекты увлечения одних
обобщенных координат другими
В реальности между отдельными видами взаимодействия имеются тесные связи, состоящие в том, что перенос какой-либо координаты от одного объекта к другому одновременно сопровождается переносом некоторых других координат, независимо от наличия или отсутствия движущих сил для переноса последних. Назовем это эффектом увлечения одних обобщенных координат другими.
Перенос данной координаты будем считать самопроизвольным, если он совершается под действием градиента или напора сопряженного с ней потенциала, и вынужденным, если он обусловлен увлечением ее другими координатами. Самопроизвольный и вынужденный переносы одной и той же координаты суть независимые друг от друга процессы; они могут происходить одновременно и иметь как одинаковые, так и разные направления.
В качестве примеров увлечения одних координат другими можно назвать:
перенос электрического заряда компонентов их массами;
перенос масс заряженных частиц компонентов за счет электрического заряда;
перенос энтропии массами или зарядами частиц компонентов.
Так, рассматривая самопроизвольный перенос электрического заряда g под действием напора сопряженного с ним электрического потенциала (см. рис. 4.6), нельзя исключить вынужденный одновременный перенос массы m компонентов и энтропии S за счет изменения числа частиц компонентов в системе. Таким образом, изображенная на рис. 4.6 модель является в достаточной степени идеализированной, без учета вынужденных переносов других координат.
Исходя из сказанного, можно записать приращение degm m-й обобщенной координаты системы в виде суммы двух независимых слагаемых degm,сам и degm,вын, первое из которых обусловлено самопроизвольным переносом, а второе - вынужденным переносом через контрольную поверхность системы:
degm = degm,сам + degm,вын . (4.32)
Выразим слагаемое degm,вын через приращения degS,сам любой из обобщенных координат (S), кроме m-й, с помощью соотношения
degm,вын = Lm,SdegS,сам, (4.33)
где L - коэффициент увлечения координаты вида m координатой вида S.
Тогда на основе уравнений (4.32) и (4.33) для массы k-го компонента получаем:
demk = demk,сам + demk,вын, (4.34)
где demk,вын = Lmk,gkdegk,сам (4.35)
Уравнения (4.34) и (4.35) показывают, что масса k-го компонента mk может переноситься как самопроизвольно (под действием сопряженного с ней химического потенциала к,уд), так и вынужденно - за счет ее увлечения электрическим зарядом gk.
Соответственно для электрического заряда k-го компонента имеем
degk = degk,сам + degk,вын, (4.36)
где degk,вын = Lgk,mkdemk,сам . (4.37)
Совместное рассмотрение уравнений (4.34) (4.37) показывает, что масса и электрический заряд k-го компонента подвергаются взаимному увлечению.
Коэффициенты увлечения Lmk,gk и Lgk,mk могут быть получены из уравнения связи между электрическим зарядом и массой k-го компонента (4.24), согласно которому
demk,вын = (Mk / Fzk) degk,сам; (4.38)
degk,вын = (Fzk / Mk) demk,сам . (4.39)
Сопоставляя равенства (4.38) и (4.39), находим:
Lgkmk = 1 / Lmkgk = F (zk / Mk). (4.40)
Из приведенных уравнений вытекает, что полное приращение degk электрического заряда k-го компонента линейно выражается через полное приращение demk массы того же компонента:
degk = F (zk / Mk) demk . (4.41)
Как и следовало ожидать, полученный результат совпадает с уравнением (4.26).
Применительно к энтропии уравнения (4.32) и (4.33) приобретают вид:
deS = deSсам + deSвын; (4.42)
deSвын = Lsmkdemk.сам = deSмасс . (4.43)
Уравнение (4.43) получено благодаря уравнениям связи (4.38) и (4.39) и выражает вынужденное приращение энтропии через приращение массы компонентов.
Самопроизвольный перенос энтропии deSсам в уравнении (4.42) есть не что иное, как проявление теплового взаимодействия (теплообмена) между объектами под действием градиента сопряженного с ней потенциала температуры. Это означает, что deSсам = deSтепл.
Таким образом, полное приращение энтропии системы может быть представлено в виде
deS = deSтепл + deSмасс , (4.44)
где слагаемое deSтепл обусловлено теплообменом, а слагаемое deSмасс - массообменом между системой и окружающей средой.
4.7. Меры взаимодействия. Работа и теплота
Для количественной оценки взаимодействий различного вида и их сравнительного анализа необходимо располагать общей для них мерой. Роль такой меры играет обобщенная работа, которая в общем виде выражается дифференциальным соотношением:
Аm = Pmdegm, (4.45)
где Аm - элементарная работа, связанная с переносом обобщенной координаты вида "m" degm (имеет смысл не изменения, а бесконечно малого количества работы, связанного с переносом через контрольную поверхность бесконечно малого количества обобщенной координаты под действием градиента сопряженного с ней обобщенного потенциала Рm).
Равенство (4.45) налагает определенные условия на единицы измерения пары сопряженных свойств gm и Pm: произведение их единиц измерения должно давать единицу измерения работы (например в СИ, Дж).
Заслуживает особого внимания тот факт, что Аm не является полным дифференциалом, так как потенциал Pm, в силу наличия эффектов увлечения одних координат другими, является функцией не только сопряженной с ним обобщенной координаты gm, но и некоторых других координат системы. Имея в виду эту особенность работы, говорят, что она зависит от пути перехода системы из одного состояния в другое, т.е. является функцией процесса, совершаемого системой.
Согласно равенству (4.45) элементарная работа может принимать как положительные, так и отрицательные значения. Считается, что если Аm 0, то работа совершается окружающей средой над системой (воздействие вида m направлено на систему со стороны окружающей среды); если Аm 0, то работу совершает система над окружающей средой (воздействие направлено от системы в сторону окружающей среды).
Перейдем к рассмотрению конкретных видов работы. Для определенности предположим, что объектом изучения является однородная система с механической, массовой, электрической и термической степенями свободы.
При передаче объема через контрольную поверхность совершается механическая работа:
dAмех = -pdeV, (4.46)
где p давление системы;
-p механический потенциал системы;
deV изменение объема системы.
При переносе массы компонента k через контрольную поверхность системы совершается массовая работа вида k:
dАk,масс = k,удdemk, (4.47)
где k,уд удельный химический потенциал k-го компонента в системе;
demk изменение массы того же компонента системы с учетом эффектов увлечения (уравнение 4.34).
Используя связь между массой и числом молей компонента k (4.14), запишем выражение (4.47) в виде:
dAk,масс = k,мольdenk, (4.48)
где величина k,моль (мольный химический потенциал) определяется равенством:
k,моль = k,удMk . (4.49)
Суммирование величины типа Ах,масс по всем компонентам дает массовую работу, связанную с массообменом в целом между системой и окружающей средой:
dAмасс
=
![]() dAк,
масс =
dAк,
масс =
![]() к,
уд demk=
к,
уд demk=![]() к,
моль denk
. (4.50)
к,
моль denk
. (4.50)
С переносом электрического заряда компонентом k через контрольную поверхность системы связана электрическая работа:
dAk,эл = degk , (4.51)
где – электрический потенциал системы;
degk – изменение электрического заряда k-го компонента системы с учетом эффектов увлечения. (уравнение 4.36).
Суммируя уравнения (4.51) по всем компонентам, получаем выражение для электрической работы, связанной с электрическим взаимодействием в целом между системой и окружающей средой:
dAэл
=
![]() dAk,эл
=
dAk,эл
=
![]() deqk
=
deq ,
(4.52)
deqk
=
deq ,
(4.52)
где deqk - изменение электрического заряда системы.
Наличие жесткой связи между приращениями deqk и demk (4.41), обусловленной эффектами взаимного увлечения электрического заряда и массы k-го компонента, позволяет записать:
dAэл
=
F
![]() demk
=
F
demk
=
F
![]() denk
. (4.53)
denk
. (4.53)
Как видно, массовая и электрическая работы выражаются через изменения одних и тех же аргументов.
С переносом энтропии через контрольную поверхность системы связана термическая работа:
dAтерм = ТdeS, (4.54)
где Т - температура системы;
deS - приращение энтропии системы за счет внешних причин с учетом эффектов увлечения.
Используя для deS выражение (4.44), получим:
dAтерм = ТdeSтепл + Т deSмасс . (4.55)
Часть термической работы, обусловленная только тепловым взаимодействием (самопроизвольным переносом энтропии через контрольную поверхность системы под действием только сопряженного с ней обобщенного потенциала - температуры), называется теплотой dQ:
dQ = TdeSтепл . (4.56)
Таким образом, при наличии теплового, массового и электрического взаимодействия термическая работа dAтерм состоит из теплоты dQ и слагаемого TdeSмасс, обусловленного увлечением энтропии массами и электрическими зарядами компонентов.
Лишь в случае закрытой системы, когда она не обменивается с окружающей средой частицами компонентов (demk = 0, degk = 0) и, следовательно, deSмасс = 0, термическая работа совпадает с теплотой.
