
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Глава 8.Расчеты изменения энтропии системы
В параграфе 6.2 было показано, что энтропия является функцией состояния системы. Поэтому ее изменение при переходе системы из состояния 1 в состояние 2 определяется разностью ее значений в этих состояниях и не зависит от того, каким способом этот процесс осуществляется (обратимым или необратимым). Это положение дает возможность вычислить изменение энтропии при любом реальном процессе, мысленно заменяя его одним или несколькими обратимыми (квазиравновесными) процессами, в результате которых система переводится из начального в то же конечное состояние, что и при неравновесном процессе.
На основании первого и второго закона термодинамики можно определить приращение энтропии для закрытых систем в соответствии с уравнением (6.9):
![]() ,
,
где первое слагаемое связано с теплообменом закрытой термомеханической системы с окружающей средой, а второе слагаемое – с внутренними процессами в системе.
Проводя соответствующим образом калориметрические измерения, описанные в параграфе 7.3, можно определить каждую из этих составляющих в отдельности:
![]() (8.1)
(8.1)
![]() .
(8.2)
.
(8.2)
8.1. Изменение энтропии системы deSтепл .
Для определения конечного приращения энтропии при переходе системы из состояния 1 в состояние 2 следует проинтегрировать аналитическое выражение второго закона термодинамики (8.1) или (8.2.):
![]() .
(8.3)
.
(8.3)
Чтобы соотношению (8.3) придать более конкретный вид, выразим приращение теплоты для закрытой системы из уравнения (7.1):
![]() (8.4)
(8.4)
или
![]() . (8.5)
. (8.5)
Отсюда находим конечное изменение энтропии системы в процессе
![]() (8.6)
(8.6)
или
![]() .
(8.7)
.
(8.7)
Из соотношений (8.6) и (8.7) следуют зависимости энтропии от температуры при постоянном объеме или постоянном давлении системы и от объема и давления при постоянной температуре.
Зависимость энтропии от температуры при постоянном объеме или постоянном давлении можно получить, если известна зависимость от температуры внутренней энергии или энтальпии. В соответствии с соотношениями (5.48) и (5.49)
![]() ;
;![]()
запишем
dUV = CVdТ иdНР= СРdТ (8.8)
или (в соответствии с объединенным уравнением первого и второго законов термодинамики)
dUV= ТdSVиdНР= ТdSР. (8.9)
Сравнение уравнений (8.8) с соответствующими соотношениями (8.9) дает основание записать
![]() и
и![]() .
(8.10)
.
(8.10)
Соотношения (8.10) показывают, что энтропия системы всегда увеличивается с повышением температуры при V =constили Р =const,
так
как
![]() и
и![]() .
.
Конкретные зависимости энтропии от температуры при постоянном давлении или объеме получим, подставив в уравнения (8.6) и (8.7) выражения (8.8) для dUV и dНР:
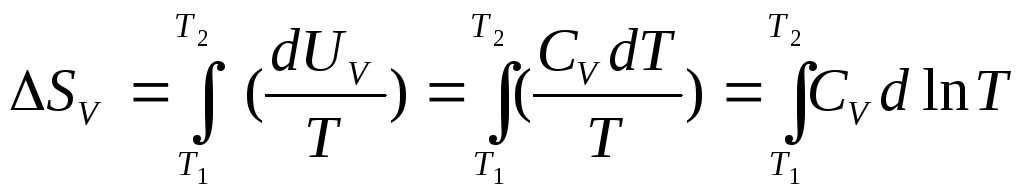 ,
(8.11)
,
(8.11)
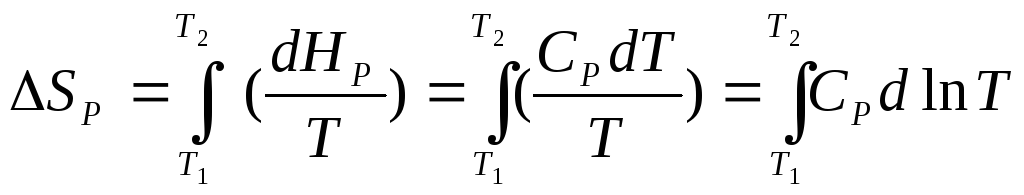 .
(8.12)
.
(8.12)
Для того чтобы вычислить интеграл, надо знать зависимость теплоемкостей СVи СРот температуры. Иногда достаточно принять, что теплоемкости в узком интервале температур не зависят от Т. Тогда
![]() ;
;![]() .
(8.13)
.
(8.13)
Если же требуется учесть зависимость теплоемкости от температуры, которая, например, имеет выражение Ср= а + вТ, то
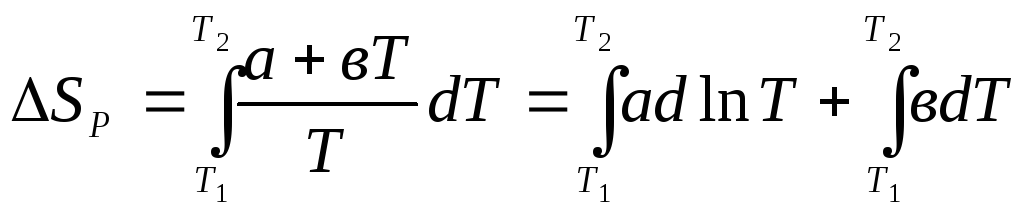 (8.14)
(8.14)
или
![]() .
(8.15)
.
(8.15)
Интеграл может быть определен и графически.
Зависимости энтропии от объема и давления при постоянной температуре следуют из тех же соотношений (6.6) и (6.7):
![]() ;
;![]() (8.16)
(8.16)
или
![]() ;
;![]() .
(8.17)
.
(8.17)
Из
соотношений (8.17) следует, что энтропия
при постоянной температуре всегда
увеличивается с возрастанием объема
системы и с уменьшением давления, так
как
![]() и
и![]() .
.
Конкретные зависимости энтропии от объема и давления при Т=constможно получить, проинтегрировав соотношения (8.16):
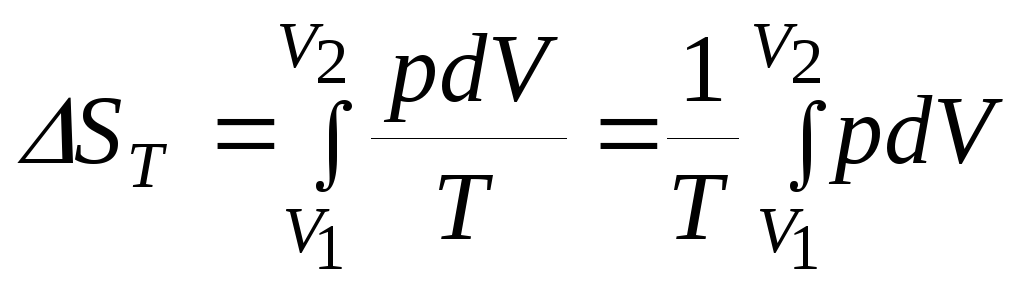 (8.18)
(8.18)
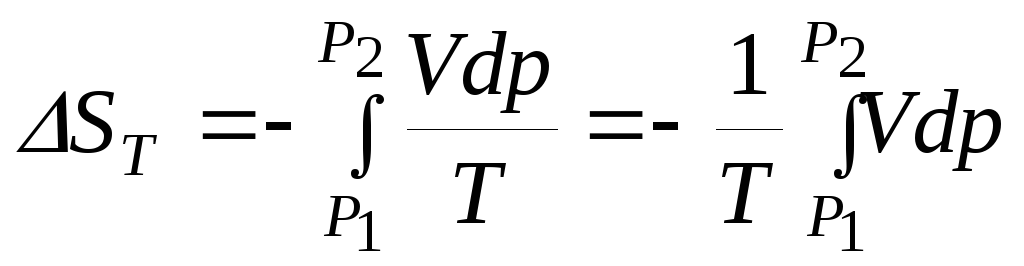 . (8.19)
. (8.19)
Для проведения интегрирования необходимо знать зависимость объема системы от давления при постоянной температуре, т.е. уравнение состояния. Используем в качестве примера уравнение состояния 1 моль идеального газа рV=RT. Тогда решением уравнения (8.18) будут выражения:
 ;
(8.20)
;
(8.20)
![]() ; (8.21)
; (8.21)
![]() . (8.22)
. (8.22)
Таким же образом найдем решение уравнение (8.19):
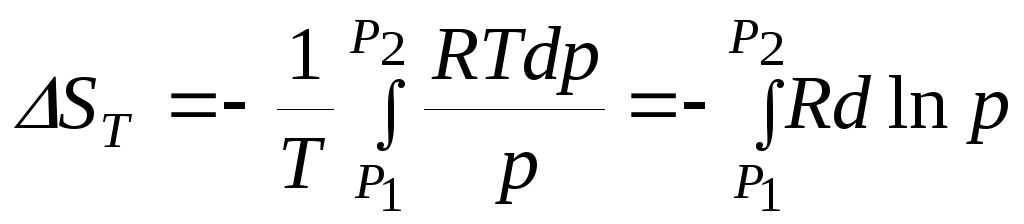 ;
(8.23)
;
(8.23)
![]() ;
(8.24)
;
(8.24)
![]() .
(8.25)
.
(8.25)
8.2. Изменение энтропии системы при химических
превращениях di Sхим.
Несколько иначе выполняются расчеты изменения энтропии при химических и фазовых превращениях, которые обычно проходят при постоянных температуре и давлении (изобарно-изотермические процессы). Как следует из определения, данного в параграфе 7.1., поглощаемая или выделяемая теплота в ходе этих процессов фактически является энтальпией или изобарным тепловым эффектом при постоянных р и Т.
![]() ;
;![]() .
.
В соответствии с уравнением (7.18)
![]() ,
,
где
![]() .
.
Поскольку энтропия – экстенсивная величина, ее изменения в процессе, в том числе и в химической реакции, аддитивны по отношению к парциальным молярным величинам компонентов системы, т.е.
![]() ;
;![]() ,
(8.26)
,
(8.26)
где ni– число молей компонентов системыi.
Заменив число молей компонентов на химическую переменную , получим
![]() ,
(8.27)
,
(8.27)
![]() . (8.28)
. (8.28)
Уравнение (8.27) является выражением дифференциального мольного изменения энтропии системы в ходе химической реакции, а уравнение (8.28) – ее интегрального изменения.
В
соответствии со вторым законом
термодинамики при самопроизвольном
протекании химической реакции в
изолированных системах энтропия
возрастает (S0),
а ее изменение постепенно уменьшается: ,
так как снижается работоспособность
системы. В ходе химической реакции
энтропия растет до максимального
значения и перестает изменяться в
состоянии равновесия (S=0),
когда работоспособность системы
полностью исчерпана.
,
так как снижается работоспособность
системы. В ходе химической реакции
энтропия растет до максимального
значения и перестает изменяться в
состоянии равновесия (S=0),
когда работоспособность системы
полностью исчерпана.
Вычисление изменения энтропии для изобарно-изотермического химического процесса основано на уравнении:
![]() .
(8.29)
.
(8.29)
К сожалению, воспользоваться выражением (8.28) для определения изменения энтропии не представляется возможным, так как в большинстве случаев не удается калориметрически измерить парциальную мольную энтропию каждого компонента реакции.
Для определения энтропии из уравнения (8.29) необходимо знать ее значения при нескольких температурах (хотя бы при двух), исходя из калориметрических измерений НР,Т.
Воспользовавшись уравнением Кирхгофа (7.36)
![]()
и, решая его совместно с уравнением (8.29), получаем
 .
(8.30)
.
(8.30)
Проинтегрировав уравнение (8.30), получим
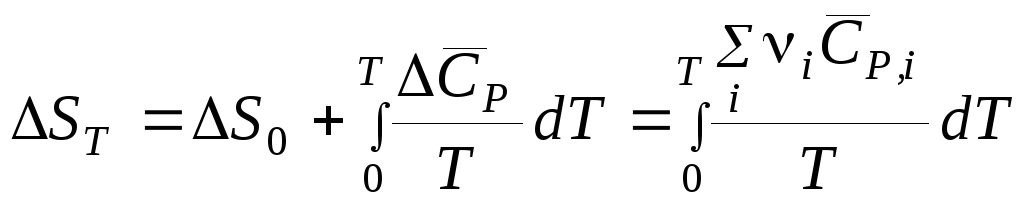 ,
(8.31)
,
(8.31)
где S0– постоянная интегрирования, представляющая собой гипотетическую энтропию при абсолютном нуле.
Чаще
всего парциальные мольные теплоемкости
неизвестны. Поэтому расчеты ведут по
молярным теплоемкостям (вместо
![]() в уравнение (8.31) записывают СР,i).
в уравнение (8.31) записывают СР,i).
Кроме того, в уравнении (8.31) используются стандартные мольные энтропии реагентов, отнесенные к образованию одного моля каждого реагента из простых веществ при Р=1 атм и Т=298 К.
В наиболее удобном для практического использования виде уравнение (8.31), с учетом указанных изменений, записывается следующим образом:
![]() .
(8.32)
.
(8.32)
Наиболее точное приближение при интегрировании уравнения (8.32) учитывает зависимости Срот температуры. Эти зависимости обычно задаются эмпирическими уравнениями типа (5.59), (5.60) и (7.46):
Ср=а +вТ +сТ2+с`Т-2.
Используя
(7.46) совместно с (8.32), приходим к следующему
выражению для вычисления
![]() по справочным данным:
по справочным данным:
![]()
![]()
(8.33)
Пример.
Рассчитать изменение энтропии при 1000 К реакции, приведенной в задаче в параграфе 7.5, пользуясь справочными данными.
Значения абсолютных энтропий образования участников реакции возьмем из справочника [ ] (см. таблицу).
|
Вещество |
CCl4 (г) |
SO2 (г) |
HCL (г) |
CH4 (г) |
SO2Cl2 (г) |
|
Дж/моль·К |
310,12 |
248,07 |
186,79 |
186,27 |
311,29 |
Решение
Для решения задачи используем уравнение (8.33):
![]() .
.
Значения коэффициентов Δa, Δb, Δc, Δc/ берем из задачи в параграфе 7.5 (пример, приведенный в параграфе 7.6).
Δa = –15,72; Δb = 7,62 10-3; Δc = 20,15 10-6; Δc/ = 30,48 105.
![]() =
310,12 + 4·248,07 + 4·186,79 – 186,27 – 4·311,29 = 618,13
Дж/моль·К.
=
310,12 + 4·248,07 + 4·186,79 – 186,27 – 4·311,29 = 618,13
Дж/моль·К.
![]()
![]() .
.
![]() .
.
Изменение энтропии при 1000 К
![]()
![]()
Дж /моль·К.
8.3. Изменение энтропии системы
при фазовых превращениях
Фазовые квазиравновесные превращения первого рода при постоянном давлении происходят при постоянной температуре. В связи с этим изменение энтропии при фазовых превращениях можно выразить непосредственно из уравнения (8.29):
![]() .
(8.34)
.
(8.34)
Запишем фазовые превращения (полиморфные превращения, плавление, возгонка, испарение) в виде
Фаза (1) Фаза (2).
Интегрируя уравнение (8.34) при условии постоянства температуры
![]() ,
(8.35)
,
(8.35)
получаем
![]() ,
(8.36)
,
(8.36)
где Sфаз,Нфаз, Тфаз– соответственно изменение энтропии, энтальпии и температуры фазового перехода.
При плавлении, испарении, сублимации теплота поглощается, т.е. НР,Т0; поэтому энтропия при этих фазовых превращениях (в соответствии с (8.36)) увеличивается. При обратных процессах (кристаллизация, конденсация) энтропия уменьшается.
Было установлено, что молярная энтропия испарения при температуре кипения и атмосферном давлении для многих неполярных жидкостей примерно одинакова и составляет 89-90 Дж/Кмоль – правило Трутона. У ассоциированных жидкостей (вода, спирты и др.)Sиспнесколько больше, так как требуется больше затратить теплоты на их испарение. Если же ассоциация наблюдается в паровой фазе (например, уксусная кислота и ее гомологи образуют димеры в паровой фазе), то значениеSиспнесколько меньше, чем это следует из эмпирического правила Трутона.
Следует указать также на существование эмпирического правила Ричардса, согласно которому энтропии плавления простых веществ, в том числе металлов, близки между собой и колеблются около величины R(8,314 Дж/Кмоль). Так, дляCu Sпл= 9,57 Дж/Кмоль, а для РвSпл=
8,02 Дж/Кмоль. Для соединений обычноSплR. Так, при плавлении льда (273К)Нпл= 6025 Дж/моль иSпл= 6025/273 = 22,07 Дж/Кмоль. Изменение энтропии при испарении значительно больше, чем при плавлении.
Если процесс фазового перехода не является изотермическим, то следует учитывать изменение энтропии при обратимом изменении температуры. Это может быть сделано с помощью уравнения, аналогичного уравнению (8.29):
![]() .
(8.37)
.
(8.37)
Здесь приближенно принимается, что теплоемкость Срв указанном интервале не зависит от температуры.
8.4. Изменение энтропии при смешении идеальных газов
Если привести в соприкосновение два газа, находящиеся при одинаковых давлении и температуре, то они будут самопроизвольно диффундировать друг в друга до тех пор, пока газовая фаза не станет микроскопически однородной. Поскольку между молекулами идеальных газов нет взаимодействия, при смешении энтропия не изменяется. Смешение происходит самопроизвольно только за счет изменения энтропии. Это изменение энтропии равно изменению, которое произошло бы, если бы каждому газу была предоставлена возможность изотермически расширяться от его начального объема до конечного общего объема смеси. Изменение энтропии для каждого газа можно вычислить по уравнению (8.21):
![]() .
.
Расчет изменения энтропии при смешении идеальных газов при постоянной температуре и давлении проиллюстрируем следующим примером. Реакционная камера (система) разделена перегородкой на две части (две подсистемы) объемами V1 иV2. В одной части системы содержитсяn1молей газа 1, в другой –n1молей газа 2. Если убрать перегородку, газы смешаются при Р=constи Т=const.
Тогда, например, для газа 1 изменение энтропии равно
![]() ,
(8.38)
,
(8.38)
где n1– число молей газа 1;
V1– начальный объем газа 1;
V2– начальный объем газа 2.
Так что V1+V2 представляет собой конечный объем смеси газов. Аналогичные выражения можно записать и для газа 2.
Суммарная энтропия расширения этих двух газов равна:
![]() ,
(8.39)
,
(8.39)
где n2 – число молей газа 2.
Это уравнение справедливо только для изотермического смешения.
Мольные доли N1иN2двух идеальных газов выражаются равенствами:
![]() , (8.40)
, (8.40)
![]() .
(8.41)
.
(8.41)
Поэтому
Sсмеси=-R(n1lnN1+n2 lnN2) . (8.42)
Если N1+ N2 = 1, то изменение энтропии является мольной величиной, и уравнение (6.42) можно записать как
![]() =
-R(N1lnN1+N2lnN2).
(8.43)
=
-R(N1lnN1+N2lnN2).
(8.43)
Энтропия смешения положительна, так как N11 иN21. Следовательно, в изолированной системе диффузия одного газа в другой происходит самопроизвольно, хотя энергия при этом не уменьшается.
Уравнение (8.43) можно записать в обобщенном виде для смешения одного моляiкомпонентов с образованием идеального газового раствора:
![]() .
(8.44)
.
(8.44)
