
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
В соответствии с уравнением (4.56) теплота может быть определена, если известно изменение энтропии S системы. Однако то обстоятельство, что энтропия не может быть измерена непосредственно, создает некоторые осложнения, особенно при описании изохорных и изобарных процессов. Возникает необходимость в определении количества теплоты с помощью измеряемой на опыте величины.
В качестве такой величины может выступать теплоемкость системы. Наиболее общее определение теплоемкости вытекает из выражения первого закона термодинамики (5.2), (5.3). Исходя из него, любая емкость системы С по отношению к работе вида m определяется уравнением
Cm = dAm / dPm = Pmdegm / dPm, (5.42)
где Сm – емкость системы;
Pm и gm – соответственно обобщенный потенциал и координата состояния вида m.
Величина Cm показывает, какое количество работы вида m необходимо совершить при заданных условиях, чтобы изменить m-й обобщенный потенциал системы на единицу его измерения.
Понятие емкости системы по отношению к той или иной работе в термодинамике широко используется лишь при описании теплового взаимодействия между системой и окружающей средой.
Емкость системы по отношению к теплоте называется теплоемкостью и задается равенством
С = deQ / dT = TdeSтепл / dT . (5.43)
Таким образом, теплоемкость может быть определена как количество теплоты, которое необходимо сообщить системе, чтобы изменить ее температуру на один Кельвин.
Теплоемкость, подобно внутренней энергии и энтальпии, является экстенсивной величиной, пропорциональной количеству вещества. На практике используют теплоемкость, отнесенную к единице массы вещества, – удельную теплоемкость, и теплоемкость, отнесенную к одному молю вещества, – молярную теплоемкость. Удельная теплоемкость в СИ выражается в Дж/(кг·К), а молярная – в Дж/(моль·К).
Удельная и молярная теплоемкости связаны соотношением:
Смоль = СудМ, (5.44)
где М - молекулярная масса вещества.
Различают истинную (дифференциальную) теплоемкость, определяемую из уравнения (5.43) и представляющую собой элементарное приращение теплоты при бесконечно малом изменении температуры, и среднюю теплоемкость, представляющую собой отношение полного количества теплоты к полному изменению температуры в данном процессе:
![]() =
Q/T
. (5.45)
=
Q/T
. (5.45)
Связь между истинной и средней удельной теплоемкостью устанавливается соотношением
![]() =
=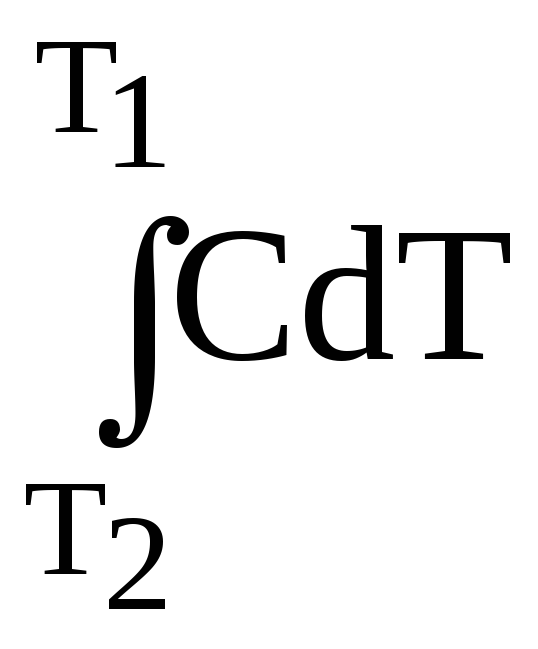 /
T
(5.46)
/
T
(5.46)
или
![]() =
=![]()
 .
(5.47)
.
(5.47)
При постоянных давлении или объеме теплота и соответственно теплоемкость приобретают свойства функции состояния, т.е. становятся характеристиками системы. Именно эти теплоемкости - изобарную СР (при постоянном давлении) и изохорную СV (при постоянном объеме) наиболее широко используют в термодинамике.
Если система нагревается при постоянном объеме, то в соответствии с выражением (5.27) изохорная теплоемкость CV записывается в виде
CV
=
![]() . (5.48)
. (5.48)
Если система нагревается при постоянном давлении, то в соответствии с уравнением (5.32) изобарная теплоемкость СР предстает в виде
СР
=
![]() .
(5.49)
.
(5.49)
Чтобы найти связь между СР и СV, надо продифференцировать выражение (5.31) по температуре. Для одного моля идеального газа это выражение с учетом уравнения (5.18) можно представить в виде
H = U + pV = U + RT . (5.50)
Тогда
dH/dT = dU/dT + R, (5.51)
а разность между изобарной и изохорной теплоемкостями для одного моля идеального газа численно равна универсальной газовой постоянной R:
СР - СV = R . (5.52)
Теплоемкость при постоянном давлении всегда больше теплоемкости при постоянном объеме, так как нагревание вещества при постоянном давлении сопровождается работой расширения газа.
Используя выражение внутренней энергии идеального одноатомного газа (5.21), получим значение его теплоемкости для одного моля идеального одноатомного газа:
CV = dU/dT = d(3/2 RT)dT = 3/2 R 12,5 Дж/(моль·К); (5.53)
CР = 3/2R + R = 5/2 R 20,8 Дж/(моль·К). (5.54)
Таким образом, для одноатомных идеальных газов CVиCp не зависит от температуры, поскольку вся подведенная тепловая энергия расходуется только на ускорение поступательного движения. Для многоатомных молекул наряду с изменением поступательного движения может происходить и изменение вращательного и колебательного внутримолекулярного движения. Для двухатомных молекул обычно учитывают дополнительно вращательное движение, вследствие чего численные значения их теплоемкостей составляют:
CV = 5/2 R 20,8 Дж/(моль·К); (5.55)
Cp = 5/2 R + R = 7/2 R 29,1 Дж/(моль·К). (5.56)
Попутно коснемся теплоемкостей веществ в других (кроме газообразного) агрегатных состояниях. Для оценки теплоемкостей твердых химических соединений нередко используют приближенное правило аддитивности Неймана и Коппа, согласно которому молярная теплоемкость химических соединений в твердом состоянии равна сумме атомных теплоемкостей элементов, входящих в данное соединение. Так, теплоемкость сложного химического соединения с учетом правила Дюлонга и Пти можно оценить так:
CV = 25n Дж/(моль·К), (5.57)
где n - число атомов в молекулах соединений.
Теплоемкости жидкостей и твердых тел вблизи температуры плавления (кристаллизации) почти равны. Вблизи нормальной температуры кипения большинство органических жидкостей имеет удельную теплоемкость 1700 - 2100 Дж/кг·К. В промежутках между этими температурами фазовых переходов теплоемкость жидкости может значительно отличаться (зависит от температуры). В общем виде зависимость теплоемкости твердых тел от температуры в интервале 0 – 290К в большинстве случаев хорошо передается полуэмпирическим уравнением Дебая (для кристаллической решетки) в области низких температур
CР CV = eT3, (5.58)
в котором коэффициент пропорциональности (e) зависит от природы вещества (эмпирическая константа).
Зависимость теплоемкости газов, жидкостей и твердых тел от температуры при обычных и высоких температурах принято выражать с помощью эмпирических уравнений, имеющих вид степенных рядов:
СР = a + bT + cT2 (5.59)
или
СР = a + bT + c'T-2 , (5.60)
где a, b, c и c' - эмпирические температурные коэффициенты.
Возвращаясь к описанию процессов в закрытых системах с привлечением метода теплоемкостей, запишем некоторые уравнения, приведенные в параграфе 5.1, в несколько ином виде.
Изохорный процесс. Выражая внутреннюю энергию (5.27) через теплоемкость, получим
dUV
= QV
= U2
– U1
= CV
dT =
![]() CV
dT
. (5.61)
CV
dT
. (5.61)
С учетом того, что теплоемкость идеального газа не зависит от температуры, уравнение (5.61) можно записать так:
UV = QV = U2 - U1 = CVT . (5.62)
Чтобы вычислить значение интеграла (5.61) для реальных одно- и многоатомных газов, надо знать конкретный вид функциональной зависимости CV = f(T) типа (5.59) или (5.60).
Изобарный процесс. Для газообразного состояния вещества первый закон термодинамики (5.29) для этого процесса с учетом записи работы расширения (5.35) и с использованием метода теплоемкостей записывается так:
QР = СVT + RT = CРT = H (5.63)
или
QР
= HР
= H2
– H1
=
![]() CРdT
. (5.64)
CРdT
. (5.64)
Если система является идеальным газом и теплоемкость СР не зависит от температуры, соотношение (5.64) переходит в (5.63). Для решения уравнения (5.64), описывающего реальный газ, необходимо знать конкретный вид зависимости Cp = f(T).
Изотермический процесс. Изменение внутренней энергии идеального газа в процессе, протекающем при постоянной температуре
dUT= CVdT = 0. (5.65)
Адиабатический процесс. Так как dU = CVdT, то для одного моля идеального газа изменение внутренней энергии и совершаемая работа равны соответственно:
U = CVdT = CV(T2 - T1); (5.66)
Амех = -U = CV(T1 - T2). (5.67)
Анализ уравнений, характеризующих различные термодинамические процессы при условиях: 1) p = сonst; 2) V = сonst; 3) T = сonst и 4) Q = 0 показывает, что все они могут быть представлены общим уравнением:
pVn = сonst. (5.68)
В этом уравнении показатель "n" может принимать значения от 0 до для разных процессов:
изобарного (n = 0);
изотермического (n = 1);
изохорного (n = );
адиабатического (n = ; где = CР/CV – адиабатический коэффициент).
Полученные соотношения справедливы для идеального газа и представляют собой следствие его уравнения состояния, а рассмотренные процессы - частные и предельные проявления реальных процессов. Реальные же процессы, как правило, являются промежуточными, протекают при произвольных значениях "n" и получили название политропных процессов.
Если сравнить работу расширения идеального газа, производимую в рассмотренных термодинамических процессах, с изменением объема от V1 до V2, то, как видно из рис. 5.2, наибольшая работа расширения совершается в изобарном процессе, меньшая – в изотермическом и еще меньшая – в адиабатическом. Для изохорного процесса работа равна нулю.

Рис. 5.2. P = f (V) –зависимость для различных термодинамических процессов (заштрихованные области характеризуют работу расширения в соответствующем процессе)
