
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
7.2. Дифференциальная и интегральная теплоты химических процессов
Термохимическими уравнениями называют уравнения химических реакций, в правой части которых наряду с формулами веществ, образующихся в результате реакции, приводятся и тепловые эффекты реакций.
Существуют
два способа записи термохимических
уравнений. В соответствии с современным
термодинамическим
способом
значение теплового эффекта реакции в
виде энтальпии
![]() Н
указывают отдельно после химического
уравнения. Например:
Н
указывают отдельно после химического
уравнения. Например:
2С(тв)
+ О2(г)
= 2СО(г);
![]() Н
= -221,04 кДж/моль.
Н
= -221,04 кДж/моль.
Обозначения в скобках при компонентах (тв), (г), (ж) указывают на агрегатное состояние веществ, соответственно – твердое, газообразное, жидкое. В некоторых случаях используются обозначения, которые, в случае необходимости, отражают аллотропное состояние вещества: С(графит), С(корунд) и т.д. Применяющийся также термохимический способ отличается тем, что тепловой эффект реакции Qр записывают непосредственно в уравнении химической реакции в виде теплоты. Причем, если теплота выделяется в ходе реакции (экзотермическая реакция), то значение теплового эффекта записывают в правой части уравнения со знаком плюс:
2С(тв) + О2(г) = 2СО(г) + 221,04 кДж/моль.
Если же теплота поглощается (эндотермическая реакция), то термохимическое уравнение записывают так:
СО2(г) + С(графит) = 2СО(г) – 173 кДж/моль.
Таким образом, если тепловые эффекты
записываются в правой части уравнения,
то они положительны для экзотермических
реакций и отрицательны для эндотермических
реакций (в термохимической записи).
Знаки
![]() Н
в термодинамическом способе записи
прямо противоположны знакам тепловых
эффектовQрв
термохимической записи в соответствии
с выводом (7.8), т.е.Qр= -
Н
в термодинамическом способе записи
прямо противоположны знакам тепловых
эффектовQрв
термохимической записи в соответствии
с выводом (7.8), т.е.Qр= -![]() Нр.
Нр.
Тепловые эффекты реакций, приводимые в справочных таблицах, обычно относят к одному молю одного из веществ, участвующих в реакции. Значение теплового эффекта реакции одновременно относится к определенным количествам других веществ, соответствующим стехиометрическим коэффициентам этих веществ в уравнении реакции, при условии, что стехиометрический коэффициент вещества, на 1 моль которого дается тепловой эффект, равен единице.
Отсюда в термохимических уравнениях появляются дробные стехиометрические коэффициенты. Например:
СО(г)+ 1/2О2(г)= СО2(г);![]() Н
= -284,5 кДж/моль.
Н
= -284,5 кДж/моль.
Это значит, что тепловой эффект реакции, отнесенной к 1 моль СО2(г),одновременно относится к 1 моль СО(г)и к ½ моль О2(г).
Тепловые эффекты химических реакций так же, как внутренняя энергия и энтальпия системы, относятся к экстенсивным величинам. Поэтому они могут быть выражены через парциальные мольные величины в соответствии с уравнениями (3.46 – 3.48).
При постоянных объеме системы и температуре (изохорно-изотермический процесс) уравнение (3.46) приобретает вид:
![]() (7.15)
(7.15)
где
![]() (7.16)
(7.16)
или
![]() (7.17)
(7.17)
В приведенных уравнениях величины
![]() - парциальные мольные внутренние энергии
компонентов. Величина
- парциальные мольные внутренние энергии
компонентов. Величина![]() -
дифференциальная, или истинная, теплота
химического процесса приV,Т
=const, т.е. это количество
теплоты, выделившееся из системы или
поглощенное системой (или изменение
внутренней энергии системы) в расчете
на единицу химической переменной (на
один пробег реакции) при данном составе
системы (при изменении его на бесконечно
малую величину).
-
дифференциальная, или истинная, теплота
химического процесса приV,Т
=const, т.е. это количество
теплоты, выделившееся из системы или
поглощенное системой (или изменение
внутренней энергии системы) в расчете
на единицу химической переменной (на
один пробег реакции) при данном составе
системы (при изменении его на бесконечно
малую величину).
Химические процессы чаще проводят при постоянных давлении и температуре (изобарно-изотермический процесс). При этих условиях соотношение (3.46) принимает вид
![]() (7.18)
(7.18)
где
![]() (7.19)
(7.19)
или
![]() (7.20)
(7.20)
Величины
![]() представляют собой парциальные мольные
энтальпии компонентов химической
системы.
представляют собой парциальные мольные
энтальпии компонентов химической
системы.
Величина
![]() -
дифференциальная или истинная теплота
химического процесса при р,Т=const,
т.е. это количество теплоты, выделившееся
из системы или поглощенное системой
(или изменение энтальпии системы в
химическом процессе) в расчете на единицу
химической переменной (в расчете на
один пробег химической реакции) при
данном составе системы (при изменении
его на бесконечно малую величину).
-
дифференциальная или истинная теплота
химического процесса при р,Т=const,
т.е. это количество теплоты, выделившееся
из системы или поглощенное системой
(или изменение энтальпии системы в
химическом процессе) в расчете на единицу
химической переменной (в расчете на
один пробег химической реакции) при
данном составе системы (при изменении
его на бесконечно малую величину).
Как ![]() ,
так и
,
так и![]() являются функциями мгновенного состояния
системы (при изменении состава в ходе
химической реакции или фазового
перехода).
являются функциями мгновенного состояния
системы (при изменении состава в ходе
химической реакции или фазового
перехода).
В приведенном выше соотношении (7.19) стехиометрические коэффициенты для продуктов реакции i0, а для реагентовi 0. Если же принять все стехиометрические коэффициенты положительными, то определение рассматриваемой величины можно сформулировать так: дифференциальная теплота (энтальпия) реакции равна разности между суммой произведений парциальных мольных энтальпий продуктов реакции на соответствующие стехиометрические коэффициенты и аналогичной суммой для исходных веществ:
![]()
![]() .
(7.21)
.
(7.21)
По мере протекания реакции степень превращения веществ увеличивается (т.е. возрастает химическая переменная), изменяется состав системы и соответственно, в общем случае, изменяются значения парциальных мольных энтальпий компонентов и дифференциальная энтальпия реакции. Только в идеальной системе, в которой парциальные мольные энтальпии, равные молярным величинам, не зависят от состава системы, т.е. от степени превращения веществ, дифференциальная энтальпия реакции также не зависит от состава системы. Поэтому соотношение (7.19) для идеальной системы можно записать так:
![]() (7.22)
(7.22)
где
![]() -
молярная энтальпия компонентаi.
-
молярная энтальпия компонентаi.
Для процессов фазового переноса вещества из фазы 1 в фазу 2 уравнение (7.19) переходит в соотношение
![]() ,
(7.23)
,
(7.23)
где
![]() и
и![]() - парциальные молярные энтальпии веществаiсоответственно в начальной
и конечной фазах.
- парциальные молярные энтальпии веществаiсоответственно в начальной
и конечной фазах.
Применительно к идеальной системе уравнение (7.23) записывается так:
![]() , (7.24)
, (7.24)
т.е. дифференциальная теплота фазового перехода равна разности дифференциальных или молярных (в идеальной системе) энтальпий вещества i в конечной и начальной фазах.
В термохимических расчетах используют, как правило, значения интегральных теплот химических процессов, т.е. теплот, отнесенных к единице химической переменной (к одному молю компонента с =1).
Чтобы получить выражение для интегральной теплоты процесса, необходимо проинтегрировать соотношение (7.20), определяющее теплоту при постоянных P и T.
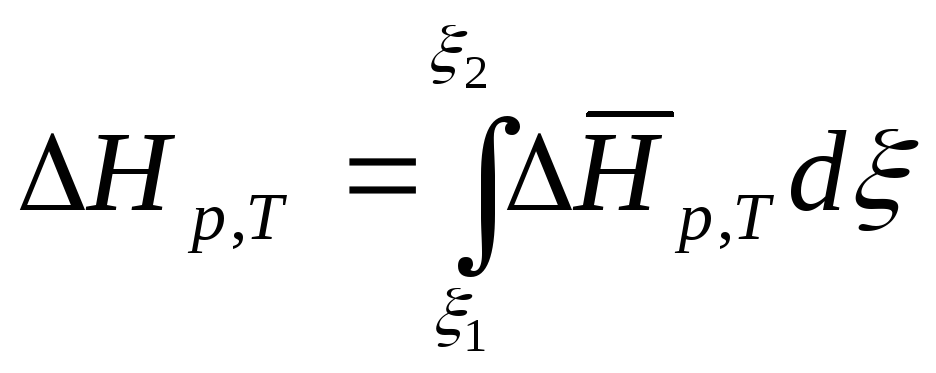 (7.25)
(7.25)
или
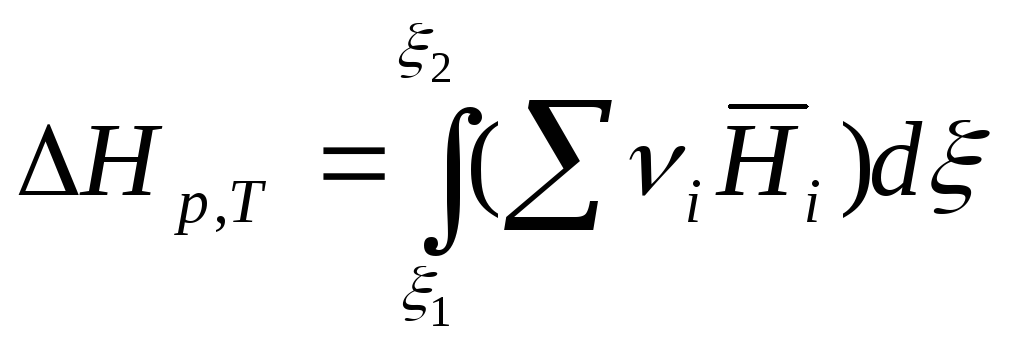 .
(7.26)
.
(7.26)
Из этих соотношений видно, что для их
точного решения необходимо знать
зависимости парциальных мольных
энтальпий
![]() от химической переменной(т.е. от состава системы), которые обычно
неизвестны. Поэтому предполагают, что
система, в которой происходит химическая
реакция, идеальная, и тогда можно принять,
что парциальная мольная энтальпия равна
молярной энтальпии чистого вещества,
т.е.
от химической переменной(т.е. от состава системы), которые обычно
неизвестны. Поэтому предполагают, что
система, в которой происходит химическая
реакция, идеальная, и тогда можно принять,
что парциальная мольная энтальпия равна
молярной энтальпии чистого вещества,
т.е.![]() .
.
Условие идеальности системы приводит к следующему выражению уравнения (7.26):
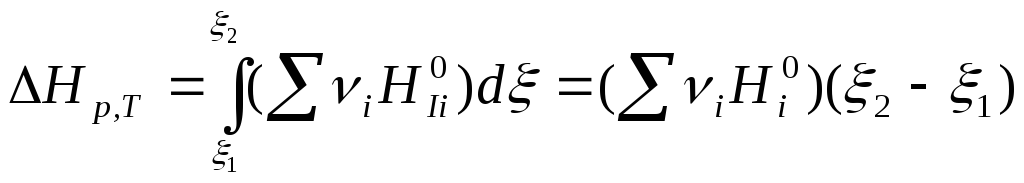 , (7.27)
, (7.27)
где 1и2– соответственно химическая переменная для системы в начальном и конечном состояниях.
Для условия изменения химической переменной на единицу, т.е.
2-1= 1 (на 1 моль компонентаi), уравнение (7.27) записывается так:
![]() .
(7.28)
.
(7.28)
Сравнение этого соотношения с уравнением (7.22) показывает, что в идеальной системе значения интегральных и дифференциальных теплот данной химической реакции одинаковы. Они не зависят от степени превращения вещества (от состава системы) и определяют тепловой эффект реакции «в чистом виде» (т.е. без учета сопутствующих взаимодействий).
Таким образом, из соотношения (7.28) следует
определение теплового эффекта реакции,
являющегося основным понятием в
термохимии: под тепловым эффектом
химической реакции понимают интегральную
теплоту этой реакции, протекающей в
идеальной системе при постоянной
температуре, давлении (![]() )
или объеме (
)
или объеме (![]() ),
рассчитанную на единицу химической
переменной (или приi=1,
т.е. на 1 моль основного компонента).
),
рассчитанную на единицу химической
переменной (или приi=1,
т.е. на 1 моль основного компонента).
Соотношение между
![]() и
и![]() вытекает из уравнения (7.14):
вытекает из уравнения (7.14):
![]() =
=![]() +RТ
+RТ![]() (7.29)
(7.29)
При i=0 тепловые эффекты реакции при постоянном объеме и постоянном давлении одинаковы.
7.3. Стандартные тепловые эффекты
и калориметрические измерения
Для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к одинаковым условиям. В противном случае их значения будут несопоставимы и все операции с ними станут невозможными. Исходя из этого, в практике термохимии принято обращаться к стандартным тепловым эффектам химических реакций.
За стандартные тепловые эффекты обычно принимают либо тепловые эффекты образования химических соединений из простых веществ, либо тепловые эффекты разложения (сгорания) химических веществ до простых соединений, взятых в термодинамически устойчивом состоянии при рассматриваемых (стандартных) условиях.
Под стандартной теплотой образования
химического соединения понимают то
количество теплоты, которое выделяется
или поглощается при образовании одного
моля соединения из простых веществ,
энтальпии образования которых условно
принимаются равными нулю при стандартных
условиях (обычно при Р=1 атм и Т=298 К).
Стандартный тепловой эффект обозначается
![]() или
или![]() ,
в частности
,
в частности![]() .
.
Из возможных форм термодинамически устойчивого существования простых веществ выбирают модификации, устойчивые при обычных условиях (например, атомы элементов, графит, ромбическая сера, белое олово, кристаллический йод, жидкий бром и др.). Энтальпии образования именно таких веществ в их обычном состоянии принимают равными нулю.
Так, энтальпия образования СО2равна изменению энтальпии для следующей реакции:
С(графит)+ О2(газ)= СО2(газ);![]() .
.
Следует отметить, что большинство сложных соединений образуется из элементарных веществ с выделением теплоты, что говорит о меньшем запасе в них химической энергии, чем в простых веществах. Вместе с тем существует много и таких соединений (например, оксид азота N2О, циан С2N2), при образовании которых теплота поглощается и превращается в химическую энергию. Такие сложные вещества обладают бóльшим запасом энергии, чем составляющие их элементы, и поэтому обнаруживают повышенную склонность к химическим реакциям по сравнению с элементарными веществами.
Энтальпии образования многих соединений, ионов и атомов известны с большой точностью; некоторые из них приведены в справочниках. Для многих веществ значения теплот образования табулированы. Так, теплоты образования ионов в водных растворах отнесены к теплоте образования иона водорода, которая условно принята равной нулю.
За стандартное состояние растворенного вещества в водном растворе принимают гипотетическое идеальное состояние с молярной концентрацией, равной единице, в котором мольная энтальпия растворенного вещества имеет такое же значение, как в бесконечно разбавленном растворе.
Поскольку для термохимических измерений пригодны только те реакции, которые проходят быстро и до конца, наибольшее значение в термохимии имеют теплоты сгорания. Чтобы быть уверенным в том, что произошло полное сгорание, вещество поджигают электрической искрой в стальной калориметрической бомбе, содержащей кислород под определенным давлением. В таких условиях все углеводороды сгорают, образуя высшие оксиды элементов (СО2, Н2О,SО2).
Чтобы обеспечить сравнение различных
реакций, экспериментальные термохимические
данные обычно приводят в виде изменения
стандартной энтальпии
![]() в данной реакции.Стандартная теплота
сгорания – теплота, выделяющаяся при
полном сгорании (окислении) в атмосфере
кислорода одоного моля вещества (чаще
всего органического) при 298 К.
в данной реакции.Стандартная теплота
сгорания – теплота, выделяющаяся при
полном сгорании (окислении) в атмосфере
кислорода одоного моля вещества (чаще
всего органического) при 298 К.
В отличие от стандартных теплот сгорания стандартные теплоты образования удается определить прямым калориметрическим измерением только в отдельных случаях. Обычно же их вычисляют на основании измерений теплот сгорания (органического вещества) или растворения (неорганического вещества).
Для экспериментального определения тепловых эффектов используют специальные приборы – калориметры (или калориметрические системы). Калориметрическая система – это реактор, помещенный в оболочку. Различают два случая: оболочка предотвращает тепловой обмен между реактором и окружающей средой (изолированная система) или облегчает учет такого обмена (закрытая система).
Калориметры обычно подразделяют на калориметры с постоянной и с переменной температурой. В первых из них оболочка содержит плавящиеся твердые тела (так называемые «ледяные» калориметры) или испаряющуюся жидкость. Во время опыта температура в таком калориметре остается постоянной, потому что вся теплота, сообщаемая системе, идет на изменение агрегатного состояния вещества оболочки. О тепловом эффекте судят по количеству расплавившегося или испарившегося вещества.
В калориметрах переменной температуры возможны два способа измерений:
– адиабатический, когда температуру оболочки изменяют в ходе опыта так, чтобы она в любой момент времени совпадала с температурой реактора. В этом случае теплообмен отсутствует и, значит, реактор является изолированной системой. Такие калориметры применяют для измерения малых тепловых эффектов или тепловых эффектов медленно текущих процессов;
– диатермический, когда реактор обменивается теплотой с изотермической оболочкой (реактор – закрытая система). Оболочка содержит значительное количество воды, обладающей относительно большой удельной теплоемкостью и вследствие этого сохраняет практически постоянную температуру.
Именно такого типа калориметры обычно применяют для измерения теплоемкостей, теплоты растворения, разведения, нейтрализации, изменения агрегатного состояния веществ, сгорания. В последнем случае (при определении тепловых эффектов сгорания) реакции проводят при постоянном объеме по описанному выше методу в калориметрической бомбе.
На рис. 7.1 представлена схема калориметра с изотермической оболочкой.
Рис.
7.1 Калориметр с изотермической оболочкой
наружный
стакан;
внутренний
стакан;
крышка;
отверстие;
мешалка;
термометр;
подставка;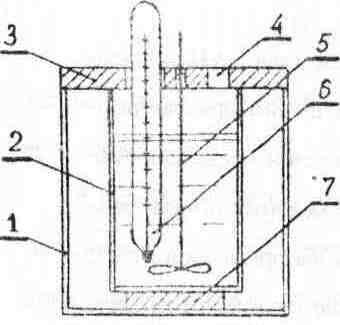
Калориметр состоит из наружного и внутреннего стаканов. Пространство между стаканами представляет собой изотермическую оболочку. Сверху стаканы закрыты крышкой из материала с малой теплопроводностью (например, пенопласта). В крышке устроены отверстия для мешалки, термометра, а также отверстие, через которое внутрь калориметра вводится исследуемое вещество, а также различные вещества или устройства, позволяющие оценить теплоемкость калориметрической системы. Внутренний стакан устанавливается на подставку из теплоизоляционного материала.
Принцип калориметрических измерений такого рода заключается в определении изменения (увеличения или уменьшения) температуры при протекании реакции в калориметре. Тепловой эффект реакции определяется как произведение постоянной калориметра (теплоемкости калориметрической системы Ск) на изменение температурыТ:
Н = Ск.с.Т (7.30)
Теплоемкостью калориметрической системы называют количество тепла, необходимое для ее нагрева на один градус.
Теплоемкость калориметрической системы можно определить различными способами. В приближенных измерениях ее вычисляют как сумму теплоемкости калориметрической жидкости и всех соприкасающихся частей калориметра, участвующих в теплообмене (стакан, мешалка, термометр и др.). Каждая из них равна произведению соответствующей удельной теплоемкости и массы, т.е.
Ск.с.=Сimi, (7.31)
где Сi– удельные теплоемкости отдельных частей системы;
mi – массы соответствующих частей.
В случае точных измерений значениеСк.снаходят в предварительных опытах, состоящих в том, что в калориметр вводят определенное количество тепла и измеряют изменение температуры. Теплоемкость калориметрической системы рассчитывается по формуле
Ск.с.=Н/t, (7.32)
где Н – количество тепла, сообщенное системе;
t – изменение температуры калориметрической системы в предварительных опытах.
В большинстве случаев предварительную калибровку калориметрической системы, т.е. определение ее теплоемкости по уравнению (7.32), осуществляют с помощью введения в систему нагретого тела, теплоты таяния льда, теплоты разбавления кислоты, теплоты растворения соли, нагрева системы электрическим током и др.
Погрешность результатов, полученных с использованием описанного калориметра и способов определения теплоемкости калориметрической системы, составляет 5 – 10%. Для получения более точных результатов измерения проводят на калориметрических установках, представляющих собой сложные приборы, в которых изменения температуры фиксируются с помощью электроизмерительных приборов с точностью до тысячных долей градуса и погрешность результатов измерения достигает 0,01%.
7.4. Закон Гесса
Как следует из первого и второго законов термодинамики, теплоты изохорного (V = const) и изобарного (Р = const) процессов имеют свойства функции состояния, и поэтому они не зависят от пути процесса, а определяются только начальным и конечным состоянием системы. Это положение относится и к тепловому эффекту: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути превращения веществ, т.е. от наличия и вида промежуточных реакций, через которые может протекать итоговая реакция.
Это важное заключение было дано русским химиком Г.И.Гессом на основании экспериментальных результатов в 1836 г. (еще до того, как были сформулированы законы термодинамики) и получило название закона Гесса.
Пусть тепловой эффект непосредственного превращения компонентов (итоговая реакция) равен сумме в соответствии с уравнениями (7.22) или (7.28) произведений молярных энтальпий компонентов на их стехиометрические коэффициенты, т.е.
![]() .
.
Эту реакцию можно представить в виде комбинации нескольких реакций, например двух (1) и (2); при этом продукт реакции (1) является промежуточным соединением, которое в реакции (2) превращается в конечный продукт. Тепловой эффект каждой из этих реакций равен соответственно
![]() ;
;![]() .
.
Уравнение итоговой реакции можно получить сложением уравнений первой и второй реакций, предварительно уравняв стехиометрические коэффициенты при промежуточном соединении в обоих уравнениях, для чего подбирают соответствующий множитель для каждого уравнения – (n1) и (n2). Такое уравнение приводит к сокращению промежуточного соединения в записанной сумме уравнений. Соответственно этому тепловой эффект итоговой реакции можно записать как сумму:
![]() +
+![]() =
=![]()
или ![]() .
.
Таким образом, тепловые эффекты можно складывать друг с другом точно так же, как уравнения химических реакций. Это положение также можно рассматривать как закон Гесса для тепловых эффектов. Неидеальность системы можно учесть, включив в цикл процессы замены среды (растворителя), разбавления (концентрирования) и т.д.
Возможность суммирования тепловых эффектов покажем на примере процесса окисления графита кислородом. Примем окисление графита до монооксида углерода за итоговую реакцию:
2С(графит)+ О2(г)= 2СО(г).
Тепловой эффект реакции
![]() =
=![]() кДж/моль
кДж/моль
Эту реакцию можно рассматривать как комбинацию двух реакций:
(1) С(графит)+ О2(г)= СО2(г) ,
![]()
![]() кДж/моль
кДж/моль
(2) 2СО(г)+ О2(г)= 2СО2(г),
![]()
![]() кДж/моль.
кДж/моль.
Уравнение итоговой реакции получим, если умножим уравнение реакции (1) на множитель 2 и из полученного уравнения вычтем уравнение реакции (2). Отсюда находим тепловой эффект итоговой реакции:
![]() кДж/моль
кДж/моль
или
![]() кДж/моль
кДж/моль
Представленный пример иллюстрирует независимость теплового эффекта от пути процесса. Складывать тепловые эффекты реакций, очевидно, можно только при одинаковых условиях (температуре и давлении), в качестве которых используют, как указывалось выше, стандартные условия.
Закон Гесса позволяет определить тепловые эффекты реакций, которые или невозможно измерить непосредственно, или по каким-либо причинам они не были измерены.
7.5. Следствия из закона Гесса
Закон Гесса имеет ряд следствий, которые можно объединить в три основных положения.
Положение I. Если совершаются два химических процесса, приводящие к образованию из одинаковых реагентов одинаковых продуктов, то независимо от пути обоих процессов их тепловые эффекты одинаковы, или разность между их тепловыми эффектами равна нулю.
Это положение объединяет два следствия.
Первое следствие: тепловой эффект разложения соединения точно равен и противоположен по знаку тепловому эффекту его образования из продуктов разложения (рис. 7.2)
К 1-2 II



![]()
К1,
К2
![]()
