
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Рис. 7.2 Иллюстрация первого следствия
из закона Гесса:
К1, К2 – продукты разложения;
К 1-2 – соединение;
IIиIi – cостояния системы
Второе следствие: тепловой эффект кругового процесса равен нулю. Это следствие является основой применения термохимических циклов для расчета тепловых эффектов различных процессов (рис. 7.3).

Рис. 7.3 Иллюстрация второго следствия из закона Гесса:
IиIi –основное состояние системы;
а, b, с –промежуточные состояния системы
![]()
![]()
Пример:
1) NН3(г)+ НСl(г)=NН4Сl(г) ;Н0 = -175,3 кДж/моль
NН4Сl(г)+nН2О(ж)=NН4Сl nН2О(р-р);Н0 = 16,3 кДж/моль
![]()
 кДж/моль
кДж/моль
2)
NН3(г)+
Н2О(ж)=NН3Н2О(р-р)
;![]() кДж/моль
кДж/моль
НСl(г)+
Н2О(ж)= НСl
nН2О(р-р);![]() кДж/моль
кДж/моль
НСl
nН2О(р-р)+NН3Н2О(р-р)=NН4Сl
nН2О(р-р)![]() кДж/моль
кДж/моль
![]() кДж/моль
кДж/моль
Положение II. Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным состояниям (из одинаковых исходных веществ образуются различные продукты), то разность между тепловыми эффектами этих реакций представляет собой тепловой эффект перехода из одного конечного состояния в другое (рис. 7.4).
Пример:
1)
S(г)+ 2О2(г)+
Н2(г) =SО3(г)+ Н2О(ж);![]() кДж/моль
кДж/моль
2)
S(г)+ 2О2(г)+
Н2(г) = Н2SО4(ж);![]() кДж/моль
кДж/моль
3)
SО3(г)+ Н2О(ж)= Н2SО4(ж);![]() кДж/моль
кДж/моль
т.е.
![]() кДж/моль
кДж/моль
Рис.
7.4 Иллюстрация положения II закона Гесса:
Обозначения: I– начальное
состояние;
II,III –
конечные состояния

![]()
I III
Из этого положения вытекают два следствия.
Первое следствие: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ (с учетом стехиометрических коэффициентов) – рис. 7.5.
![]()

Рис. 7.5 Иллюстрация следствия из закона Гесса
Пример:
SО3(г)+ Н2О(ж)= Н2SО4(ж);![]()
![]() =
=![]() кДж/моль.
кДж/моль.
Сравнение полученного результата с реакцией (3), приведенной в положении II, подтверждает это следствие.
Второе следствие: если конечные состояния в реакционных системах отличаются только агрегатным состоянием вещества, то разность тепловых эффектов таких реакций равна теплоте фазового перехода.
Пример:
Н2+ ½ О2= Н2О(г) ;
 =
-241,83 кДж/моль,
=
-241,83 кДж/моль,Н2+ ½ О2= Н2О(ж);
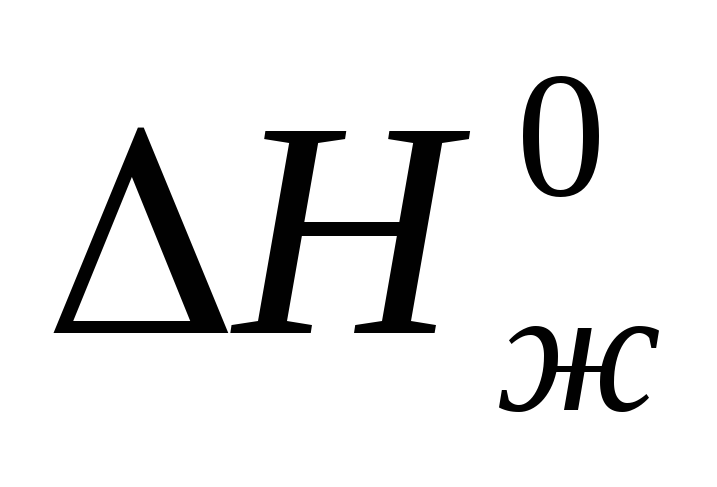 =
-285,84 кДж/моль,
=
-285,84 кДж/моль,Н2+ ½ О2= Н2О(т);
 =
-291,67 кДж/моль.
=
-291,67 кДж/моль.
Следовательно, тепловые эффекты процессов плавления, сублимации и испарения равны соответственно:
Н2О(т)Н2О(ж);![]() =5,83
кДж/моль
=5,83
кДж/моль
Н2О(т)Н2О(г);![]() =
49,84 кДж/моль
=
49,84 кДж/моль
Н2О(ж)Н2О(г);![]() =
44,01 кДж/моль
=
44,01 кДж/моль
Положение III. Если совершаются две реакции, приводящие из разных начальных состояний к одинаковым конечным состояниям (из различных исходных веществ образуются одинаковые продукты), то разность между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое (из одних исходных веществ в другие) – рис. 7.6.
Рис.
7.6 Иллюстрация положения III закона
Гесса:
I– конечное состояние;
II,III–
начальные состояния

![]()
I III
Например, тепловой эффект реакции окисления графита до монооксида углерода (СО) нельзя определить непосредственным измерением, так как одновременно с этой реакцией всегда имеет место образование диоксида углерода (СО2). Для определения теплового эффекта этой реакции используются известные тепловые эффекты следующих реакций:
1)
С(графит)+ О2(г)= СО2(г);![]() -393,296
кДж/моль;
-393,296
кДж/моль;
2)
СО(г)+ ½ О2(г)= СО2(г);![]() -284,512
кДж/моль;
-284,512
кДж/моль;
Тепловой эффект реакции определяется с помощью положения III
С(тв)+ ½ О2(г)= СО(г);![]() -108,784
кДж/моль,
-108,784
кДж/моль,
![]()
![]() -
-![]() =
-393,296 –(-284,512 ) = -108,784 кДж/моль;
=
-393,296 –(-284,512 ) = -108,784 кДж/моль;
или
![]()
![]() =
-108,784 кДж/моль
=
-108,784 кДж/моль
Данное положение имеет три следствия.
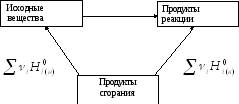
Первое следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов) –рис.7.7.
![]()
![]()
Рис. 7.7. Иллюстрация следствия из закона Гесса
Пример:
С6Н6(ж) 3С2Н2(г) ;
Н0 = 3НС1(С2Н2) – Н0С2(С6Н6).
Известны энтальпии сгорания:
С6Н6(ж) + 7 ½ О2(г) = 6СО2(г) + 3Н2О(г) ; Н0 = -3301,51 кДж/моль,
С2Н2(г) + 2 ½ О2(г) = 2СО2(г) + Н2О(г) ; Н0 = -1299,63 кДж/моль.
Здесь Н0 приведены для 1 моль С6Н6(ж) и С2Н2(г), подвергшихся сгоранию.
Отсюда Н0 = -3301,51 – 3(-1299,63) = 597,38 кДж/моль.
Второе следствие: если вещество, находящееся в разных модификациях, вступает в одну и ту же реакцию, то разность тепловых эффектов этих реакций равна теплоте перехода вещества из одной модификации в другую.
Пример:
С(графит) + О2(г) = СО2(г) ; Н0 = -393,51 кДж/моль
С(алмаз)
+ О2(г)
= СО2(г)
; Н0
= -395,34 кДж/моль
С(графит) С(алмаз) ; Н0 = 1,83 кДж/моль
Третье следствие: зная теплоты (энтальпии) образования элементарных веществ, на основе закона Гесса можно найти энергии химических связей.
Проиллюстрируем это следствие на примере определения энергии связи С-Н. Запишем две реакции с различным начальным и одинаковым конечным состоянием, а именно, взаимодействие газообразных элементарных углерода и водорода с образованием молекулы СН4 (метана) и взаимодействие графита и молекулярного водорода с образованием также СН4 :
1)
С(г)
+ 4Н(г)
= СН4(г)
; ![]()
2)
С(графит)
+ 2Н2(г)
= СН4(г)
; ![]() =
-74,85 кДж/моль.
=
-74,85 кДж/моль.
Первая реакция позволяет
определить искомую энергию связи С-Н
[Е(С-Н)= ¼
![]() ],
а вторая реакция дает возможность
получить необходимые дополнительные
данные из справочной литературы.
],
а вторая реакция дает возможность
получить необходимые дополнительные
данные из справочной литературы.
Переходы веществ в газообразное атомное состояние сопровождаются тепловыми эффектами:
3)
С(графит)С(г);![]() =
716,67 кДж/моль,
=
716,67 кДж/моль,
Н2(г)2Н (г);
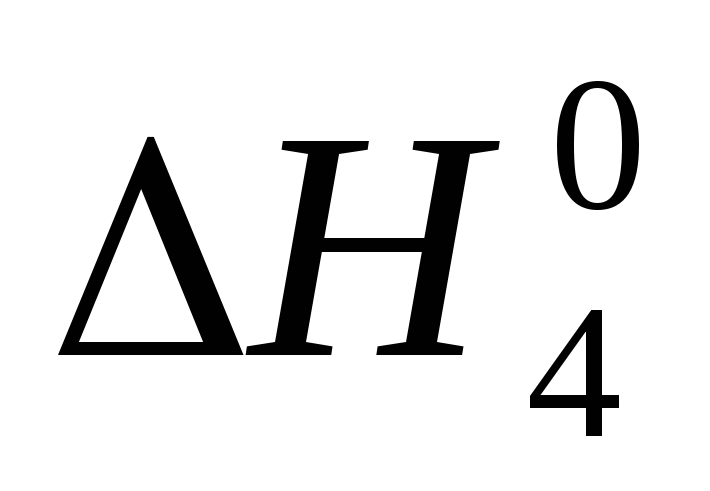 =
435,96 кДж/моль.
=
435,96 кДж/моль.
Согласно положению IIIразность между тепловыми эффектами (1) и (2) дает тепловой эффект перехода из одного начального состояния в другое, т.е.
![]() -
-
![]() =
=![]() + 2
+ 2![]() ;
;
-![]() = 716,67 + 2435,96
+ 74,85 = 1663,44 кДж/моль
= 716,67 + 2435,96
+ 74,85 = 1663,44 кДж/моль
или
![]() = - 1663,44 кДж/моль.
= - 1663,44 кДж/моль.
Отсюда энергиячетырех связей С-Н (т.е. энергия, необходимая для разрыва связей) равна 4Е(С-Н) = 1663,44 кДж/моль. Следовательно, Е(С-Н) = 415,86 кДж/моль.
Аналогичным образом можно рассчитать энергии связей между атомами других элементов, подбирая соответствующие соединения.
В настоящее время накоплено значительное количество сведений по энергиям разрыва химических связей, рассчитанных на основе термохимического метода.
7.6. Зависимость теплового эффекта от
температуры. Уравнение Кирхгофа
Изменение системы, обусловленное одновременным изменением Т и Р, можно представить в виде двух процессов, один из которых вызван изменением только температуры, а другой – только давления. Поэтому можно изучать зависимость теплового эффекта реакций от каждого из этих факторов в отдельности. Впрочем, поскольку изменение Н с изменением Р проявляется лишь при очень высоких давлениях, значительно больший практический интерес представляет вопрос о влиянии температуры на тепловой эффект реакции.
При Р=constтеплота процесса определяется изменением энтальпии. Как функцию температуры и состава системы (химической переменной) ее можно представить следующим тождеством:
![]() ,
(7.33)
,
(7.33)
где
![]() =
СР– теплоемкость при Р =const.
=
СР– теплоемкость при Р =const.
Производные по химической переменной в уравнении (7.33) можно выразить через парциальные молярные величины (при постоянных пераметрах Р и Т), тогда
![]() (7.34)
(7.34)
или
![]() ,
(7.35)
,
(7.35)
где
![]() -
парциальная молярная теплоемкость при
Р=const компонента i.
-
парциальная молярная теплоемкость при
Р=const компонента i.
Уравнения (7.33), (7.34) и (7.35) называются уравнениями Кирхгофа.
Для тепловых эффектов идеальной системы, т.е. эффектов, отнесенных к единице химической переменной или к одному молю основного компонента, уравнение Кирхгофа принимает вид
![]() .
(7.36)
.
(7.36)
Для процессов перехода вещества из одной фазы (1) в другую (2) или его превращения из одной модификации в другую, сумма теплоемкостей, записанная в уравнениях (7.35) и (7.36), соответствует разности теплоемкостей этого вещества в одной и другой фазах:
![]() и
и![]() .
(7.37)
.
(7.37)
По уравнению Кирхгофа рассчитывают теплоту химического процесса при любой температуре, если известны теплоты этого процесса для одной температуры и парциальные молярные теплоемкости участвующих в процессе веществ.
Уравнение Кирхгофа (7.36) можно получить также с помощью закона Гесса. Для примера рассмотрим простой процесс АВ, который можно провести или при температуре Т1, или при температуре Т2. Если известна энтальпия реакции при Т1, то ее можно рассчитать и при Т2при условии, что теплоемкости А и В известны.
Переход от А при Т2к В при Т2можно осуществить двумя путями:
Н2
 А
В
А
В
Т2
Н1
А В
Т1
Первый путь – проведение реакции А В при Т2(тепловой эффект реакцииН2). Второй путь более сложный: изменение темпертуры исходного вещества А (от Т2до Т1)); далее проведение реакции АВ при температуре Т1(тепловой эффект реакцииН1); наконец изменение температуры продукта реакции В (от Т1до Т2). Тогда изменение энтальпии реакции при Т2, в соответствии с законом Гесса, можно записать в виде
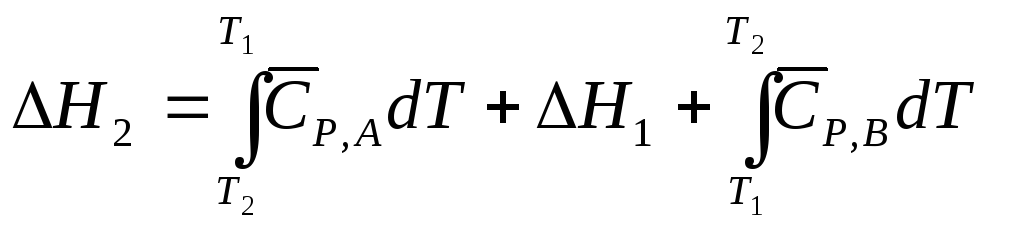 ,
,
так как изменение энтальпии не зависит от пути перехода между двумя состояниями. Это уравнение удобно записать в виде
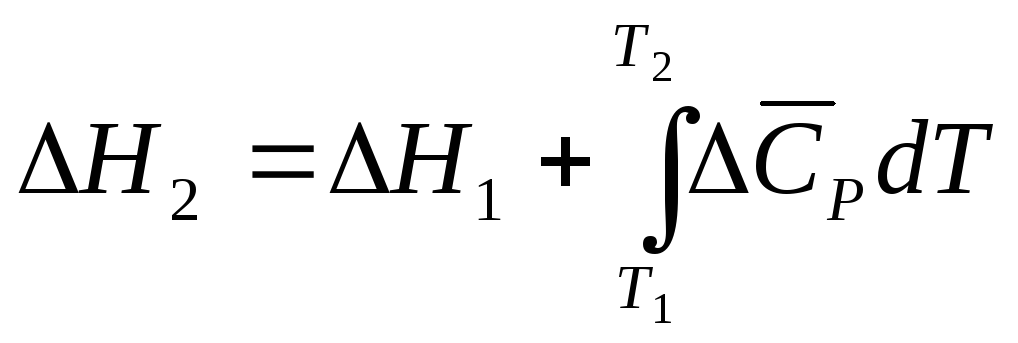 , (7.38)
, (7.38)
где
![]() .
.
Уравнение (7.38) представляет собой уравнение Кирхгофа (7.34) в интегральной форме.
По
аналогии с предыдущим, учитывая, что
![]() (5.48), зависимость теплового эффектаU
реакции при Т,V = сonst от температуры можно
записать в виде
(5.48), зависимость теплового эффектаU
реакции при Т,V = сonst от температуры можно
записать в виде
![]() (7.39)
(7.39)
И з
уравнения Кирхгофа (7.34) следует, что
чувствительность теплоты процессаНР,Тк изменению
температуры определяется абсолютным
значением дифференциального изменения
теплоемкости системы
з
уравнения Кирхгофа (7.34) следует, что
чувствительность теплоты процессаНР,Тк изменению
температуры определяется абсолютным
значением дифференциального изменения
теплоемкости системы![]() или
или![]() ,
а знак производной
,
а знак производной![]() определяется знаком разности
теплоемкостей
определяется знаком разности
теплоемкостей ![]() реагентов и продуктов реакции (рис.
7.8).
реагентов и продуктов реакции (рис.
7.8).
![]()
![]()
![]()
![]()
![]()

![]()
![]()
 Т
Т
![]()
![]()
![]()
![]()
![]()
![]()
Н=f(Т) Т
Рис.
7.8. К определению характера зависимости
теплового эффекта от температуры:
![]() – теплоемкости исходных веществ;
– теплоемкости исходных веществ;![]() – теплоемкости продуктов реакции.
– теплоемкости продуктов реакции.
Из диаграмм, представленных на рис. 7.8,
следует, что если суммарная теплоемкость
продуктов реакции
![]() больше суммарной теплоемкости исходных
веществ
больше суммарной теплоемкости исходных
веществ![]() ,
т.е.
,
т.е.
![]() ,
то значение теплового эффекта этой
реакции увеличивается с повышением
температуры. Если суммарная теплоемкость
продуктов реакции меньше суммарной
теплоемкости реагентов (исходных
веществ), т.е.
,
то значение теплового эффекта этой
реакции увеличивается с повышением
температуры. Если суммарная теплоемкость
продуктов реакции меньше суммарной
теплоемкости реагентов (исходных
веществ), т.е.![]() ,
то значение теплового эффекта такой
реакции уменьшается с увеличением
температуры. И, наконец, если продукты
реакции и реагенты имеют одинаковую
суммарную теплоемкость, то тепловой
эффект реакции не зависит от температуры.
,
то значение теплового эффекта такой
реакции уменьшается с увеличением
температуры. И, наконец, если продукты
реакции и реагенты имеют одинаковую
суммарную теплоемкость, то тепловой
эффект реакции не зависит от температуры.
Для расчета приращения теплот реакции с изменением температуры системы проводят интегрирование уравнения Кирхгофа. Интегрируя уравнение (7.34) в интервале температур от 0 до Т, получаем
 ;
;
![]() , (7.40)
, (7.40)
где Н0–константа интегрирования, представляющая собой гипотетическую теплоту реакции при абсолютном нуле.
Можно интегрировать уравнение (7.34) и в интервале от 298 К до Т, отталкиваясь от константы интегрирования Н0. При Р=1 атм получаем выражение
![]() .
(7.41)
.
(7.41)
Чаще всего парциальные молярные
теплоемкости и тем более их зависимости
от температуры неизвестны. Поэтому
расчеты ведут по молекулярным теплоемкостям
(в уравнении (7.35) вместо
![]() записывают
записывают![]() ),
используемым при описании идеальных
систем.
),
используемым при описании идеальных
систем.
Интегрирование уравнений Кирхгофа в зависимости от требований к точности расчетов можно провести в нескольких приближениях.
В первом приближении допускается, что теплоемкости реагентов и продуктов реакции одинаковы в данном интервале температур. Тогда для узкого интервала температур
т.е. ![]() (7.42)
(7.42)
или Н2 = Н1 = const, (7.43)
т.е. тепловой эффект считается независимым от температуры.
В более точном приближении интегрирования уравнения Кирхгофа принимают, что теплоемкости компонентов не зависят от температуры
![]() .
(7.44)
.
(7.44)
При таком условии в уравнении (7.41) СРможно вынести за знак интеграла, тогда получим
![]() .
(7.45)
.
(7.45)
Таким образом, температурная зависимость
теплового эффекта является линейной,
так как
![]() - постоянная величина.
- постоянная величина.
Аналогичное уравнение получается при использовании средних теплоемкостей компонентов реакции в данном интервале температур.
Наиболее точное приближение при интегрировании уравнения Кирхгофа учитывает зависимость СРот температуры. ЗависимостьСР=f(Т) обычно получают с помощью степенных рядов (5.59) и (5.60). При этом теплоемкости компонентов следует выражать через степенные температурные ряды одинаковой формы.
Из уравнений (5.59) и (5.60) следует, что
СР = а + вТ + сТ2 + c`Т-2. (7.46)
Изменения коэффициентов а, в, с и с`определяются соотношениями:
![]()
![]()
![]()
![]() . (7.47)
. (7.47)
Подставляя уравнение (7.46) в уравнение Кирхгофа (7.41), получим при стандартных условиях
![]() .
(7.48)
.
(7.48)
После интегрирования будем иметь зависимость Н=f(Т) в конечном виде:
![]()
![]()
(7.49)
По уравнению (7.49) можно рассчитать тепловой эффект при любой температуре, если известен тепловой эффект реакции при стандартной температуре и если температура находится в интервале, в котором справедливо соотношение СР =f(Т).
Пример.
Составьте уравнение зависимости теплового эффекта химической реакции
CH4(г) + 4SO2Cl2 = CCl4(г) + 4SO2(г) + 4HCl(г)
от температуры. Рассчитайте тепловой эффект этой реакции при 1000 К и давлении 1,0133 105Па (см. таблицу)
Данные для решения выпишем из справочника [ ]
|
Вещество |
кДж/моль |
Коэффициенты уравнения Ср= а +bT + cT2 + c/T-2, Дж/моль·К |
Интервал температур | |||
|
а |
b·103 |
c·106 |
c/·10-5 | |||
|
СН4(г) СCl4(г) SO2Cl2(г) SO2(г) HCl(г) |
– 74,85 – 100,42 – 363,17 – 296,9 – 92,31 |
14,32 59,36 87,91 46,19 26,53 |
74,66 97,0 16,15 7,87 4,6 |
– 17,43 – 49,57 – – – |
– – – 14,23 – 7,7 1,09 |
298 – 1500 298 – 1000 298 – 1000 298 – 2000 298 – 2000 |
Решение
Воспользуемся уравнением (7.49).
Рассчитаем коэффициенты Δа, Δb, Δc, Δc/:
Δа = 59,36 + 4 46,19 + 4 26,53 – 14,32 – 4 87,91 = – 15,72,
Δb = (97,0 + 4 7,87 + 4 4,6 – 74,66 – 4 16,15) 10-3= 7,62 10-3,
Δс = (–49,57 – 4(–17,43)) 10-6 = 20,15 10-6,
Δс/ = [4(–7,7) + 4·1,09 – 4 (–14,23)]·105 = 30,48 105,
![]() =
–100,42 + 4(–296,9) + 4(–92,31) – (–74,85) – 4 (–363,17)
= –129,73 кДж/моль
=
–100,42 + 4(–296,9) + 4(–92,31) – (–74,85) – 4 (–363,17)
= –129,73 кДж/моль
![]() = –129730 – 15,72(Т–298) +
= –129730 – 15,72(Т–298) +![]() (Т2– 2982) +
(Т2– 2982) +![]() (Т3– 2983) – 30,48 105(
(Т3– 2983) – 30,48 105(![]() –
–![]() )
= – 129730 – 15,72 Т + 4864,56 + 3,81 10-3Т2– 338,34 + 6,716 10-6Т3–
)
= – 129730 – 15,72 Т + 4864,56 + 3,81 10-3Т2– 338,34 + 6,716 10-6Т3–![]() .
.
Таким образом, зависимость
![]() =f(Т)
имеет вид:
=f(Т)
имеет вид:
![]() =
– 115333,34 – 15,72Т + 3,81 10-3Т2+
6,716 10-6Т3–
=
– 115333,34 – 15,72Т + 3,81 10-3Т2+
6,716 10-6Т3–![]() .
.
Тепловой эффект реакции при Т=1000 К равен:
![]() =
– 115333,34 – 15,72 1000 + 3,81 10-310002+
=
– 115333,34 – 15,72 1000 + 3,81 10-310002+
6,716 10-310003–![]() = – 123575,34 Дж/моль.
= – 123575,34 Дж/моль.
