
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
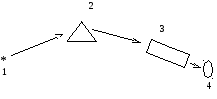
Рис. 2.14 Схема получения спектров:
1 – источник света; 2 – монохроматор; 3 – измерительная
ячейка; 4 – индикатор излучения
Для получения спектральных характеристик в разных областях спектра используют различные узлы.
УФ – области
1. Водородная или ртутная лампа
2. Монохроматор – дифракционная решетка
3. Ячейка из кварца или флюорита СаF2
4. Фотоэлемент.
Видимая область
1. Лампа накаливания
2. Призмы или дифракционные решетки
3. Ячейки из стекла
4. Фотоэлемент
ИК–область
1. Нагретые тела
2. Дифракционные решетки
3. Ячейки из галогенидов щелочных металлов
4. Индикатор излучения – термометр сопротивления
Д ля
изображения спектров чаще используют
графический метод (рис. 2.15). На графиках
по оси У откладывают фактор поглощения
(коэффициент пропускания, % пропускания,
оптическую плотность), а по оси Х фактор
частоты (частота, волновое число, длины
волн).
ля
изображения спектров чаще используют
графический метод (рис. 2.15). На графиках
по оси У откладывают фактор поглощения
(коэффициент пропускания, % пропускания,
оптическую плотность), а по оси Х фактор
частоты (частота, волновое число, длины
волн).
Рис. 2.15 Графическое изображение спектров.
Узкая область длин волн называется линией. Полоса поглощения – полоса, наблюдаемая в широком интервале длин волн, т.е. полоса – группа линий. С уменьшением структура спектра усложняется, и в УФ-области сплошные полосы поглощения.
Коэффициент пропускания, процент пропускания, оптическая плотность. Оптическая плотность – аддитивное свойство.
П усть
кювета с толщиной слояl
заполнена средой, поглощающей излучение.
Это может быть газ, жидкость, твердое
тело, индивидуальное вещество или
растворы.
усть
кювета с толщиной слояl
заполнена средой, поглощающей излучение.
Это может быть газ, жидкость, твердое
тело, индивидуальное вещество или
растворы.
Ослабление света зависит от толщины слоя l и, во-вторых, от концентрации поглощения частиц С, а также устанавливает характер этой зависимости количественно.
Первую зависимость называют законом Ламберта – Бугера: каждый тонкий слой постоянной толщины внутри однородной среды поглощает одинаковую долю падающего на него светового потока.
Вторая зависимость носит название закона Беера: поглощение света данным тонким слоем внутри однородной среды пропорционально числу поглощающих частиц в единице объема, т. е. концентрации.
Обе эти зависимости обычно объединяют и называют законом светопоглощения Ламберта – Бугера – Беера.
М
-dJ/ J
Для монохроматического пучка света можно записать:
– dJ
/ J = k C dl
,
где k – коэффициент поглощения.
После интегрирования
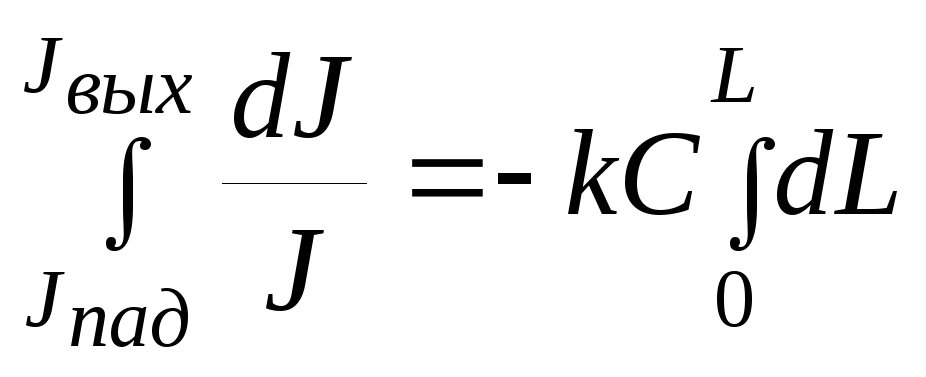 (2.68)
(2.68)
получаем
![]() (2.69)
(2.69)
Jвых = Jпад e–k C L (2.70)
Таким образом, при прохождении монохроматического света через поглощающую среду его интенсивность уменьшается в зависимости от L и C экспоненциально.
На практике приходится, однако, учитывать, что ослабление светового потока в кювете происходит как в результате поглощения, так и в результате рассеяния. Особенно сильно эти явления проявляются при прохождении пучка через границу раздела фаз у стенок кюветы (рис.2.17).
Е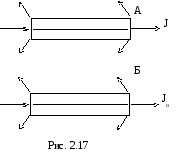 сли
пропустить свет через такую же кювету,
но заполненную непоглощающей средой
(например, прозрачным растворителем в
случае исследования раствора), то в ней
ослабление светового потока произойдет
только из-за рассеяния и отражения от
стенок кюветы. Таким образом, для учета
собственной поглощающей способности
вещества необходимо сравнивать световой
потокJ,
прошедший сквозь кювету с поглощающим
веществом, и световой поток Jo
, прошедший через кювету сравнения:
сли
пропустить свет через такую же кювету,
но заполненную непоглощающей средой
(например, прозрачным растворителем в
случае исследования раствора), то в ней
ослабление светового потока произойдет
только из-за рассеяния и отражения от
стенок кюветы. Таким образом, для учета
собственной поглощающей способности
вещества необходимо сравнивать световой
потокJ,
прошедший сквозь кювету с поглощающим
веществом, и световой поток Jo
, прошедший через кювету сравнения:
Jo
J
ln = k C L , (2.71)
J = Jo e–k C L (2.72)
П
Jo
J
lg = D , (2.73)
п
k
2,3
олучаемD = C L. (2.74)
Величину D называют оптической плотностью (экстинкцией, погашением), а дробь k/2,3 – коэффициентом погашения (коэффициентом экстинкции) и обозначают через .
= k/2,3 (2.75)
Окончательно закон светопоглощения обычно записывают в виде:
D = Е С L. (2.76)
На основании уравнения (2.76) можно дать следующую формулировку объединенного закона светопоглощения Ламберта –Бугера – Беера: при данной длине волны оптическая плотность прямо пропорциональна концентрации поглощающих частиц и толщине поглощающего слоя. Оптическая плотность обладает свойством аддитивности, т. е. оптическая плотность смеси веществ, подчиняющихся закону светопоглощения и не вступающих в химическое взаимодействие друг с другом, равна сумме оптических плотностей компонентов при L = сonst:
D
=
![]() =
=
![]() .
(2.77)
.
(2.77)
При использовании объемной концентрации (молярность, моль/л) коэффициент погашения называют молярным коэффициентом погаше-ния. Физический смысл его выражается формулой:
= D (при l = 1 см и С = 1 моль/л)
Кроме величины оптической плотности на практике часто используют величину Т – пропускание (в процентах):
Т
=
![]() 100
% . (2.78)
100
% . (2.78)
Величины D и T связаны соотношением:
D = 2 - lg (2.79)
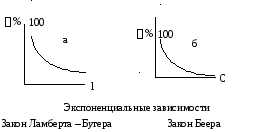
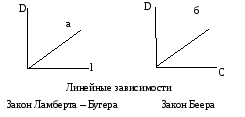
Рис. 2.18 Способы графического представления
законов светопоглощения
Превращение энергии при поглощении. Если не рассматривать внутриядерную энергию, то полная энергия молекулы складывается в первом приближении из энергии электронов Еэл, колебания ядер Екол, вращения молекулы как целого Евр и энергии ее поступательного движения Еt:
Е = Еэл + Екол + Евр + Еt . (2.80)
Первые три вида движения подчиняются квантовым законам, энергия же поступательного движения может меняться непрерывно. При переходе молекулы из одного состояния в другое могут изменяться все составляющие энергии и в общем случае энергия поглощенного кванта:
h = Е′ – E″ = (Е′эл – E″эл) + (Е′кол – E″кол) + (Е′вр – E″вр). (2.81)
Взаимное расположение электронных, колебательных и вращательных квантовых уровней и переходы между ними определяют вид и структуру молекулярного спектра.
Д
Н = Е , (2.82)
г
где Н – оператор Гамильтона;
2 = d2/dx2 + d2/dy2+ d2/dz2 – оператор Лапласа;
Е – полная энергия молекулы;
u – потенциальная энергия молекулы;
m – масса частицы .
Полная энергия Е определяется суммой (2.81), а волновая функция, описывающая состояния системы из ядер и электронов (за исключением поступательного движения молекулы), дается как произведение электронной, колебательной и вращательной волновых функций:
= эл кол вр .
Функция , описывающая реальные состояния молекулы, должна быть конечна, однородна, непрерывна и должна превращаться в нуль при бесконечном удалении от молекулы. При указанных условиях уравнение (2.81) будет иметь решение только при определенных, так называемых собственных значениях энергии Е.
Сопоставим вклады различных видов движения в общую энергию молекулы на примере Н2. Вклад различных видов молекулярного движения в энергию 1 моль водорода при 291 К (кДж/моль):
электронная энергия – 3095;
колебательная энергия – 25,9;
вращательная энергия – 2,5.
Из приведенных данных можно сделать важные заключения:
1) каждый вид молекулярного движения можно рассматривать независимо друг от друга, хотя в молекуле все эти виды движения взаимосвязаны и совершаются одновременно;
2) основой такого разделения служит тот факт, что электронная энергия значительно больше колебательной, а последняя, в свою очередь, примерно на порядок превосходит вращательную энергию молекулы:
Еэл >> Екол >> Евр ; (2.83)
3) такая разница в энергиях показывает, что для возбуждения того или иного вида молекулярного движения требуется существенно различная энергия: меньше всего – для возбуждения вращательного движения, заметно больше – для возбуждения колебательного и несоизмеримо больше энергии необходимо затратить на возбуждение электронов.
Если сопоставить энергию различных видов движения для молекулы водорода с энергиями квантов в соответствующих областях спектра (таблица 2.2), то легко заметить, что энергия электромагнитного излучения в видимой и УФ областях соизмерима с электронной энергией молекул; в ближней и средней ИК-областях она имеет тот же порядок, что и энергия колебаний ядер в молекуле, а в дальней ИК и микроволновой областях – соответствует энергии вращения молекул.
Т а б л и ц а 2.2
Энергия квантов в различных областях электромагнитного спектра
|
Область спектра |
Энергия Е, кДж/моль Е = hNa |
Молекулярный процесс – причина поглощения |
|
Микроволновая Дальняя ИК |
0,0012 – 0,12 0,12 – 2,4 |
Вращение молекул |
Т а б л и ц а 2.2 (окончание)
|
Средняя ИК Ближняя ИК |
2,4 – 60 60 – 155 |
Колебания ядер атомов в молекуле |
|
Видимая Ближняя УФ Дальняя УФ |
155 – 300 300 – 598 598 – 12000 |
Переходы валентных электронов |
Хотя численные значения различных составляющих энергии для других молекул будут иными, чем для водорода, подобное сопоставление чаще всего приводит к аналогичным результатам.
Полезно отметить, что энергия, необходимая для разрыва связи между атомами в молекуле Ехим св (для Н2) = 7·10-9 Дж/молекулу или 425 кДж/моль сравнима с энергией кванта в УФ или видимой области спектра. Поэтому электронное возбуждение нередко сопровождается распадом молекулы или другими фотохимическими процессами. Изучая поглощение вещества в различных областях спектра, мы как бы «настраиваемся» на возбуждение различных молекулярных процессов, а это позволяет рассматривать проблему строения молекул с различных сторон.
