
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Решение
![]() ,
,
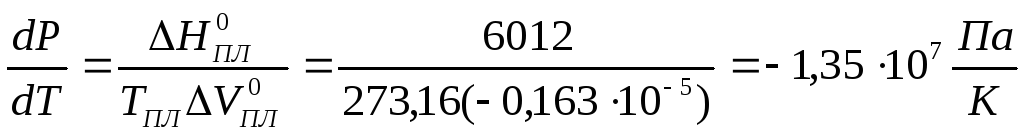 ,
,
![]() .
.
В пересчете на 1 атм. это составит
![]() .
.
Таким образом, при увеличении давления на 1 атм. температура плавления льда понижается всего на 0,00750.
Пример 2
Как
изменится температура кипения воды с
ростом давления, если
![]() ,
мольные объемы жидкой воды и пара равны
соответственно 1,8·10
,
мольные объемы жидкой воды и пара равны
соответственно 1,8·10![]() и 0,0224
и 0,0224![]() ?
?
Решение
![]() ,
,
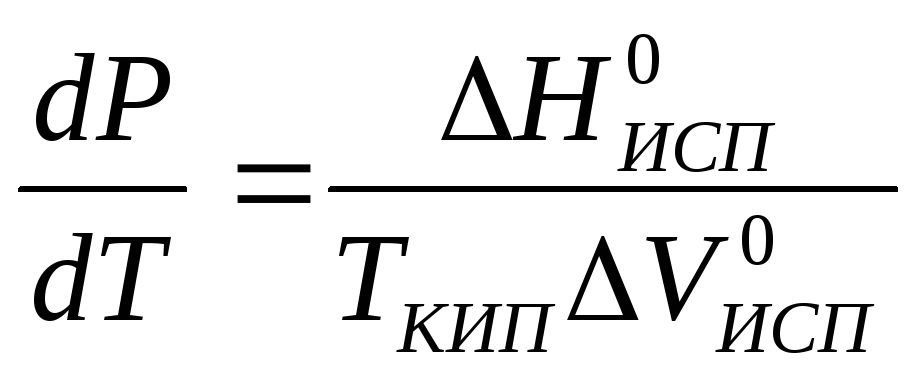 ,
отсюда
,
отсюда
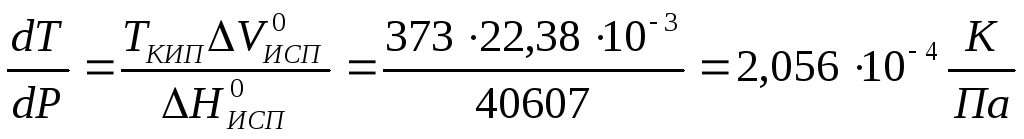 ,
или в пересчете на 1 атм.
,
или в пересчете на 1 атм.
![]() ,
,
т.е. с увеличением давления на 1 атм. температура кипения повышается на 20,830. На этом явлении работают скороварки.
11.13. Диаграмма состояния однокомпонентной системы
Диаграмма состояния - это графическое изображение зависимости состояния системы и фазовых равновесий в ней от внешних условий.
Рассмотрим однокомпонентную систему - воду. Запишем уравнение Гиббса С=К-Ф+2-r, посколькуr=0,К=1,тоС=3-Ф.
Максимальное число степеней свободы в любой системе определяется минимальным числом фаз Фmin=1. Поэтому для однокомпонентной системы Сmax=2, т.е. состояние системы определяется двумя переменными - температурой и давлением. Максимальное число одновременно сосуществующих фаз будет равно 3, так как при Сmin=0, Фmax=3.
Когда твердая фаза имеет лишь одну модификацию, тремя фазами, находящимися в равновесии, являются жидкая, твердая и газообразная фазы. В такой простейшей однокомпонентной системе возможны следующие двухфазные равновесия:
жидкая фаза – пар;
жидкая фаза - твердая фаза;
твердая фаза - пар.
Каждое из этих равновесий характеризуется определенной кривой Р=Р(Т) (рис. 11.7). Положение этих кривых можно определить аналитически по уравнению Клаузиуса-Клапейрона.
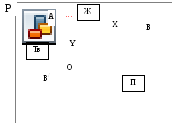
Т
Рис. 11.7. Диаграмма состояния воды.
Кривые: ОВ – испарения и возгонки; ОА – плавления и кристаллизации; ОС – возгонки и сублимации.
Каждая из этих кривых отражает равновесие двух фаз. Линия ОА - равновесие твердая фаза – жидкая; ОВ - равновесие жидкая фаза – пар; ОС - равновесие твердая фаза - пар.
Линия
![]() ,
являющаяся продолжением линии ОВ,
определяет давление насыщенного пара
над переохлажденной водой. Такое
состояние неустойчиво, так как
переохлажденная вода всегда обладает
большим давлением пара, т.е. большим
химическим потенциалом, чем лед при той
же температуре. Переохлажденная вода
находится в метастабильном равновесии
с паром. При внесении в такую воду
несколько кристалликов льда произойдет
быстрое замерзание ее.
,
являющаяся продолжением линии ОВ,
определяет давление насыщенного пара
над переохлажденной водой. Такое
состояние неустойчиво, так как
переохлажденная вода всегда обладает
большим давлением пара, т.е. большим
химическим потенциалом, чем лед при той
же температуре. Переохлажденная вода
находится в метастабильном равновесии
с паром. При внесении в такую воду
несколько кристалликов льда произойдет
быстрое замерзание ее.
Рассмотрим процесс испарения.
Уравнение
Клаузиуса-Клапейрона
![]()
![]()
При
испарении ![]()
![]() и
и![]() ,
значит
,
значит![]() ,
,
т.е. с увеличением температуры увеличивается давление.
В
точке В линия ОВ прекращается и далее
она не существует. Исчезает различие
между фазами, исчезает и поверхность
раздела, тепловой эффект фазового
перехода стремится к нулю (![]() )
– этокритическая
точка.
Для воды она наступает при Ткр=647,3
К и Ркр=2,212·107
Па,
)
– этокритическая
точка.
Для воды она наступает при Ткр=647,3
К и Ркр=2,212·107
Па,
![]() ,
,![]() =56
=56![]() .
.
Процесс возгонки
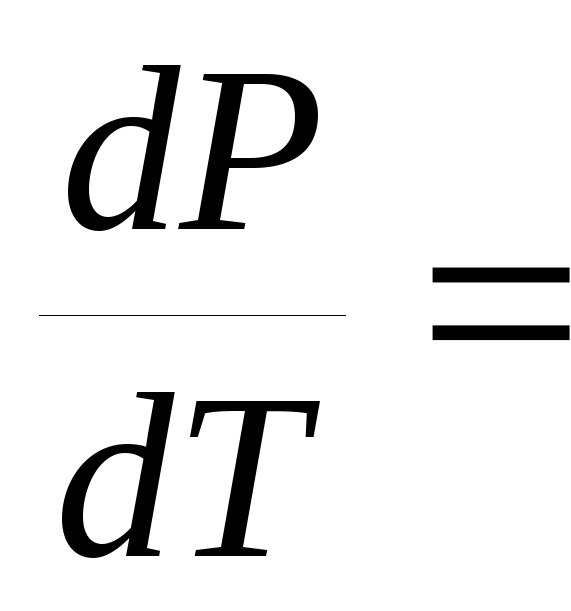
 .
.
При
возгонке
![]()
![]() ,
,![]() ,
,![]() ,
значит
,
значит![]() ,
,
т.е. с увеличением температуры давление увеличивается.
Процесс плавления.
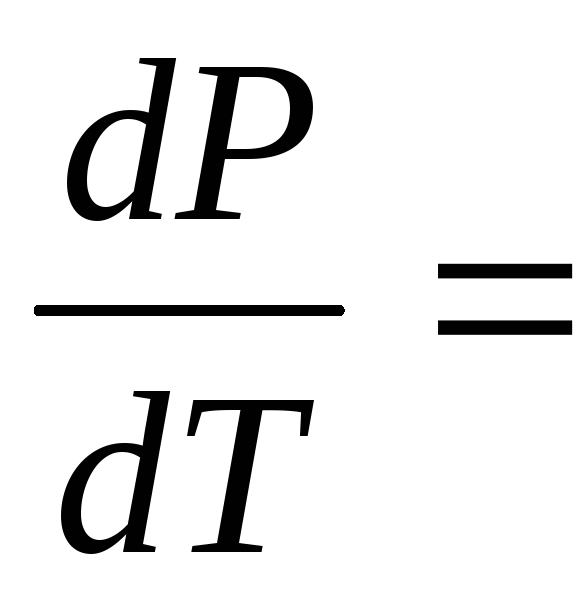
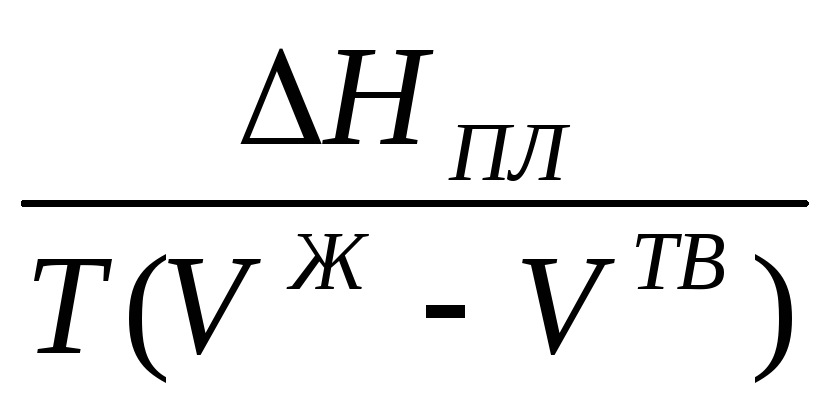 .
.
При
плавлении
![]()
![]() (
(![]() <0,
значит
<0,
значит
![]() ,
,
т.е. с увеличением температуры давление уменьшается. Этим и объясняется наклон линии плавления.
Определим вариантность системы для нескольких точек на диаграмме.
Точка Х. Правило фаз Гиббса С=3-Ф. Число фаз в этой точке Ф=1, тогда С=2. Система бивариантна, т.е. состояние системы определяется двумя переменными - давлением и температурой.
Точка У. Число фаз Ф=2, С=1. Система моновариантна, т.е. произвольно менять можно только один из параметров (например, температуру), другой же должен изменяться в зависимости от первого.
Точка О. Число фаз Ф=3, С=0. Система нонвариантна. Это означает, что равновесие может быть только при строго определенных величинах температуры и давления насыщенного пара, одинаковых для твердой и жидкой фаз. Изменение хотя бы одного параметра нарушает равновесие и вызывает исчезновение, по меньшей мере, одной фазы.
Геометрическим образом нонвариантной системы, является так называемая тройная точка О, в которой сходятся кривые кипения, возгонки и плавления. Тройной точке воды соответствует Т=273,1576К и Р=6,09.102Па.
Заключение
Рассмотренные в настоящем учебном пособии подходы к определению и расчетам молекулярных констант и термодинамических параметров состояния физико-химических систем, по мнению авторов, позволят обучающимся в дальнейшем осознанно осуществлять расчеты балансов химических реакций, прогнозировать интенсивность и направленность химических процессов.
Во второй части учебного пособия, предлагаемого к изданию, авторы попытаются конкретизировать эти подходы с учетом агрегатного состояния веществ, дополнить изложенную систему взглядов приложением к расчетам химико-технологического характера применительно к различым видам физико-химических систем. Кроме того, во второй части учебного пособия будут изложены основные принципы учения о скоростях химических процессов как с позиций формальной кинетики, так и с позиций неравновесной химической термодинамики.
1 В физическом смысле термин "точка" означает очень малую по сравнению с системой, но все еще макроскопическую область.
*В дальнейшем, для упрощения записи, индексы «е» для такой системы опускаются.
