
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
![]()
= с/
(ж
- пара)4
. (2.1)
= с/
(ж
- пара)4
. (2.1)
На рис. 2.3 представлена схема изменения межфазного поверхностного натяжения вблизи границ ы раздела фаз «жидкость – пар» (– фаза пара,– фаза жидкости). На рисунке видно, что в пределах некоторой толщиныhповерхностного слоя происходит монотонное увеличение поверхностного натяжения, по мере приближения к границе раздела фаз, достигая максимума непосредственно на границе раздела.
Поверхностное натяжение (,) численно равно работе по образованию единичной поверхности и имеет размерность Дж/м2 (СИ) или эрг/см2 (CГС). Кроме того, оно характеризует некомпенсированность межмолекулярных сил по мере перехода из одного (обычно жидкого) в другое (газообразное) состояние.
Эта некомпенсированность межмолекулярных взаимодействий вызвана появлением границы раздела фаз, вблизи которой нарушается упорядоченность жидкой структуры вещества.
Поверхностное натяжение , как видно из его размерности, интенсивное свойство, которое может быть использовано для изучения макроскопических свойств вещества. Переход к определению микроскопических свойств можно осуществить следующим образом.
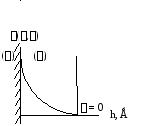
Рис. 2.3. Изменение межфазного поверхностного натяжения вблизи границы раздела фаз (h - толщина поверхностного слоя)
При низких температурах, далеких от критической температуры, пара можно пренебречь.
Тогда = с/ 4 . (2.2)
Помножим это выражение на М4, где М – молекулярная масса жидкости:
М4 = с/ 4 М4 (2.3)
и
М
4
ли= с/ М4 = сonst. (2.4)
где с/, М4 – постоянные.
С
М
ледовательно, и= Р = сonst. (2.5)
В
М
1/4
[P]ok = = 1/4 Vok (моль) . (2.6)
Выражение (2.6) передает физический смысл парахора: он представляет собой молярный объем жидкости при такой температуре, когда поверхностное натяжение равно 1.
Парахор (Р) в СИ имеет размерность Дж1/4м5/2/моль.
Поскольку объемы – величины аддитивные, возникает возможность суммирования величин парахоров отдельных фрагментов молекул.
Значение парахора не зависит от температуры и давления и определяется исключительно структурой молекул.
Парахор является приближенно аддитивным свойством, т. е.
[Р]оk = [P]e ae + [P]m bm, (2.7)
где ae – число атомов вида «e» в молекуле;
Ре – атомный парахор вида «е»;
bm – число структурных элементов вида «m» в молекуле;
Pm – составляющая (инкремент) парахора для структурных элементов
вида «m».
Исследования с помощью парахора проводят в такой последовательности:
измеряют поверхностное натяжение и плотность оk и рассчитывают опытное значение парахора;
задаются гипотезой о строении молекулы, находят значения (в справочниках) Ре и Pm для отдельных атомов и структурных элементов (циклов, двойных и обычных связей и т. д.). Вычисляют значение парахора как приближенное аддитивное свойство;
3) сравнивают опытное и расчетное значение парахора. Если они несовпадают, то исходная гипотеза неверна. Тогда задаются новой гипотезой и производят сопоставление опытных и расчетных значений до близкого совпадения.
Пример: бензол С6Н6
Е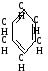 сли
формула верна, то парахор бензола состоит
из парахоров:
сли
формула верна, то парахор бензола состоит
из парахоров:
6С = 6 ·16·10-7 = 96 ·10-7 Дж1/4 м5/2 моль-1
6Н = 6 ·27,56 ·10-7 = 165,36 ·10-7 Дж1/4 м5/2 моль-1
3 двойных связи = 3 · 33,78 ·10-7 = 101,34 · 10-7 Дж1/4 м5/2 моль-1
6-членное кольцо Рe = 1,42 ·10-7 Дж1/4 м5/2 моль-1
В сумме: 364,12·10-7 Дж1/4 м5/2 моль-1
Для бензола опытное значение парахора [Р]о равно 360·10-7 Дж1/4 м5/2 моль-1, что можно считать хорошим совпадением с теоретическим.
Мольная рефракция. Это понятие связано с поляризуемостью молекул. При прохождении света через вещество возникает переменное электрическое поле высокой частоты (порядка 1015 Гц). Энергия такого поля невелика, поэтому поляризации подвергается лишь электроны, но не атомы (эл >> ат). Электронная поляризация, возникающая в этом случае за счет смещения электронов, называется молярной рефракцией R.

Молярная рефракция может быть определена на основании измерения показателя преломления видимого света (n) по уравнению Лорентца:
(n2
- 1) Mk
(n2
+ 2) ok
(n2
- 1)
(n2
+ 2)
RoK = = = Vok, мол , (2.8)
где RoK - молярная рефракция, м3/моль.
Закон преломления:
Sin 1
Sin 2

![]()
n21 = (2.9)
П
V1/
V2
n21 = , (2.10)
где V1 и V2 – скорости света в первой и второй средах.
Е
с
/ V2
n21 = , (2.11)
где с – скорость света в вакууме, n2 1.
Более удобно измерять показатель преломления по отношению к воздуху, тогда вводится переводной коэффициент 1,00029.
Свакуум = 1,00029Своздуха. (2.12)
Как было показано ранее, величина электронной поляризуемости имеет порядок 1Å3 = 10-30 м3 и характеризует объем электронного облака молекулы:
эл r3 . (2.13)
Тогда
RoK = Vмолекулы NА = 4/3 r3NА = 4/3 элNА . (2.14)
Из этого соотношения виден физический смысл молярной рефракции: она близка к собственному объему молекул одного моля вещества.
Поскольку объем обладает свойством аддитивности, следовательно:
RoK = Re ae + Rm bm , (2.15)
где Re – атомная рефракция;
Rm – составляющая рефракции структурных элементов;
a – число атомов;
bm – число структурных элементов.
RoK = Re ae + Rциклов bциклов + Rкр. связей bкр. связей . (2.16)
Мольная рефракция не зависит от температуры и агрегатного состояния вещества. Последовательность операций при исследовании строения молекул та же, что и в методе по парахору.
Пример: этилен
Неправильный расчет:
R (C2H4) (расчетное) = 2 RC + 4 RH < R (C2H4) (опытное) на величину двойной связи. Разница равна R (двойной связи).
R (C2H4) (расчетное) – R (C2H4) (опытное) = R двойной связи
Правильно:
R (C2H4) (расчетное) = 2 RC + 4 RH + R двойной связи
При работе с растворами удобно пользоваться понятием удельная рефракция rok.
Удельная рефракция – величина, отнесенная к 1 грамму вещества, а молярная – к 1 молю.
О
(n2
- 1)
(n2
+ 2) ok
(n2
- 1)
(n2
+ 2)
rok = = Vok уд. , (2.17)
где Vok уд. – удельный объем компонента k.
2.4. МЕТОДЫ IIГРУППЫ
2.4.1. МЕТОДЫ ОПРЕДЕЛЕНИЯ ДИПОЛЬНЫХ МОМЕНТОВ
О
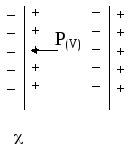
Рис.2.7
Поляризация диэлектрика во внешнем
электрическом поле
P(V)
– вектор
плотности поляризации (электрический
момент единицы объема диэлектрика)
В

 P(V)
=
o
E
, (2.18)
P(V)
=
o
E
, (2.18)
где Е – напряженность электрического поля, В/м. Заряд в 1 Кл создает в
вакууме на расстоянии 1 м напряженность 9·109 В/м);
0 – электрическая постоянная – она имеет размерность электрической
емкости, поделённой на длину [Ф/м];
– не зависящая от Е величина, называемая диэлектрической воспри-
имчивостью диэлектрика (безразмерная величина),
= ( – 1) / 4 . (2.19)
Уравнение (2.19) вытекает из теории Максвелла (где – диэлектрическая проницаемость, величина показывающая во сколько раз ослабляется поле в диэлектрике по сравнению с вакуумом).
![]() ,
(2.20)
,
(2.20)
где Eх – напряженность внешнего поля.
Явление поляризуемости наблюдается из-за индуцированности дипольных моментов и из-за ориентации диполей (дипольных моментов) (рис. 2.5).
P(V)
х
=
![]() +
+
![]() , (2.21)
, (2.21)
где ![]() эл. инд
х
= инд
0
Eх,лок
;
эл. инд
х
= инд
0
Eх,лок
;
![]() эл.
ор. х = ор.
0
Eх,лок
;
эл.
ор. х = ор.
0
Eх,лок
;
инд и ор – коэффициенты поляризуемости;
Ех,лок – напряженность локализованного электрического поля вследствие возникновения локализованных зарядов.
P(V)
х
=
![]() (v)
0
Eх,лок
(инд
+ ор)
. (2.22)
(v)
0
Eх,лок
(инд
+ ор)
. (2.22)


индуцирование диполей (инд.) ориентация жестких диполей (ор)
Рис. 2.5. Механизмы поляризации в постоянном электрическом поле
Для газов и неполярных жидкостей известно уравнение Лоренца:
Ех,лок = Ех + 4/3 P(V)х 1/0 . (2.23)
Это выражение для напряженности локализованного поля.
Подставим в это уравнение – PV(х) из уравнения (2.20):
Тогда
![]() .
(2.24)
.
(2.24)
Далее выражение (2.24) подставим в выражение (2.22)
PV(х)
=
![]() (v)
0
Eх/3
(
+ 2) (инд
+ ор)
. (2.25)
(v)
0
Eх/3
(
+ 2) (инд
+ ор)
. (2.25)
Совместное решение уравнений (2.20) и (2.25) дает:
![]() (v)
0
Eх/3
(
+ 2)
(инд
+ ор)
= (
– 1) 0
Eх
/ 4
,
(2.26)
(v)
0
Eх/3
(
+ 2)
(инд
+ ор)
= (
– 1) 0
Eх
/ 4
,
(2.26)
-
1
+
2
=
4/3
![]() (v)
(инд
+ ор).
(2.27)
(v)
(инд
+ ор).
(2.27)
О
Mk
ok
Умножим обе стороны уравнения (2.27) на (2.28)
-
1
+
2
Mk
ok
Mk
ok
= 4/3 N(v) (инд + ор) . (2.29)
M
ok
Напомним, что = V0k, моль.
Т
-
1
+ 2
M
kok
огда
V0k,
моль = 4/3
![]() (v)
(инд
+ ор)
,
(2.30)
(v)
(инд
+ ор)
,
(2.30)
M
ok
где N(v) = NA . (2.31)
В итоге получаем уравнение Клаузиуса – Мосотти:
![]() V0k,
моль = 4/3
NA
.
(2.32)
V0k,
моль = 4/3
NA
.
(2.32)
Введем понятие – мольная поляризация 0k , т. е. поляризация, отнесенная к 1 молю вещества (скалярное интенсивное свойство). Тогда:
-
1
+
2
-
1
+
2
0k = V0k, моль = (2.33)
0k = 4/3 NA . (2.34)
С помощью уравнений связи (2.32) - (2.34) можно, измерив диэлектрическую проницаемость вещества (диэлектрика) и, зная молекулярную массу и плотность, вычислить молярную поляризуемость 0k, а затем и поляризуемость .
О
-
1
+ 2
риентационная поляризация. Из уравнения Клаузиуса-Мосотти (2.32) следует, что:
= V0k,моль
![]() .
(2.35)
.
(2.35)
В уравнении (2.35) поляризуемость включает в себя как ориентационную, так и индукционную (деформационную) поляризации. В свою очередь индукционная поляризуемость может сопровождаться как смещением электронов, так и деформацией атомов в молекуле вещества. Таким образом, можно записать
= инд.ат + инд.эл + ор . (2.36)
Эти рассуждения распространяются и на молярную поляризуемость:
0k = 0k, инд. эл. + 0k, инд. ат. + 0k ор . (2.37)
Ориентационной поляризации подвержены полярные молекулы. В постоянном, т. е. статическом электрическом поле (создаваемом, например, с помощью конденсатора с плоскопараллельными пластинами), полярные молекулы ориентируются в соответствии с направлением поля. Ориентационная поляризация зависит от температуры: с повышением температуры усиливается тепловое хаотическое движение молекул, которое препятствует их ориентации, т. е. уменьшает ориентационную поляризацию. Величина ориентационной поляризации зависит и от дипольного момента молекулы: чем он больше, тем больше значение 0k ор.
Например у аммиака при Т = 292 К0 ор = 57,57·10-30 м3, а при Т = 466 К0 ор = 39,59·10-30 м3.
Если поляризация с температурой не изменяется, то это значит, что данное вещество состоит из неполярных молекул. В этом случае нет жестких диполей, т. е. индукционная поляризация от температуры не зависит.
З
2
3
kT
ор = , (2.38)
где – дипольный момент;
k – константа Больцмана.
В
2
3
kT
0k = 0k инд + 4/3 NА , (2.39)
4
NА
2
9
kT
0k = 0k инд + . (2.40)
Уравнение (2.40) – основа для определения дипольных моментов. Это уравнение строго справедливо для газо- и парообразного состояния веществ. Это и понятно, поскольку молекулы газа находятся друг от друга на больших расстояниях и почти не оказывают влияние друг на друга, особенно, если концентрация молекул газа невелика (при малых давлениях). В жидкостях диполи могут вращаться, но их вращение осложненяется за счет межмолекулярных диполь-дипольных и индукционных взаимодействий, поэтому уравнение (2.40) для жидкого состояния веществ не является строгим.
С
2
k
1
T
помощью зависимости молярной поляризации газов от температуры по уравнению (2.40) можно определять величину дипольных моментов молекул. Перепишем уравнение (2.40) в виде:о,газк = 4/3 NА инд + 4/9 Na . (2.41)
Легко видеть, что уравнение зависимости о,газк= f(1/Т) представляет собой уравнение прямой линии, если учесть, что инд не зависит от температуры.
Первое слагаемое обозначим через b, а коэффициент перед вторым через a, тогда
2
k
4/9 Na = a , (2.43)
1
T
о, газк = b + a . (2.44)
Опытным путем при различных температурах находят о,газк и строят графики.
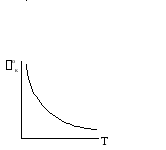

Рис. 2.6 Зависимости 0k от Т и от 1/Т
4
NА
2
9
k
По определению tg = a = . (2.45)
Из соотношения (2.45) следует, что
=
0,0127![]() ·10-18
эл.ст.ед.
· см,
·10-18
эл.ст.ед.
· см,
=
0,0127·![]() Д
(дебай) . (2.46)
Д
(дебай) . (2.46)
Последовательность расчета дипольных моментов :
1) измеряют диэлектрическую проницаемость и плотность о,газак при нескольких температурах Т и рассчитывают молярную поляризацию газа для каждой из температур;
2) строят график зависимости о,газак,ор = f(1/Т), рассчитывают коэффициенты a и b;
3) вычисляют дипольный момент, используя значения a.
Индукционная (деформационная) поляризация. Изменения в состоянии молекулы вызываются не только постоянными, но и переменными электрическими полями. При наложении таких полей удается избежать ориентационную поляризации, выделив индукционную.
инд = ат + эл , (2.47)
Здесь эл >> ат, поскольку легкие электроны смещаются легче, чем атомы.
При оптических частотах изменение электромагнитного поля происходит настолько быстро, что у молекулы, обладающей дипольным моментом, не хватает времени, чтобы изменить свою ориентацию в поле. Особый интерес представляет поведение молекул в поле высокой частоты, когда имеет место лишь один вид поляризации – электронная (эл).
Так как
ок ат << ок эл , (2.48)
ок ат 0,03 – 0,05 ок эл ,
ок эл = R . (2.49)
Уравнение (2.49) справедливо для поля высокой частоты. Физический смысл этого уравнения состоит в том, что такое поле возникает при прохождении через вещество видимого света. Как было показано ранее, электронная поляризация, наблюдаемая в этом случае, называется рефракцией. Отсюда – равенство молярной поляризации и молярной рефракции.
Следует упомянуть еще об одном соотношении – соотношении Максвелла для этих условий:
= n2 . (2.50)
И сходя
из соотношений (2.49) и (2.50), можно перейти
от уравнения Клаузиуса – Мосотти
сходя
из соотношений (2.49) и (2.50), можно перейти
от уравнения Клаузиуса – Мосотти
0k = ,
к уравнению Лорентца:
уравнению Лорентца:
R = .
И
2
kТ
ок = ок эл + 4/9 Na ,
2
kТ
ок = R + 4/9 Na ,
![]()
=√ 9kТ(ок – R)/(4 Na).
Подставив
все постоянные величины, получим
уравнения (2.51а) и (2.51б), где дипольный
момент в (2.51а) имеет размерность
эл.ст.ед.см,
а в (2.51б) выражен в дебаях:
= 0,0127 10-18
(ок
– R)Т
, (2.51а)
= 0,0127 (ок – R)Т . (2.51б)
Дипольные моменты можно определять также и по зависимости мольной поляризации раствора полярного вещества в неполярном растворителе от состава раствора.
Дипольный момент растворенного вещества в неполярном растворителе может быть определен с помощью диэлектрической постоянной и измерения плотности разбавленных растворов (рис. 2.10).
Пусть имеются образцы растворов. Условимся, что неполярный растворитель имеет индекс – 1, полярное вещество – 2, тогда
(12
– 1) (N1M1
+ N2M2)
(12
+ 2) 12
12 = , (2.52)
12 = (N2) (2.53)
где 12 – диэлектрическая постоянная раствора;
12 – плотность раствора;
N1 и N2 – мольные доли соответственно растворителя с молекулярной массой М1 и растворенного вещества с молекулярной массой М2.
Сняв экспериментальную зависимость, выраженную уравнением (2.53), можно построить график, как на рис 2.10.
1-2
Рис. 2.7 Зависимость мольной поляризации
раствора от мольной доли растворенного
вещества
1о
N2
1


















На рис. 2.10 изображена экспериментальная кривая (1), содержащая информацию о дипольном моменте растворенного вещества.
Найдем уравнение кривой и оценим вклады в значения со стороны растворителя и растворенного вещества.
12 = 1N1 + 2N2 (2.54)
где 1 и 2 – парциальные мольные поляризации компонентов раствора. 12 – эффективная поляризация.
При этом: 1 о1 , 2 о2, так как существуют межмолекулярные силы взаимодействия типа:1 – 2, 2 – 2, 1 – 1.
 1
= 1
(Т, Р,
N2)
(2.55)
1
= 1
(Т, Р,
N2)
(2.55)
2 = 2 (Т, Р, N2) (2.56)
12 = 1 (1 – N2) + 2N2 (2.57)
12 = 1 + (2 – 1) N2 (2.58)
Уравнение (2.58) – уравнение кривой 1.
Рассмотрим, как это уравнение будет действовать в области разбавленных растворов.
Если N2 0, то 1 о1, то это состояние отвечает бесконечно разбавленному раствору. Молекулы растворенного вещества предельно сольватированы и не взаимодействуют друг с другом (т. е. отсутствуют взаимодействия типа 2 – 2). Остаются два типа взаимодействия (1 – 2 и 1 – 1).
Кривая вырождается в прямую линию, а уравнение (2.58) описывает касательную, проведенную к опытной кривой в точке N2 = 0 (рис. 2.10).
Тогда уравнение (2.58) можно записать в виде:
разб = 1о + (2 - 1о)N2, (2.59)
разб = b + a N2. (2.60)
Уравнение (2.60) – прямой линии, где a – угловой коэффициент; a = tg .
tg = 2 - 1о, (2.61)
2 = 1о + tg , (2.62)
Из уравнения (2.62) можно найти мольную поляризацию растворенного вещества в бесконечно разбавленном растворе. Его состояние похоже на состояние газа, т.е. расстояния между молекулами растворенного вещества велики и практически отсутствуют взаимодействия между ними. Поэтому к 2, найденному из уравнения (2.62), применимо уравнение Дебая (уравнение ориентационной поляризации), а по этой величине можно рассчитать дипольный момент молекул.
Для расчета дипольных моментов применяют следующую последовательность:
приготавливают образцы растворов полярного вещества в неполярном растворителе;
измеряют диэлектрическую проницаемость и плотность растворов и рассчитывают их мольную поляризацию по уравнению (2.52);
находят зависимость 12 от N2 и строят ее графически;
графически экстраполируют зависимость (кривую) в точку N2 = 0 (1= 1о). С помощью уравнения (2.62) рассчитывают 2 для бесконечно разбавленного раствора полярного вещества в полярном растворителе.
Далее могут быть использованы два пути расчета .
Первый способ:
при нескольких температурах проводят измерения и рассчитывают поляризацию 2 при этих температурах;
строят графическую зависимость 2 от 1/Т (2 = b + a 1/T) и определяют угловой коэффициент наклона прямой по уравнению:
t
2
Na
2
k
рассчитывают дипольный момент (в дебаях) из уравнения:
=
0,0127
a
.
Второй способ:
определяют показатель преломления (n) и плотность образца () растворенного вещества в чистом виде и рассчитывают мольную рефракцию:
R
n2
- 1
n2
+ 2
M
o2
2 = .
рассчитывают дипольный момент вещества (в дебаях):
=
0,0127
(2о
– R2)
T.
Определение дипольного момента позволяет сделать заключения о характере химической связи (ионная, полярная, ковалентная) и о геометрической структуре молекулы.
При рассмотрении сложных молекул каждой связи целесообразно приписывать определенное значение i, учитывая при этом не только его величину но и знак (в зависимости от направления смещения электронов)., т. е. рассматривая дипольный момент, приходящийся на связь, как вектор.
Дипольный момент многоатомной молекулы можно считать равным векторной сумме дипольных моментов всех связей:
=
![]() .
(2.63)
.
(2.63)
Векторное сложение дипольных моментов связей показано на рисунке 2.11 (во всех случаях принято, что вектор направлен от + к –).
HCN SO2
–
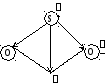


Рис. 2.11 Определение строения вещества с помощью векторого сложения
Для определения строения вещества вычисляют (по правилу сложения векторов) для различных моделей. Правильной оказывается та из них, для которой вычисленные значения наиболее близко к опытному.
Примеры
Из двух мыслимых вариантов (а) и (б) строения молекулы аммиака выбираем (б), поскольку измерения показывают, что молекула полярна (рис. 2.12):

(a)
= 0
(б)
= 1,48
Рис. 2.12 Модели строения молекулы аммиака
2) синтезировали хлорнитробензол (рис. 2.13). Дипольный момент составил 4,35D. Какой это хлорнитробензол (орто-, мета- или пара-)?
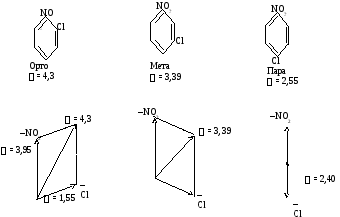
Вывод: синтезировано орто-соединение.
2.4.2. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ (СПЕКТРОХИМИЯ)
Спектром называется распределение энергии электромагнитного излучения по длинам волн или частотам.
Молекулярная спектроскопия изучает спектральный состав излучения, получающегося в результате поглощения, испускания или рассеяния света веществом. Слова «свет», «световой» и т. п. условно используется для обозначения электромагнитного излучения не только в видимой, но и в других областях спектра, применяемых в молекулярной спектроскопии.
Абсорбционная спектроскопия основана на способности вещества к избирательному поглощению. Чтобы определить, какие именно кванты поглощаются веществом и какова величина поглощения, через вещество пропускают электромагнитное излучение источника, имеющего непрерывный спектр испускания, а затем прошедший поток раскладывают в спектральном приборе по длинам волн и исследуют его спектральный состав. Подобным же образом изучают рассеянное веществом излучение.
Эмиссионная спектроскопия, нашедшая широкое применение в атомной спектроскопии, для изучения молекул используется реже. Для получения спектров испускания необходимо перевести достаточное число молекул в возбужденное состояние, сообщив веществу избыточную энергию извне. Нередко для этого применяют пламя горелки, дуговой или искровой разряд и т. д.
Термином спектроскопия обозначают обычно такой раздел современной науки, в котором спектральные измерения проводят с целью решения различных химических и физико-химических задач. Возможности спектрохимии чрезвычайно широки. Укажем лишь небольшую часть из огромного круга задач, решать которые позволяют методы спектрохимии.
1. Определение молекулярных постоянных, позволяющих описать систему энергетических состояний молекулы. Эти данные используют для расчета термодинамических функций веществ и констант равновесия химических реакций.
2. Определение строения молекулы или ее составных частей. Определение в молекуле функциональных групп. Установление геометрической конфигурации молекул, их симметрии. Определение внутримолекулярных расстояний и углов между связями. Количественная оценка упругих сил, действующих между атомами в молекуле, определение частот внутримолекулярных колебаний, энергии химической связи (диссоциации). Установление структуры координационных соединений – определение числа и способов связывания лигандов.
3. Исследование межмолекулярных взаимодействий. Изучение водородной и донорно-акцепторной связи, явлений гидратации и сольватации, взаимодействия между ионами в растворе.
4. Исследование химических равновесий и кинетики химических реакций.
5. Аналитическое приложение. Качественный и количественный анализ молекулярного состава природных и синтетических веществ, многокомпонентных смесей. Идентификация индивидуального соединения; определение его молекулярной массы; контроль степени очистки.
