
- •Предисловие
- •Раздел I. Строение вещества
- •Глава 1. Основные понятия и определения
- •Меры количества компонентов в системе
- •Классы химических частиц
- •Молекулы типа симметричного волчка. Примером такой молекулы может служить молекула аммиака (nh3).
- •Некоторые макроскопические свойства
- •Глава 2. Методы исследования строения вещества
- •Парахор. В 1926 г. Была установлена эмпирическая связь между плотностью вещества и его межфазным поверхностным натяжением :
- •Шкала электромагнитных колебаний. Виды излучений
- •Способы получения и способы изображения адсорбционных спектров. На рис.2.14 показана схема получения спектров.
- •Для получения спектральных характеристик в разных областях спектра используют различные узлы.
- •Видимая область
- •Вращательные спектры
- •Колебательные спектры
- •Раздел 2. Химическая термодинамика
- •Глава 3. Основные понятия и определения
- •Глава 4.Взаимодействие между системой и
- •4.3. Особенности энтропии как обобщенной координаты
- •Глава 5.Первый закон термодинамики
- •5.3. Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Глава 6. Второе начало термодинамики
- •6.1. Самопроизвольные и несамопроизвольные
- •Графическое выражение работы в равновесном и неравновесном процессах.
- •Глава 7. Теплоты химических процессов (термохимия)
- •7.2. Дифференциальная и интегральная теплоты химических процессов
- •IиIi – cостояния системы
- •IиIi –основное состояние системы;
- •Глава 8.Расчеты изменения энтропии системы
- •Глава 9. Третье начало термодинамики
- •Глава 10. Критерии направленности и сродства
- •Впервые Дж. Максвелл (1871) показал, что если внутренняя энергия системы выражается только функцией энтропии и объема, то через ее част-
- •Из уравнений (10.26) и (10.42) имеем
- •При этом
- •И для открытых систем в соответствии с (10.40), (10.46), (10.53) и (10.54):
- •Соответственно, если взять производную от отношения по температуре, то уравнение (8.70) предстает в виде:
- •При постоянных т и р уравнение (10.50) можно представить в виде
- •При сопоставлении (10.73) с (10.74) получаем
- •Глава 11. Равновесные состояния
- •Выход эфира, моль/л
- •11.6. Уравнение изотермы-изобары химической реакции
- •Для любой реакции
- •Примеры
- •Решение
- •Отсюда . (11.148)
- •Из (11.159) находим
- •Решение
Выход эфира, моль/л
|
|
Концен. |
Кислота |
Спирт |
Эфир |
Вода |
|
|
Исходн. Равнов. |
1 0,333 |
1 0,333 |
0 0,667 |
0 0,667 |
|
1. |
Исходн. Равнов. |
1 0,155 |
2 1,155 |
0 0,845 |
0 0,845 |
|
2. |
Исходн. Равнов. |
1 0,457 |
1 0,457 |
0 0,543 |
1 0,543 |
|
3. |
Исходн. Равнов. |
1 0,667 |
1 0.667 |
1 0,333 |
1 0,333 |
Выводы
Наибольший выход эфира получен в 1-м случае, т.е. с ростом концентрации реагирующих веществ (хотя бы одного из них) выход продуктов реакции увеличивается.
Наименьший выход эфира получен в 3-м случае, т.е. без отвода продуктов реакции (хотя бы одного из них) их выход снижается.
Задача 2. Вычислить Кр и Кс реакции N2O4 2NO2
при 500 К, Р = 5-104 Па и степени разложения, равной 75%.
Решение
Kp
=
![]() ,
где
,
где
![]() =
P
=
P![]() ,
а
,
а
![]() =P
=P![]()
Р - общее давление в системе, равное 5104 Па,
х
- мольная доля компонента, равная
отношению числа молей данного компонента
к сумме молей всех компонентов системы:
![]() .
.
N2O4 2NO2
= 0 1 моль 0
Число молей в
момент равновесия 1 - 2
сумма молей: 1 - + 2 = 1 +
Мольные доли участников реакции:
![]() ,
,
![]() ;
;
Kp
=
![]() =
=![]() ;
;
Kp
= 5104![]() ; Kc=
Kp(RT)-,
= 1;
; Kc=
Kp(RT)-,
= 1;
Kc=
![]() =
61,85моль/м3
=
61,85моль/м3
Ответ: Кр = 25, 7104 Па, Кс = 61,85 моль/м3.
Решим обратную задачу: найти степень разложения N2O4, если при той же температуре давление в системе повысить вдвое, т.е. Р=105 Па.
25,7104
= I05![]() ;
= 0,625
;
= 0,625
При повышении давления равновесие в данной реакции смещается влево, следовательно, степень разложения N2O4 должна уменьшиться, что и показал расчет.
11.6. Уравнение изотермы-изобары химической реакции
Предположим, что гомогенная газовая реакция (газы идеальные)
аА + вВ сС + dD
протекает самопроизвольно при постоянных р и Т. При этом изменяется текущее значение изобарно-изотермического потенциала:
Gp,T = (iG)прод. – (iG)исх.
или
Gp,T = (cGC + dGD) – (aGA + bGB) (11.86)
Для
1
моля
индивидуального идеального газа (11.53)
G=![]() .
В этом случае для самопроизвольной
реакции
.
В этом случае для самопроизвольной
реакции
Gp,T
=

или
Gp,T
=
 неравн
(11.87)
неравн
(11.87)
В состоянии равновесия Gp,T = 0, тогда
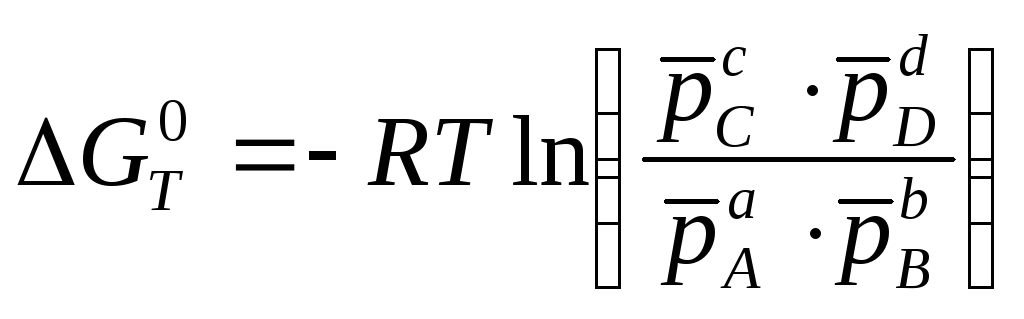 равн.
;
равн.
;
 равн.=
К0
(11.88)
равн.=
К0
(11.88)
Следовательно,
![]() .
(11.89)
.
(11.89)
Подставляя последнее выражение в (11.87), получим:
Gp,T
=
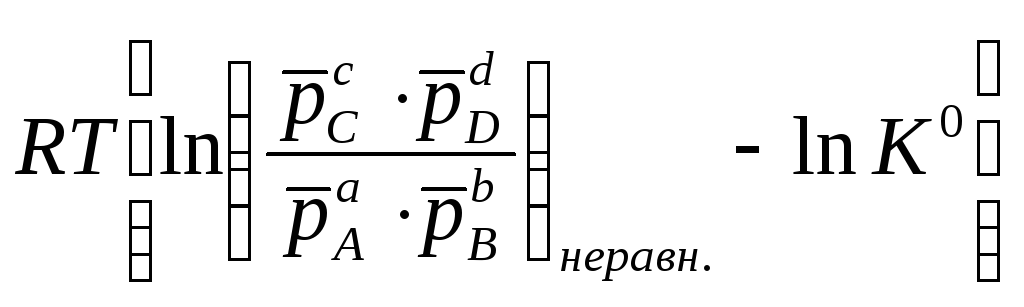 .
(11.90)
.
(11.90)
Это уравнение носит название изотермы-изобары химической реакции Вант-Гоффа (1886 г.)
Для любой реакции
Gp,T
=
![]() .
(11.91)
.
(11.91)
Если при термодинамических расчетах используется эмпирическая константа равновесия Кр, то из (11.88) и (11.70) следует, что
G0p,T
=
![]() ,
,
где р0 - стандартное давление.
При р0 = 1атм
G0p,T
=
![]() .
(11.91)
.
(11.91)
Имея
в виду, что
![]() ,
по аналогии с предыдущим можно показать,
что для изохорического процесса:
,
по аналогии с предыдущим можно показать,
что для изохорического процесса:
FV,T
=
 (11.92)
(11.92)
(уравнение изотермы-изохоры)
или F0 V,T = – RT lnKc . (11.93)
При использовании эмпирической константы равновесия Кс , если в качестве стандартной концентрации принимается С0= 1,
![]() = – RT lnKN
. (11.94)
= – RT lnKN
. (11.94)
Из
уравнения изотермы-изобары химической
реакции (11.87) следует, что если G0
> O, т.е.
К < 1, то это значит, что данная реакция
не идет самопроизвольно в стандартных
условиях. Зная порядок величины G0,
иногда
можно распространить вывод, строго
применимый только к стандартным
условиям, на любые условия. Так, если
G0
>> O,
можно сказать, что и G
> O, т.е.
реакция невозможна при любых разумных
составах смеси, изменяя которые можно
было бы сделать второй член правой части
уравнения (11.87)
отрицательным и большим по абсолютной
величине, чем
![]() .
.
Ясно, что если G0 при данной температуре имеет большое отрицательное значение, т.е. К0 очень велика, то реакция принципиально осуществима не только в стандартных, но и в любых условиях.
Особое внимание следует обратить на то обстоятельство, что концентрации и парциальные давления, входящие в соотношения для константы равновесия К0 (а, значит, и в стандартные значения G0), являются равновесными, в отличие от неравновесных текущих (в произвольный момент времени) в уравнении изотермы-изобары (11.90).
Так как за стандартное состояние принимается или чистое вещество, или идеальный раствор (гипотетическое состояние), то химические потенциалы компонентов численно равны их энергии Гиббса, а стандартное химическое сродство численно равно стандартной энергии Гиббса химического процесса, взятой с обратным знаком:
![]() .
(11.95)
.
(11.95)
Стандартное химическое сродство, так же, как и стандартная энергия Гиббса, является постоянной величиной при постоянных Т и Р.
Значения стандартного химического сродства А*,0(или -G0), вычисленные по значениям констант равновесия, очевидно, будут зависеть от выбора стандартных состояний и соответственно от выбранной шкалы (как и значения самих констант равновесия). Так, если состав системы характеризуется мольными долями, то стандартное химическое сродство А*,0(или -G0) определяется сродством относительно такого состояния, когда все компоненты реакции находятся в чистом виде, т.е. их мольные доли равны единице. Если константа равновесия выражена через парциальные давления компонентов, то, очевидно, стандартное химическое сродство А*,0(или -G0) равно сродству, отсчитанному относительно состояния, в котором все компоненты имеют парциальные давления, равные единице.
