
- •Коллектив авторов
- •Глава 1. Строение и функции
- •Глава 8. Химический пилинг. -
- •Глава 1
- •1.1. Эпидермис
- •1.3. Гиподерма
- •1.4. Иннервация кожи
- •1.7. Иммунная система кожи
- •Глава 2 старение кожи
- •2.1. Естественное старение кожи
- •2.2. Фотостарение кожи
- •2.3. Методы профилактики старения кожи
- •Глава 3
- •3.2. Основы для наружных средств
- •3.3. Лекарственные формы
- •3.4. Специфические наружные средства
- •Глава 4
- •4.1. Компоненты косметических средств для ухода за кожей
- •4.2. Косметические средства для личной гигиены
- •4.4. Кремы
- •4.5. Декоративная косметика
- •4.6. Камуфлирование дефектов на коже
- •Глава 5
- •5.8. Другие
- •Глава 6
- •Глава 7
- •8.2. Поверхностный химический пилинг
- •8.3. Средний химический пилинг
- •Глава 9
- •Глава 10
- •10.1. Краткий обзор
- •Глава 11 угри (acne)
- •11.3. Тактика лечения
- •11.6. Амбулаторное лечение
- •11.7. Косметические средства
- •Глава 12
- •12.1. Розовые угри (rosacea)
- •12.3. Периоральный дерматит
- •Глава 13 рубцы
- •13.2. Факторы, влияющие на формирование рубца
- •13.3. Клинические варианты рубцов
- •13.4. Лечение келоидных и гипертрофических рубцов
- •Глава 14
- •14.3. Клинические проявления и диагностика впч-инфекции
- •Глава 15 болезни ногтей
- •15.5. Лечение ониходистрофий
- •Глава 16 опухоли кожи
- •16.1. Классификации опухолей кожи
Глава 13 рубцы
С .Н.
Ахтямов, Е.Г. Красавцева
.Н.
Ахтямов, Е.Г. Красавцева
Рубцы на коже — продукт регенера- ции, появляющийся на месте повреж- дения слоев кожи: эпидермиса, дермы и/или гиподермы. Рубцы могут быть как результатом перенесенных заболе- ваний кожи (ветряная оспа, угри, пи- одермия, туберкулез кожи и другие дерматозы), так и следствием травм, ожогов, хирургических вмешательств. Рубцы могут быть и едва заметны- ми, и обширными, грубыми, способ- ными нарушать строение и функцию поврежденного участка кожи. Харак- тер рубцов зависит от множества при- чин, главными из которых являются глубина и площадь повреждения и полноценность репарационных меха- низмов, участвующих в процессах за- живления.
13.1. Механизмы заживления ран на коже
Заживление ран на коже обусловлено чрезвычайно сложными взаимодейст- виями тканевых, гуморальных и кле- точных факторов, приводящими к восстановлению барьерных функций кожи. Так как этот процесс имеет ключевое значение при множестве дерматокосметологических процедур,
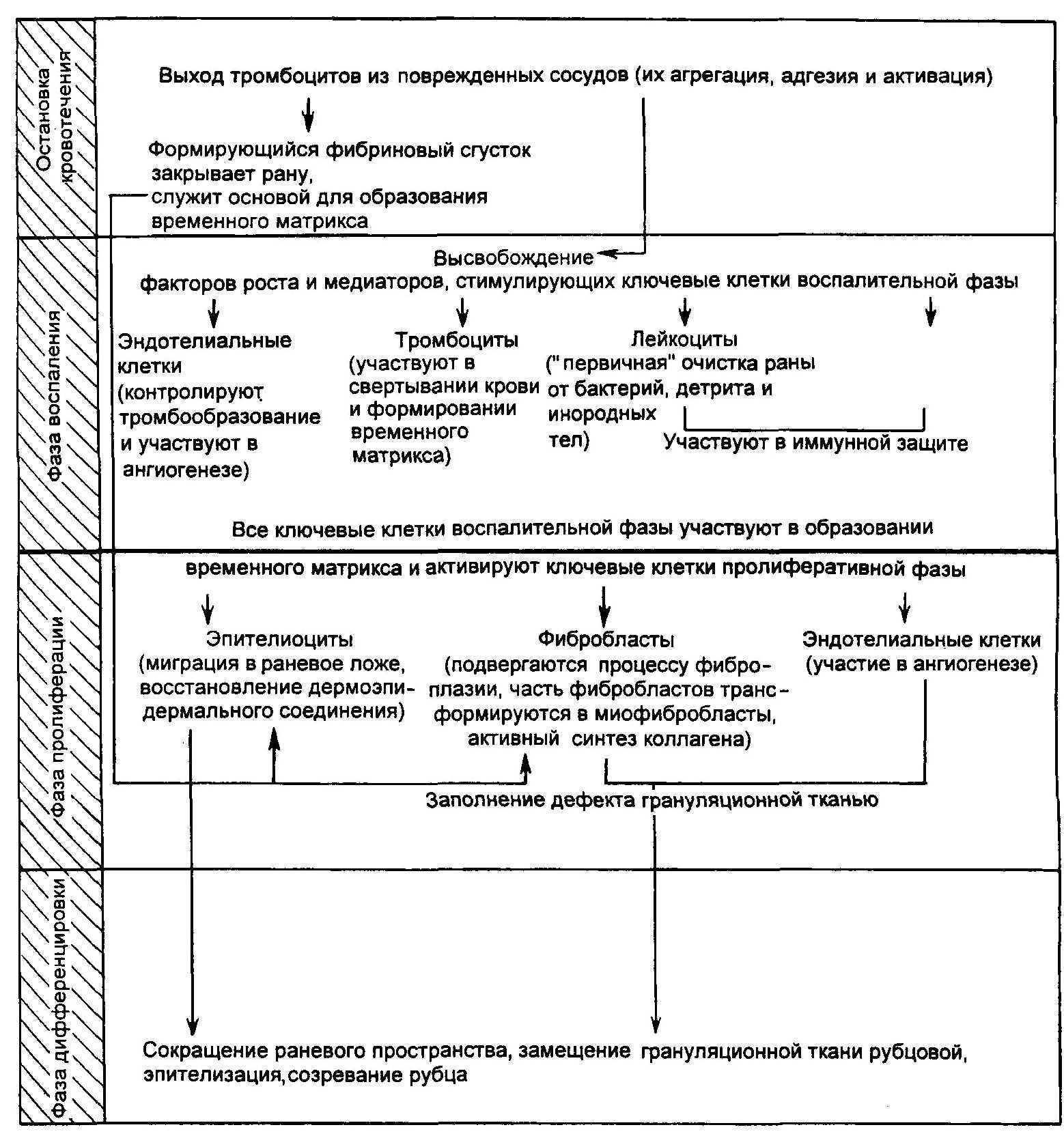
мы расскажем о нем подробно. В це-; лом процесс заживления можно раз- делить на три фазы (рис. 13.1):
воспалительную (экссудативную) фазу, включающую остановку кро- вотечения и очистку раны;
пролиферативную фазу, охватываю- щую развитие грануляционной ткани;
фазу дифференцировки (тканевого ремоделирования), включающую созревание, образование рубца и эпителизацию.
Эти фазы также называют фазами очистки, грануляции и эпителизации. Они не обязательно протекают после- довательно друг за другом, а часто вдут одновременно.
Воспалительная (экссудативная) фа- за продолжается примерно 3 дня и включает два последовательных этапа: сосудистых изменений и очищения ра- ны за счет подавления микрофлоры и отторжения нежизнеспособных тка- ней. Воспаление начинается непосред- ственно после травмы, когда из по- врежденных кровеносных сосудов вы- свобождается их содержимое, часть которого участвует в формировании тромбов, а другая (вазоактивные ве- щества) вызывает сужение сосудов.

Рис. 13.1. Фазы заживления раны.
1 — воспалительная фаза; 2 — пролиферативная фаза; 3 — фаза дифференцировки.
284
Основная задача первого этапа —
предотвращение большой потери кро- ви до того момента, когда агрегация тромбоцитов обеспечит перекрытие травмированных сосудов. Этот этап
продолжается около 10 мин.
На втором этапе происходят фор- мирование и укрепление тромбов в сосудах. Роль ключевого фактора в нем играют тромбоциты, которые по мере выхода из поврежденных сосудов активируются и начинают секретиро- вать большое количество медиаторов: фактор Виллебранда, аденозиндифос- фат, тромбоксан А2, 5-гидрокситрип- тофан, фибриноген, фибронектин и тромбоспондин. Последние три суб- станции участвуют в агрегации тром- боцитов. Фибриноген, превращающий тромбин в фибрин, к тому же укреп- ляет образовавшийся тромб в сосуде и участвует в формировании вокруг него временного матрикса [9, 10].
Свертывание крови в поврежденном сосуде проходит по двум главным тромбообразующим каскадам, в ре- зультате которых образуется тромбин. Последний отщепляет фибринопептид А и В от фибриногена, в результате чего последний полимеризируется в фибрин. Затем фактор XIII индуциру- ет перекрестные сшивки в молекуле фибрина и стабилизирует тромб [6, 9]. Образование тромбов происходит не во всех сосудах, а только в находя- щихся в ране. Этот процесс контро- лируют эндотелиальные клетки по- врежденных сосудов. Их фибриноли- тическая активность связана с синте- зом эндотелиоцитами простациклина, подавляющего агрегацию тромбоци- тов, антитромбина III, ингибирующего активность тромбина; С-протеина, разрушающего факторы коагуляции V и VIII; активатора плазминогена, ли- зирующего тромб за счет превращения плазминогена в плазмин.
Таким образом, поэтапно проте- кающее контролируемое свертывание крови приводит к образованию тром- ба, который останавливает кровотече- ние в ране и защищает ее от потери
жидкости и дальнейшего обсеменения патогенной флорой.
Кроме синтеза медиаторов, участву- ющих в свертывании крови, в течение первых минут агрегированные тром- боциты начинают выделять тромбоци- тарный фактор роста (ТцФР) — хемо- таксический агент для лейкоцитов. Этот цитокин привлекает лейкоциты к месту повреждения и поддерживает их функциональную активность. Од- новременно тромбоциты продуцируют и другие важные субстанции, участ- вующие не только в процессе воспа- ления, но и в реализации пролифера- тивной фазы: трансформирующий фактор роста р (ТФР-р), тромбоцитар- ный фактор-4, активирующие соеди- нительную ткань пептиды, р-тромбог- лобулин и нейтрофилактивирующие пептиды-2.
Через короткое время ранее сужен- ные артериолы начинают расширяться под влиянием вазоактивных веществ тучных клеток, таких как гистамин и брадикинин, и компонентов компле- мента. Эти субстанции усиливают проницаемость сосудов и облегчают проникновение нейтрофилов и моно- цитов в раневое пространство. Клини- чески процесс проявляется в покрас- нении и повышении температуры ко- жи вокруг раны.
Фагоцитоз и защита от инфекции. Лейкоциты, прежде всего нейтрофилы и моноциты, обнаруживают в ране примерно через 2—4 ч после травмы. Присутствующие в ране нейтрофилы обычно в течение нескольких дней подвергают рану первичной "чистке": фагоцитируют оставшиеся в ране кле- точный детрит, микроорганизмы и мелкие инородные вещества. В случае бактериального обсеменения миграция лейкоцитов продолжается и фагоцитоз усиливается, что, естественно, увели- чивает сроки заживления раны [15].
К раневой поверхности нейтрофилы и моноциты привлекаются с помощью как ТцФР, так и калликреина и фиб- ринопептидов — хемотаксических фак- торов, высвобождающихся из продук- тов распада фибриногена и фибрина.
285
Активность нейтрофилов усиливают интегрины — рецепторы на поверхнос- ти клеток, с помощью которых проис- ходит взаимодействие между клетками и внеклеточным матриксом. Интегри- ны позволяют нейтрофилам распозна- вать, фагоцитировать и уничтожать бактерии и детрит [3, 20].
По мере продолжения воспалитель- ного процесса нейтрофилы начинают замещаться моноцитами, которые под действием ТцФР трансформируются в тканевые макрофаги. В отличие от нейтрофилов моноциты и тканевые макрофаги являются ключевыми клет- ками, участвующими в завершении фагоцитоза и полного очищения раны от микроорганизмов и клеточного дет- рита. Кроме того, эти клетки синте- зируют цитокины, участвующие в про- лиферации фибробластов, формирова- нии грануляционной ткани и внекле- точного матрикса: фактор роста фиб- робластов, ТФР-а и р и фактор роста сосудистого эпителия [4, 5].
Пролиферативная фаза начинаетсяпримерно на 4-е сутки после травмы, но предпосылки для этого создаются уже во время воспалительной фазы. На этом этапе образующиеся грануля- ционная ткань и основное вещество (временный фибрин — фибронекти- новый матрикс) начинают заполнять раневое пространство.
Ключевыми клетками в этой фазе заживления становятся эпителиоциты, фибробласты и эндотелиальные клет- ки. Изменяясь фенотипически, они мигрируют в раневое пространство, где выделяют различные субстанции, участвующие в формировании времен- ного матрикса и в восстановлении по- врежденного эпидермиса и базальной мембраны.
При поверхностном повреждении кожи, ограниченном эпидермисом, ре- эпителизация начинается через не- сколько часов после травмы, а при более глубоком повреждении — через 1—2 сут.
Оставшиеся жизнеспособными ба- зальные клетки эпидермиса по краям раны и в фолликулах под влиянием
286
цитокинов: ТФР-р и эпидермального фактора роста и белков временного матрикса (фибронектин, а также кол- лагены типовIиIV) претерпевают рядморфологических изменений: стано- вятся уплощенными, подвергаются ретракции, что делает возможным движение вдоль коллагеновых волокон в раневое пространство клеток с вы- ступающими отростками — ламелли- подиями, направленными в раневое пространство [13].
Мощный ингибитор миграции эпи- телиоцитов, крупный гликопротеин ламинин — основной компонент lam- ina lucida дермоэпидермального соеди- нения (ДЭС; см. главу 1). В неповреж- денной коже ламинин помогает пред- отвратить прямой контакт между эпителиоцитами и коллагенами типов IV и VII, содержащимися в ДЭС и дерме (коллагены типов I, III и VI). В случае разрушения ДЭС и соответ- ственно ламинина базальные клетки вступают в прямой контакт с подле- жащим коллагеном и вследствие этого мигрируют. Как только эпителиоциты перемещаются в раневое пространство и выстилают его, ламинин вновь по- является в зоне ДЭС [19].
Параллельно с миграцией и проли- ферацией эпителиоциты участвуют в восстановлении поврежденного ДЭС. Этот процесс начинается сразу же, как только раневое ложе выстилается эпи- телиоцитами, где они продолжают про-лиферировать и синтезировать компо- ненты (коллагены типов IV и VII и ламинин), необходимые для полного восстановления ДЭС [4].
Таким образом, уже на 3-й сутки эпителий, перемещаясь по насыщен- ному фибрином матриксу, частично закрывает раневое пространство. На 7-е сутки эпителиальные клетки, дви- гаясь навстречу друг другу с противо- положных сторон раны, полностью за- крывают рану. Однако это возможно только в поверхностных ранах; при всех других ранениях кожи миграция эпителиоцитов из краевой зоны про- исходит только по мере заполнения тканевого дефекта грануляционной
тканью. Клетки эпителия не проявля- ют тенденции спускаться в углубление и могут двигаться только по ровной плоской поверхности. Миграция эпи- телиоцитов, расположенных в краевой зоне раны, идет неравномерно: за пер- воначальным нарастанием краевого эпителия следует утолщение исходно- го однослойного эпителия за счет на- слаивания клеток друг на друга. Таким образом, происходит формирование многослойного эпителия.
Процесс реэпителизации раневого пространства сопровождается фибро- плазией и ангиогенезом.
Фиброплазия — образование грану- ляционной ткани и временного мат- рикса. Грануляционную ткань можно рассматривать как временную прими- тивную ткань, которая "окончатель- но" закрывает рану и служит "ложем" для последующей эпителизации. Клю- чевые клетки, участвующие в образо- вании грануляционной ткани, — эндо- телиоциты и фибробласты. Один из стимулов их активации — низкий уро- вень кислорода в ране (гипоксия)— возникает практически сразу же после травмы вследствие повреждения кро- веносных сосудов [7].
Фибробласты, подобно эпителиоци- там, подвергаются фенотипическим изменениям, благодаря чему начинают мигрировать в рану, синтезируют большое количество коллагенов, про- теогликанов, эластина и других белко- вых соединений матрикса и, наконец, участвуют в сокращении раневого про- странства [10, 12]. Миграция фиброб- ластов в рану осуществляется с помо- щью временного матрикса, окружаю- щего тромб. Основной компонент раннего временного матрикса — фиб- ронектин, располагающийся вдоль фибробластов, поэтому вновь обра- зующиеся коллагеновые волокна име- ют такую же ориентацию. Установле- но, что фибронектиновый матрикс по- является примерно на 5-е сутки после травмы и наряду с фибробластами уча- ствует в сокращении раневого про- странства.
Другой компонент временного мат-
рикса — гиалуроновая кислота — спо- собствует подвижности клеток за счет ослабления их адгезии с матриксом, в то время как фибронектин и гепаран- сульфат, наоборот, усиливают присо- единение клеток к матриксу. Кроме того, движению клеток также благо- приятствует способность гиалуроно- вой кислоты насыщать водой матрикс, в результате чего он набухает и создает необходимое пространство для движе- ния клеток. На ранних этапах зажив- ления фибробласты продуцируют на- много больше гиалуроновой кислоты, чем в неповрежденной коже [4, 5].
Фибробласты не только участвуют в формировании временного матрик- са, но и восстанавливают постоянный внеклеточный матрикс. Под влиянием наиболее мощного стимулятора син- теза коллагена ТФР-(3 фибробласты активно синтезируют коллагены типов I и III, эластин, гликозаминогликаны и протеогликаны, причем на ранних стадиях заживления больше продуци- руется коллаген типа III [10].
По мере образования временного матрикса часть фибробластов под воз- действием ТФР-р подвергается даль- нейшим фенотипическим изменениям и трансформируется в богатые акти- ном миофибробласты. Эти клетки имеют свойства как фибробластов (на- пример, продуцируют большое коли- чество матричных белков), так и глад- комышечных клеток (из-за их способ- ности к сокращению) и располагаются в грануляционной ткани вдоль краев раны [14]. Под воздействием медиато- ров (ангиотензин, простагландины, брадикинины и эндотелины) миофиб- робласты начинают сокращаться, что приводит к сближению краев раны. Такая степень сближения также во многом зависит от глубины раны. С уче- том глубины раны разделяют на глу- бокие, поражающие все слои кожи, и поверхностные, с повреждением толь- ко верхних слоев. Глубокие раны за- живают, с одной стороны, благодаря сокращению раневого пространства, которое достигает около 40 % от ис- ходного размера раны, а с другой —
287
вследствие краевой эпителизации. В по- верхностных ранах в раневом ложе остаются неповрежденными придатки кожи с сохранившимися эпителиоци- тами, поэтому процесс сокращения раневого пространства менее выражен и эпителизация наблюдается как с краев раны, так и из придаточных структур в пределах раневого ложа.
Ангиогенез (неоваскуляризация) — процесс формирования множества ка- пилляров, питающих ключевые клетки регенерации, тесно связанный с фиб- роплазией и процессами, происходя- щими во внеклеточном матриксе. Ос- новные клетки ангиогенеза — эндоте- лиоциты, подобно эпителиоцитам и фибробластам, подвергаются специ- фическим изменениям, благодаря ко- торым они получают возможность мигрировать. Уже на 2-е сутки после травмы эндотелиальные клетки, рас- положенные по краям раны, начинают перемещаться в периваскулярное про- странство, а оставшиеся в сосудах клет- ки пролиферируют и участвуют в об- разовании новых сосудов [4].
Процесс ангиогенеза стимулируют различные факторы: гипоксия, цито- кины, ряд компонентов временного матрикса (кислотный протеин, обога- щенный цистеином, тенаскин, тром- боспондин, гепарин, фибронектин) [6, 8, 16].
Фаза дифференцировки (тканевого ре- моделирования) — третий, завершаю- щий этап заживления раны, включаю- щий формирование собственно рубцо- вой ткани, начинается с 6—10-х суток и может продолжаться несколько ме- сяцев. В течение этого времени гра- нуляционная ткань замещается рубцо- вой, благодаря чему в большой степе- ни восстанавливаются барьерные функ- ции кожи.
Превращение грануляционной тка- ни в соединительную осуществляется за счет уменьшения количества клеток и деградации временного внеклеточ- ного матрикса. Одновременно умень- шается количество капилляров, фиб- робластов и исчезают миофиброблас- ты. Такое резкое уменьшение коли-
чества клеток в трансформирующейся грануляционной ткани происходит по- средством апоптоза.
Временный фибронектиновый мат- рикс разрушается клетками и плазмен- ными протеазами [17]. Гиалуроновая кислота начинает замещаться сульфа- тированными протеогликанами: хонд- роитин-4-сульфатом и дерматансуль- фатом. Оба протеогликана существен- но усиливают упругие свойства руб- цовой ткани и одновременно подав- ляют движение клеток и их пролифе- рацию [5]. В течение небольшого про- межутка времени фибронектин заме- щается сначала коллагеном типа III, а затем, через год или позже, колла- геном типа I [10]. Последний увели- чивает упругость и прочность рубца. Несмотря на замещение нежной гра- нуляционной ткани более грубой, плот- ной рубцовой тканью, прочность зре- лого рубца составляет только 70—80 %от исходной прочности неповрежден- ной кожи, но на это могут потребо- ваться годы.
На процесс трансформации колла- гена влияют матриксразрушающие ме- таллопротеиназы (МРМ), которые в свою очередь находятся под контролем факторов роста, интерлейкина-1 (ИЛ- 1) и компонентов внеклеточного мат- рикса. Подавляются МРМ тканевы- ми ингибиторами металлопротеиназ (ТИМП). Существует три больших класса МРМ: коллагеназы, желатина- зы и стромелизины.
Коллагеназы включают интерстици- альную коллагеназу (фибробластную коллагеназу, МРМ-1), которая дейст- вует на коллагены типов I, II, III, VII и X.
Желатиназы разрушают денатури-рованный коллаген (желатин). Особо важна среди этого класса желатиназа А (МРМ-2), разрушающая желатин, коллаген типа IV и эластин.
Стромелизины имеют широкий спектр активности. Стромелизины 1 (МРМ-3) и 2 (МРМ-10) разрушают протеогли- каны, фибронектин, ламинин, жела- тины и коллагены типов III, IV и IX.
В ряде случаев формирование рубца
288
может быть либо замедленным, и тогда образуются хронические язвы, либо слишком быстро прогрессирую- щим, избыточным, с развитием гипер- трофических и келоидных рубцов. На появление таких аномальных рубцов влияют биохимическая, функциональ- ная и иммунная активность клеток, участвующих в заживлении, а также состояние внеклеточного матрикса. Например, гипертрофические рубцы характеризуются отсутствием доста-
точного созревания рубцовой ткани, т.е наличием остатков грануляций, большого количества клеток, в том числе миофибробластов, и обширной сети капилляров. Присутствие макро- фагов и фибробластов закономерно выявляет повышение уровня ТФР-р в 3 раза по сравнению с показателями в нормальном рубце. Поэтому гипер- трофические рубцы, отличающиеся по- вышенным фиброзом, подвержены ак- тивной ретракции.
19 — 7590. Ахтямов
289
В целом рубцовая ткань образуется в результате заживления раны первич- ным или вторичным натяжением. Ес- ли зона повреждения небольшая, со- прикосновение краев раны плотное, сохранена их жизнеспособность, от- сутствуют некроз и гематома, нет бак- териального обсеменения раны, то за- живление идет первичным натяжени- ем. За короткий промежуток времени края раны срастаются без видимой промежуточной ткани и образуется нежный рубец. При заживлении вто- ричным натяжением процесс рубцева- ния идет медленнее, через образова- ние грануляционной ткани, что при- водит к формированию грубого скле- розированного рубца [1, 2]. Обычно заживление вторичным натяжением характерно для обширных ран, при наличии в ране нежизнеспособных тканей и при инфицировании, препят- ствующих прямому соединению краев раны. Схематично процесс заживле- ния представлен на рис. 13.2.
В клинико-гистоморфологическом плане образование рубца происходит следующим путем. Вначале происхо- дит закрытие раны эпителием. При этом коллагеновые волокна дермы располагаются параллельно поверх- ности кожи. В течение 2—2,5 нед ру- бец грубеет. Нежно-розовый эпителий становится белесоватым, более плот- ным, приближающимся по цвету к окружающей коже. Затем происходит набухание рубцовой ткани; в межкле- точном веществе выявляют рыхло рас- положенные коллагеновые волокна, пронизанные сосудами, и неразвитый роговой слой эпидермиса. Визуально рубец приподнимается над уровнем кожи, краснеет, становится чувстви- тельным к прикосновению. Через 3— 4 нед эритема принимает цианотич- ный оттенок, болезненность уменьша- ется и рубец постепенно становится равномерно плотным, резко выступает над поверхностью кожи, местами по- крываясь плотными бляшками, что придает ему бугристый характер, обу- словливающий сходство с келоидным рубцом. С этого момента процесс руб-
290
цевания может развиваться либо по обычному варианту, когда происходит размягчение рубца, либо по пути трансформирования в келоидный или гипертрофический рубец. В послед- нем случае начинают доминировать и активироваться фибробласты. Кол- лагеновые волокна уплотняются, ста- новятся более компактными и обра- зуют спирали и узелки. Разрастаю- щиеся сосуды в ходе неоваскуляри- зации придают рубцу насыщенный красный цвет [2|. Таким образом, в течение нескольких недель или меся- цев над зарубцевавшимся участком формируется аномальное красное вы- пуклое твердое опухолевидное образо- вание.
Пока невозможно абсолютно точно определить, насколько то или иное повреждение кожи отразится на харак- тере рубца. Тем не менее существует ряд предрасполагающих факторов, по- зволяющих в определенной мере про- гнозировать этот процесс.
