
- •Патологическая физиология
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 695
- •Глава 12. Патологическая физиология 1237
- •.Краткие сведения об истории патологической физиологии
- •Экспериментально-физиологическое, физико-химическое направление
- •.Часть первая общая нозология
- •Глава 1. Общее учение о болезни
- •1.1. Здоровье и болезнь
- •1.1.1. Норма и здоровье
- •1.1.2. Определение сущности болезни
- •1.1.3. Патологическая реакция, патологический процесс, патологическое состояние
- •1.2. Общие вопросы учения об этиологии болезней
- •1.3. Общие вопросы учения о патогенезе болезней
- •1.4. Исходы болезни
- •На повреждение
- •2.1. Общая патология клетки
- •2.1.1. Повреждение клеток в патологии
- •2.1.2. Нарушение функций клеточных структур
- •Кусочки ткани Выделенные митохондрии
- •Время переживания органа при 24°с (мин)
- •2.1.3. Механизмы нарушения барьерной функции биологических мембран
- •СюТоксическое действие
- •Токсическое действие
- •2.1.4. Другие причины нарушения барьерных свойств липидного слоя мембран
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 705
- •Глава 12. Патологическая физиология 1247
- •2.1.5. Нарушение электрической стабильности липидного слоя
- •2.2. Общие реакции организма на повреждение
- •2.2.1. Общий адаптационный синдром (стресс)
- •2.2.2. Активация протеолитических систем плазмы крови
- •I Фактор Хагемана Калликреин j I Прекалликреин
- •2.2.4. Кома
- •2.2.5. Ответ острой фазы
- •2.2.5.2. Главные медиаторы ответа острой фазы
- •3.1. Реактивность организма
- •3.2. Виды реактивности
- •3.5. Резистентность
- •3.6. Факторы, влияющие на реактивность
- •3.7. Роль наследственности
- •Гидрооксифенил виноградная кислота
- •Фенилпиро- виноградная кислота
- •Гомоге нти зи н о вая кислота
- •Гомогентизиноксидаза (алкаптонурия)
- •4.1. Основные представления о строении
- •4.2. Общая стратегия иммунной защиты
- •4.3. Иммунодефицитные состояния
- •4.3.1. Первичные иммунодефициты
- •4.3.2. Вторичные иммунодефициты
- •4.4. Аутоиммунные процессы
- •4.5. Лимфопролиферативные процессы
- •5.1. Взаимоотношение аллергии и иммунитета
- •5.3. Специфические аллергические реакции
- •5.3.1. Аллергические реакции I типа (анафилактические)
- •5.3.2. Аллергические реакции II типа
- •5.3.3. Аллергические реакции III типа
- •5.3.4. Аллергические реакции IV типа
- •Характеристика повышенной чувствительности немедленного и замедленного типов
- •5.4. Атопия. Атонические и псевдоатопические заболевания
- •5.4.1. Механизмы развития
- •5.4.2. Механизмы обратимой обструкции дыхательных путей
- •5.5. Псевдоаллергия
- •5.5.1. Гистаминовый тип псевдоаллергии
- •5.5.2. Нарушение активации системы комплемента
- •5.5.3. Нарушения метаболизма арахидоновой кислоты
- •Глава 6. Патологическая физиология периферического (органного) кровообращения и микроциркуляции
- •Состояние кровотока в микрососудах при артериальной гиперемии, ишемии, капиллярном стазе и венозном застое крови,
- •Признаки расстройства периферического кровообращения (в.В. Воронин, модификация г.И. Мчедлишвили)
- •6.1. Артериальная гиперемия
- •6.3. Нарушение реологических свойств крови, вызывающее стаз в микрососудах
- •6.4. Венозный застой крови
- •Превалирование резорбция вал фильтрацией я оды а микрооо- суддк мозга
- •6.6. Кровоизлияние в мозг
- •7.1. Нарушение микроциркуляции
- •7.2. Воспалительные экссудаты
- •7.3. Эмиграция лейкоцитов периферической крови
- •7.4. Фагоцитоз
- •7.5. Специализированные функции нейтрофилов, моноцитов
- •7.6. Медиаторы воспаления
- •7.7. Исходы воспаления
- •8.1. Этиология
- •8.3. Функция органов и систем
- •9.1. Нарушение обмена белков
- •9.1.1. Нарушение расщепления и всасывания белков
- •9.1.4. Патология межуточного обмена белков (нарушение обмена аминокислот)
- •9.1.5. Изменение скорости распада белка
- •9.1.6. Патология конечного этапа обмена белков
- •9.2. Нарушение обмена липидов
- •9.2.1. Нарушение транспорта липидов и перехода их в ткани
- •9.2.2. Роль нарушений липидного обмена в патогенезе атеросклероза
- •9.2.3. Жировая инфильтрация и жировая дистрофия
- •9.3. Нарушение обмена углеводов
- •9.3.3. Нарушение регуляции углеводного обмена
- •9.4. Нарушение водного баланса
- •9.4.1. Основы регуляции водного баланса
- •9.4.2. Формы нарушения водного баланса
- •9.4.2.1. Увеличение объема внеклеточной жидкости (гиперволемия)
- •9.4.2.2. Уменьшение объема внеклеточной жидкости (гиповолемия)
- •9.5. Нарушение электролитного баланса
- •Организма человека
- •9.5.1. Нарушение баланса натрия
- •9.5.2. Нарушение баланса калия
- •9.5.3. Нарушение баланса кальция
- •9.5.4. Нарушение баланса фосфатов
- •9.5.5. Нарушение баланса магния
- •9.6. Нарушение кислотно-основного баланса
- •9.6.1. Основы регуляции кислотно-основного баланса
- •0A* й к * 5 сз" 5 неш Лшкжы Анионы КаикшыКат ионы
- •9.6.2. Основные показатели коб
- •9.6.3. Формы нарушения кислотно-основного баланса
- •9.6.3.1. Респираторный ацидоз
- •9.6.3.2. Метаболический ацидоз
- •9.6.3.3. Респираторный алкалоз
- •9.6.3.4. Метаболический алкалоз
- •9.6.3.5. Смешанные нарушения кислотно-основного баланса
- •10.2. Компенсаторно-приспособительные реакции при гипоксии
- •10.3. Нарушение обмена веществ
- •10.4. Коррекция гипоксии: необходим избыток или недостаток кислорода?
- •11.1. Механизмы клеточного деления
- •11 »2. Патофизиология клеточного деления
- •11.2.1. Активация онкогенов
- •11.2.2. Инактивация генов-супрессоров
- •11.2.3. Нарушение апоптоза
- •11.2.4. Нарушение механизмов репарации днк
- •11.3. Опухолевый рост
- •11.3.2. Этиология опухолей
- •11.3.3. Свойства опухолевых клеток in vitro
- •11.3.4. Межклеточная кооперация
- •11.3.5. Свойства злокачественных опухолей
- •11.3.6. Взаимоотношения опухоли и организма
- •11.3.7. Механизмы резистентности опухолей к терапевтическим воздействиям
- •.Часть третья нарушение функций органов и систем
- •Глава 12. Патологическая физиология нервной системы
- •12.1. Общие реакции нервной системы на повреждение
- •12.2. Нарушение функции нервной системы,
- •12.3. Метаболические энцефалопатии
- •12.4. Повреждение мозга,
- •12.5. Расстройства функций нервной системы, обусловленные повреждением миелина
- •12.6. Нарушение нервных механизмов управления движениями
- •12.6.1. Расстройства движений,
- •12.6.1.1. Болезни моторных единиц
- •12.6.1.2. Расстройства движений
- •12.6.1.3. Нарушение движений при повреждении мозжечка
- •12.6.1.4. Нарушение движений
- •13.1. Нарушение механизмов регуляции артериального давления
- •13.2. Расстройства функций мочевого пузыря
- •13.5. Вегетативные расстройства,
- •15.1. Нарушение центральных механизмов регуляции
- •15.2. Патологические процессы в железах
- •15.3. Периферические (внежелезистые) механизмы нарушения активности гормонов
- •15.4. Роль аутоаллергических (аутоиммунных) механизмов в развитии эндокринных нарушений
- •1]ДиОТипиЧесИиЕ ahtuteaa
- •16.1. Нарушение функций гипофиза
- •16.1.1. Недостаточность функции гипофиза
- •16.1.2. Гиперфункция передней доли гипофиза
- •16.2. Нарушение функций надпочечников
- •16.2.1. Кортикостероидная недостаточность
- •16.2.2. Гиперкортикостероидизм
- •16.2.3. Гиперфункция мозгового слоя надпочечников
- •16.3. Нарушение функций щитовидной железы
- •16.3.1. Гипертиреоз
- •16.3.2. Гипотиреоз
- •16.4. Нарушение функций околощитовидных желез
- •16.5. Нарушение функций половых желез
- •17.1. Краткие сведения
- •17.2. Атеросклероз
- •17.2.1. Теории происхождения
- •17.2.2. Регресс атеросклероза
- •17.3. Нарушение коронарного кровотока
- •17.3.1. Ишемия миокарда
- •17.3.2. Оглушенный и бездействующий миокард
- •17.4.Артериальная гипертензия
- •Гипертоническая болезнь!
- •17.4.1. Патогенез гипертонической болезни
- •17.4.2. Вторичная артериальная гипертензия
- •17.6. Механизмы развития сердечной недостаточности
- •17.6.2. Диастолическая форма сердечной недостаточности
- •17.7. Механизмы развития аритмий
- •17.7.1. Нарушение образования импульсов
- •17,7,2, Риэнтри
- •17.7.3. Нарушение проводимости
- •Внешнего дыхания
- •18.1. Определение понятия «дыхательная недостаточность»
- •18.2. Оценка функций внешнего дыхания придыхательной недостаточности
- •18.3. Патофизиологические варианты дыхательной недостаточности
- •18.3.1. Центрогенная дыхательная недостаточность
- •18.3.2. Нервно-мышечная дыхательная недостаточность
- •18.3.3. «Каркасная» дыхательная недостаточность
- •18.3.4. Механизмы дыхательной недостаточности при патологии дыхательных путей
- •18.3.5. Паренхиматозная дыхательная недостаточность
- •18.4. Показатели газового состава крови при дыхательной недостаточности
- •18.4.1. Гипоксемическая (I типа) дыхательная недостаточность
- •18.4.2. Гиперкапнически-гипоксемический (вентиляционный) тип дыхательной недостаточности
- •19.1. Основы регуляции клеточного цикла
- •19.2. Патология красной крови
- •19.2.1. Анемии
- •19.2.2. Эритроцитозы
- •19.4. Патология белой крови
- •19.4.1. Лейкоцитопении
- •19.4.2. Лейкоцитоз
- •19.5. Лейкозы (гемобластозы, лейкемии)
- •20.1. Факторы, свертывающие кровь
- •VIll/vWf I
- •20.2. Геморрагические синдромы
- •20.4. Синдром диссеминированного
- •20.5. Методы оценки нарушений системы гемокоагуляции
- •21.1. Нарушение лимфообразования
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 705
- •Глава 12. Патологическая физиология 1247
- •21.2. Недостаточность транспорта лимфы
- •21.3. Нарушение свертывания лимфы
- •21.4. Роль лимфатической системы в развитии отека
- •21.5. Функции лимфатической системы при развитии воспаления
- •22.1. Нарушение функций пищевода
- •22.2. Нарушение функций желудка
- •22.2.1. Нарушения секреции соляной кислоты и пепсина
- •22.2.2. Нарушение слизеобразующей функции желудка
- •22.2.3. Патофизиологические механизмы язвенной болезни
- •22.2.4. Нарушение двигательной функции желудка
- •22.3. Патофизиологические механизмы болей в животе
- •22.4. Нарушение экзокринной функции поджелудочной железы
- •22.4.1. Патофизиологические механизмы развития острого панкреатита
- •22.4.2. Патофизиологические механизмы развития хронического панкреатита
- •22.5. Нарушение функций кишечника
- •22.5.1. Нарушение переваривания и всасывания в кишечнике
- •22.5.2. Нарушения двигательной функции кишечника
- •23.1. Печеночно-клеточная недостаточность
- •23.2. Патофизиологические механизмы синдрома портальной гипертензии
- •23.3. Патофизиологические механизмы желтухи
- •24.1. Нарушение клубочковой фильтрации
- •24.2. Нарушение функций канальцев
- •24.3. Изменение состава мочи
- •24.4. Нефротический синдром
- •24.5. Острая почечная недостаточность
- •24.6. Хроническая почечная недостаточность
- •24.7. Мочекаменная болезнь
СюТоксическое действие
Расслабление стенок кровеносных сосудов
Антимикробное действие
Детоксикация Н20
28
LOOH
НООН
нею
L0
НО-
НО
Fe2+-
JW
10
^Токсическое действие
Рис. 2.6. Метаболизм супероксидного радикала.
Объяснения в тексте.
лентности супероксидные радикалы превращаются в перекись водорода; эта реакция катализируется ферментом супероксиддисмутазой (реакция 2):
2-02" Н202 + 02
Клетки-фагоциты используют перекись водорода, превращая ее в гипохлорит — соединение, разрушающее стенки бактериальных клеток; эта реакция катализируется ферментом миелопероксидазой (реакция 3):
Н202 + С|--»Н20 + СЮ-.
Избыток перекиси водорода удаляется под действием двух ферментов: глутатион-пероксидазы или каталазы (4 на рис. 2.6):
Н202 + 2GSH (глутатион) -> Глутатионпероксидаза 2Н20 + GSSG;
2Н202 Каталаза 2Н20 + 02.
Радикал гидроксила. В условиях патологии могут произойти нарушения либо системы защитных ферментов (в частности, снижение активности СОД), либо ферментных систем, связывающих ионы железа в плазме крови (церулоплазмин и трансферрин) и в клетках (ферритин). В этом случае супероксидные радикалы и перекись водорода вступают в альтернативные реакции:
образование двухвалентного железа из трехвалентного (рис. 2.6, 7):
Fe3+ + ю2- Fe2+ + 02;
реакция перекиси водорода и гипохлорита с ионами двухвалентного железа (рис. 2.6, 9 и 10):
Fe2+ + Н202 Fe3+ + НО" + НО* (реакция Фентон); Fe2+ + СЮ" + Н+ Fe3+ + CI" + НО- (реакция Осипова)
.
Совокупность продуктов, образуемых активированными клетками- фагоцитами (радикалы супероксида и гидроксила, перекись водорода и гипохлорит), называют активными формами кислорода; некоторые авторы называют гипохлорит и продукты его метаболизма в тканях (такие, как хлорамины R-NHCI), активными формами хлора.
Радикалы гидроксила химически исключительно активны и вызывают повреждение белков, нуклеиновых кислот и липидов биологических мембран. Особенно тяжелые последствия имеют две последние реакции. Радикалы ЮН вызывают разрыв нитей ДНК, оказывают в зависимости от ситуации, мутагенное, канцерогенное или цитостатическое действие. Вместе с тем, реагируя с ненасыщенными жирными кислотами, входящими в состав мембранных липидов, радикалы гидроксила инициируют цепную реакцию их пероксидации (перекисного окисления).
Цепное
окисление липидов.
Реакция цепного окисления липидов
играет исключительную роль в клеточной
патологии. Она протекает в несколько
стадий, которые получили название
инициирование, продолжение,
разветвление и обрыв цепи (рис. 2.7).
Рассмотрим эти стадии под
lh
^ loo
HOH
робнее.
QO
Jl
оо
ж
QO
lh
lh
но-
->•
loo*
?
ноон
ноон
Звено
цепи
и
Первичная цепная реакция
lh
I
00
l*
оо
—i-
OO
,-i-
lh
I
ноон
lx>
loo
*
Fev
re*"1
tmct,+ f гс
*Л
Г Li
I
'
с П
«
*
I
00
^
T ^
i
lh -
ar ▼
»
iL'
§
ОО ~»4
X j
loo
*
loh
loh
loo*
Рис. 2.7. Реакция цепного окисления липидов.
А — реакция с неразветвленной цепью, Б — разветвленная цепная реакция
Инициирование цепи. Радикал гидроксила — небольшая по размеру незаряженная частица — способен проникать в толщу гидрофобного липидного слоя и вступать в химическое взаимодействие с полиненасыщенными жирными кислотами (которые принято обозначать как LH), входящими в состав биологических мембран и липопротеинов плазмы крови. При этом в липидном слое мембран образуются липидные радикалы:
НО- + LH -> Н20 + L
-
f
Липидный радикал (L-) вступает в реакцию с растворенным в среде молекулярным кислородом; при этом образуется новый свободный радикал — радикал липоперекиси (LOO):
L- + LH -> LOO .
Продолжение цепи. Этот радикал атакует одну из соседних молекул фосфолипида с образованием гидроперекиси липида LOOH и нового радикала L-*
LOO + LH LOOH + L-.
Чередование двух последних реакций представляет собой цепную реакцию перекисного окисления липидов (см. рис. 2.7, А).
Разветвление цепи. Существенное ускорение пероксидации липидов наблюдается в присутствии небольших количеств ионов двухвалентного железа. В этом случае происходит разветвление цепей в результате взаимодействия Fe2+ с гидроперекисями липидов:
Fe2+ + LOOH -> Fe3+ + НО- + LO-.
Образующиеся радикалы LO- инициируют новые цепи окисления липидов (рис. 2.7, Б):
LO + LH -> LOH + L-; L- + 02 -> LOO- -> и т.д.
Обрыв цепей. В биологических мембранах цепи могут состоять из десятка и более звеньев. Но в конце концов цепь обрывается в результате взаимодействия свободных радикалов с антиоксидантами (InH), ионами металлов переменной валентности (например, теми же Fe2+) или друг с другом:
LOO- + Fe2+ + Н+ -> LOOH;
LOO- + InH -> In-;
LOO- + LOO- -> молекулярные продукты.
Использование хемилюминесценции для изучения реакций, идущих с участием свободных радикалов. Последняя реакция интересна еще и тем, что она сопровождается свечением — хемилюминесценци- ей. Интенсивность хемилюминесценции очень мала, поэтому ее иногда называют «сверхслабым свечением». Интенсивность свечения пропорциональна квадрату концентрации свободных радикалов в мембранах, а скорость перекисного окисления прямо пропорциональна концентрации тех же радикалов. Поэтому интенсивность «сверхслабого» свечения однозначно отражает скорость липидной пероксидации в изучаемом биологическом материале, и измерение хемилюминесценции довольно часто используется при изучении перекисного окисления липидов в различных объектах.Измерение хемилюминесценции широко применяется также для изучения образования активных форм кислорода клетками крови и пери- тонеальными макрофагами. В присутствии специальных соединений — люминола и люцигенина — наблюдается хемилюминесценция изолированных лейкоцитов крови, макрофагов или разведенной цельной крови, если клетки-фагоциты продуцируют гипохлорит, и радикалы кислорода (супероксид + гидроксил-радикал). Интенсивность хемилюминесцентных ответов клеток увеличивается в несколько раз при появлении очагов некроза в организме, например после инфаркта миокарда, и, напротив, угнетается при тканевой гипоксии; поэтому измерение клеточной хемилюминесценции может быть использовано в ряде случаев с целью выявления заболевания, оценки тяжести состояния больного и эффективности назначенного лечения.
Биологические последствия пероксидации липидов. Увеличенное образование свободных радикалов в организме и связанное с этим усиление процессов пероксидации липидов (которое иногда называют оксидативным стрессом) сопровождается рядом нарушений в свойствах биологических мембран и функционировании клеток. Наиболее изучены три прямых следствия перекисного окисления липидов.
Во-первых, перекисное окисление липидов сопровождается окислением тиоловых(сульфгидрильных) групп мембранных белков (Рг). Это может происходить в результате неферментативной реакции SH-групп со свободными радикалами липидов; при этом образуются сульфгидриль- ные радикалы, которые затем взаимодействуют с образованием дисульфидов либо окисляются кислородом с образованием производных суль- фоновой кислоты:
Pr-SH + L- LH + Pr-S-;
PiyS- + Pr2-S- PiySS-Piv, Pr-S- + 02 -> Pr-S02* -> молекулярные производные.
Связанные с перекисным окислением липидов окисление белков и образование белковых агрегатов в хрусталике глаза заканчиваются его помутнением; этот процесс имеет большое занчение в развитии старческой и других видов катаракты у человека. Важную роль в патологии клетки играет также инактивация ион-транспортных ферментов, в активный центр которых входят тиоловые группы, в первую очередь Са2+—АТФазы. Инактивация этого фермента вызывает замедление «откачивания» ионов кальция из клетки и, наоборот, вход кальция в клетку (рис. 2.8, 7), увеличение внутриклеточной концентрации ионов кальция и повреждение клетки.
2(V (.V
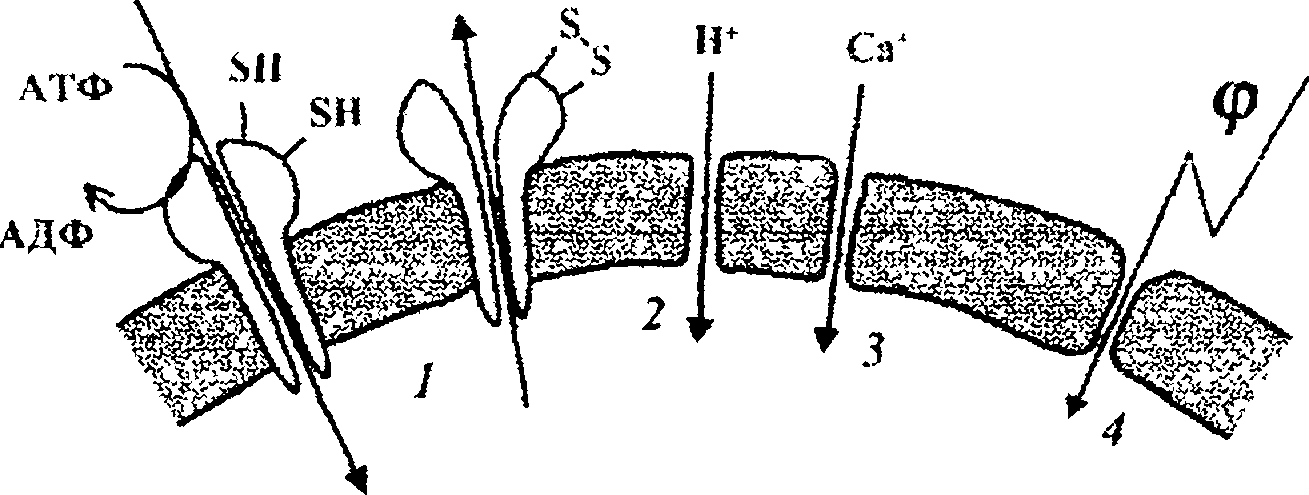
Рис. 2.8. Нарушение барьерных свойств мембран при перекисном окислении липидов.
Наконец, окисление тиоловых групп мембранных белков приводит к появлению дефектов в липидном слое мембран клеток и митохондрий. Под действием разности электрических потенциалов на мембранах через такие дефекты в клетки входят ионы натрия, а в митохондрий — ионы калия. В результате увеличивается осмотическое давление внутри клеток и митохондрий, что способствует еще большему повреждению мембран.
Во-вторых, результат перекисного окисления липидов связан с тем, что продукты пероксидации обладают способностью непосредственно увеличивать ионную проницаемость липидного бислоя. Показано, что продукты перекисного окисления липидов делают липидную фазу мембран проницаемой для ионов водорода (рис. 2.8, 2) и кальция (рис. 2.8, 3). Это приводит к тому, что в митохондриях окисление и фосфорилирование разобщаются, а клетка оказывается в условиях энергетического голода (т.е. недостатка АТФ). Одновременно в цитоплазму выходят ионы кальция, которые повреждают клеточные структуры.
Третьий (и быть может, самый важный) результат пероксидации — это уменьшение стабильности липидного слоя, что может вызвать электрический пробой мембраны собственным мембранным потенциалом, т.е. под действием разности электрических потенциалов, существующей на мембранах живой клетки. Электрический пробой приводит к полной потере мембраной ее барьерных функций (рис. 2.8, 4).
Клеточные системы антирадикальной защиты. В нормальных условиях процесс перекисного окисления липидов находится под строгим контролем ферментативных и неферментативных систем клетки, отчего скорость его невелика. Принято делить химические соединения и физические воздействия, влияющие на скорость перекисного окисления липидов, на прооксиданты (усиливают процессы перекисного окисления) и антиоксиданты (тормозят перекисное окисление липидов). К проокси- дантам в живой клетке относятся высокие концентрации кислорода (например, при длительной гипербарической оксигенации больного), ферментные системы, генерирующие супероксидные радикалы (например, ксантиноксидаза, ферменты плазматической мембраны фагоцитов и др.), ионы двухвалентного железа.
Хотя сам процесс перекисного окисления развивается в виде цепных реакций в липидной фазе мембран и липопротеинов, начальные (а возможно, и промежуточные) стадии этой сложной системы реакций протекают в водной фазе. Часть защитных систем клетки также локализуется в липидной, а часть — в водной фазах. В зависимости от этого можно говорить о водорастворимых и гидрофобных антиоксидантах.
Антиоксиданты водной фазы. Основные реакции в водной фазе, предшествующие цепному окислению, и роль антиоксидантов в ограничении скорости этих процессов можно представить в виде схемы:Супероксид- Каталаза,
дисмутаза пероксидазы
■О,
1Г>
jp рез+
Ловушки
Fe3+
м>
Ре2+
J
О,
с/г
Ко м п л е кс о н ы Цепные
реакции
Непосредственными предшественниками гидроксильного радикала, инициирующего цепное окисление липидов, служат ионы двухвалентного железа и перекись водорода (или образующийся из нее гипохлорит). По этой причине образование радикала гидроксила и пероксидация липидов тормозятся веществами, снижающими концентрацию одного из этих двух соединений. К ним относятся следующие вещества:
фермент супероксиддисмутаза — снижает концентрацию супероксидных радикалов и тем самым препятствует восстановлению ими ионов трехвалентного железа до двухвалентного. В клетке ионы же- - леза хранятся в трехвалентном состоянии в специальных депо, образованных субъединицами белка — ферритина;
ферменты каталаза и глутатионпероксидаза — удаляют перекись водорода. Эффективность работы глутатионпероксидазы зависит от концентрации свободного глутатиона, при снижении которой может возрастать концентрация цитотоксических гидроксильных радикалов;
регенерация восстановленного глутатиона (GSH) из окисленного (GSSG) осуществляется за счет НАДФН; этот процесс катализируется ферментом глутатионредуктазой. Недостаток глутатиона в клетках, например в эритроцитах, который может быть обусловлен действием токсичных веществ, например ионов тяжелых металлов или наследственным недостатком глутатионредуктазы, приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий;
соединения, связывающие ионы железа (комплексоны). Следует, однако, добавить, что в водной фазе некоторые комплексы ионов железа вступают в реакции с супероксидным радикалом и перекисью водорода наряду со свободными ионами железа.
Антиоксиданты, тормозящие развитие цепных реакций в липидной фазе. Основные реакции в липидной фазе биологических мембран и липопротеинов крови, а также роль антиоксидантов в ограничении скорости этих процессов можно продемонстрировать с помощью схемы
.Ловушки радикалов
LH | 02 J LH 102 Цепь окислеиия
HO^jr^ L»-*-^ LOO L* ^— **
PC
О
CsJ
5
cs
LO*
^
LOH
Fe2
Комплексоны
I LH
loo-Ц
LOO
♦ tt
Фосфолипаза^
НООН
GSH-пероксидаза
Fe5+
к
о.
*
Цепные реакции «ведут» свободные радикалы липидов (L* и LOO), разветвление цепей происходит при взаимодействии продукта пероксидации — гидроперекиси липидов (LOOH) с ионами Fe2+. Все соединения, снижающие концентрацию перечисленных веществ, выполняют функцию антиоксидантов. К ним относятся:
ферменты фосфолипаза и глутатионпероксидаза, разрушающие гидроперекиси липидов, предотвращая разветвление цепей окисления липидов в мембранах. При этом действие фосфолипазы заключается в отщеплении от фосфолипидов окисленной жирной кислоты, содержащей гидроперекисную группу (LOOH), а действие глутатионпероксидазы сводится к восстановлению этой группы до спиртовой с одновременным окислением глутатиона (GSH) до дисульфида (GSSG):
LOOH + 2GSH LOH + GSSG + Н20;
ловушки радикалов, которые называют иногда «липидными анти- оксидантами». По своей химической природе липидные антиоксиданты — это производные фенола. К ним относится ос-токоферол (витамин Е), убихинон (кофермент Q), тироксин, эстрогены и синтетические соединения,например ионол;
он
CH-,
сн,
сн,
сн,
Ионол![]()
![]()
сн.
н,с
a-Tocopherol (витамин Е
)
— соединения, связывающие железо. Большинство из них, включая такие природные соединения, как дипептид карнозин, не просто связывают железо, но, главное, не дают ему возможности приникнуть в липидную фазу мембран, поскольку образующиеся комплексы в силу своей полярности не проникают в гидрофобную зону.
Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, а затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина.
