
- •Патологическая физиология
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 695
- •Глава 12. Патологическая физиология 1237
- •.Краткие сведения об истории патологической физиологии
- •Экспериментально-физиологическое, физико-химическое направление
- •.Часть первая общая нозология
- •Глава 1. Общее учение о болезни
- •1.1. Здоровье и болезнь
- •1.1.1. Норма и здоровье
- •1.1.2. Определение сущности болезни
- •1.1.3. Патологическая реакция, патологический процесс, патологическое состояние
- •1.2. Общие вопросы учения об этиологии болезней
- •1.3. Общие вопросы учения о патогенезе болезней
- •1.4. Исходы болезни
- •На повреждение
- •2.1. Общая патология клетки
- •2.1.1. Повреждение клеток в патологии
- •2.1.2. Нарушение функций клеточных структур
- •Кусочки ткани Выделенные митохондрии
- •Время переживания органа при 24°с (мин)
- •2.1.3. Механизмы нарушения барьерной функции биологических мембран
- •СюТоксическое действие
- •Токсическое действие
- •2.1.4. Другие причины нарушения барьерных свойств липидного слоя мембран
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 705
- •Глава 12. Патологическая физиология 1247
- •2.1.5. Нарушение электрической стабильности липидного слоя
- •2.2. Общие реакции организма на повреждение
- •2.2.1. Общий адаптационный синдром (стресс)
- •2.2.2. Активация протеолитических систем плазмы крови
- •I Фактор Хагемана Калликреин j I Прекалликреин
- •2.2.4. Кома
- •2.2.5. Ответ острой фазы
- •2.2.5.2. Главные медиаторы ответа острой фазы
- •3.1. Реактивность организма
- •3.2. Виды реактивности
- •3.5. Резистентность
- •3.6. Факторы, влияющие на реактивность
- •3.7. Роль наследственности
- •Гидрооксифенил виноградная кислота
- •Фенилпиро- виноградная кислота
- •Гомоге нти зи н о вая кислота
- •Гомогентизиноксидаза (алкаптонурия)
- •4.1. Основные представления о строении
- •4.2. Общая стратегия иммунной защиты
- •4.3. Иммунодефицитные состояния
- •4.3.1. Первичные иммунодефициты
- •4.3.2. Вторичные иммунодефициты
- •4.4. Аутоиммунные процессы
- •4.5. Лимфопролиферативные процессы
- •5.1. Взаимоотношение аллергии и иммунитета
- •5.3. Специфические аллергические реакции
- •5.3.1. Аллергические реакции I типа (анафилактические)
- •5.3.2. Аллергические реакции II типа
- •5.3.3. Аллергические реакции III типа
- •5.3.4. Аллергические реакции IV типа
- •Характеристика повышенной чувствительности немедленного и замедленного типов
- •5.4. Атопия. Атонические и псевдоатопические заболевания
- •5.4.1. Механизмы развития
- •5.4.2. Механизмы обратимой обструкции дыхательных путей
- •5.5. Псевдоаллергия
- •5.5.1. Гистаминовый тип псевдоаллергии
- •5.5.2. Нарушение активации системы комплемента
- •5.5.3. Нарушения метаболизма арахидоновой кислоты
- •Глава 6. Патологическая физиология периферического (органного) кровообращения и микроциркуляции
- •Состояние кровотока в микрососудах при артериальной гиперемии, ишемии, капиллярном стазе и венозном застое крови,
- •Признаки расстройства периферического кровообращения (в.В. Воронин, модификация г.И. Мчедлишвили)
- •6.1. Артериальная гиперемия
- •6.3. Нарушение реологических свойств крови, вызывающее стаз в микрососудах
- •6.4. Венозный застой крови
- •Превалирование резорбция вал фильтрацией я оды а микрооо- суддк мозга
- •6.6. Кровоизлияние в мозг
- •7.1. Нарушение микроциркуляции
- •7.2. Воспалительные экссудаты
- •7.3. Эмиграция лейкоцитов периферической крови
- •7.4. Фагоцитоз
- •7.5. Специализированные функции нейтрофилов, моноцитов
- •7.6. Медиаторы воспаления
- •7.7. Исходы воспаления
- •8.1. Этиология
- •8.3. Функция органов и систем
- •9.1. Нарушение обмена белков
- •9.1.1. Нарушение расщепления и всасывания белков
- •9.1.4. Патология межуточного обмена белков (нарушение обмена аминокислот)
- •9.1.5. Изменение скорости распада белка
- •9.1.6. Патология конечного этапа обмена белков
- •9.2. Нарушение обмена липидов
- •9.2.1. Нарушение транспорта липидов и перехода их в ткани
- •9.2.2. Роль нарушений липидного обмена в патогенезе атеросклероза
- •9.2.3. Жировая инфильтрация и жировая дистрофия
- •9.3. Нарушение обмена углеводов
- •9.3.3. Нарушение регуляции углеводного обмена
- •9.4. Нарушение водного баланса
- •9.4.1. Основы регуляции водного баланса
- •9.4.2. Формы нарушения водного баланса
- •9.4.2.1. Увеличение объема внеклеточной жидкости (гиперволемия)
- •9.4.2.2. Уменьшение объема внеклеточной жидкости (гиповолемия)
- •9.5. Нарушение электролитного баланса
- •Организма человека
- •9.5.1. Нарушение баланса натрия
- •9.5.2. Нарушение баланса калия
- •9.5.3. Нарушение баланса кальция
- •9.5.4. Нарушение баланса фосфатов
- •9.5.5. Нарушение баланса магния
- •9.6. Нарушение кислотно-основного баланса
- •9.6.1. Основы регуляции кислотно-основного баланса
- •0A* й к * 5 сз" 5 неш Лшкжы Анионы КаикшыКат ионы
- •9.6.2. Основные показатели коб
- •9.6.3. Формы нарушения кислотно-основного баланса
- •9.6.3.1. Респираторный ацидоз
- •9.6.3.2. Метаболический ацидоз
- •9.6.3.3. Респираторный алкалоз
- •9.6.3.4. Метаболический алкалоз
- •9.6.3.5. Смешанные нарушения кислотно-основного баланса
- •10.2. Компенсаторно-приспособительные реакции при гипоксии
- •10.3. Нарушение обмена веществ
- •10.4. Коррекция гипоксии: необходим избыток или недостаток кислорода?
- •11.1. Механизмы клеточного деления
- •11 »2. Патофизиология клеточного деления
- •11.2.1. Активация онкогенов
- •11.2.2. Инактивация генов-супрессоров
- •11.2.3. Нарушение апоптоза
- •11.2.4. Нарушение механизмов репарации днк
- •11.3. Опухолевый рост
- •11.3.2. Этиология опухолей
- •11.3.3. Свойства опухолевых клеток in vitro
- •11.3.4. Межклеточная кооперация
- •11.3.5. Свойства злокачественных опухолей
- •11.3.6. Взаимоотношения опухоли и организма
- •11.3.7. Механизмы резистентности опухолей к терапевтическим воздействиям
- •.Часть третья нарушение функций органов и систем
- •Глава 12. Патологическая физиология нервной системы
- •12.1. Общие реакции нервной системы на повреждение
- •12.2. Нарушение функции нервной системы,
- •12.3. Метаболические энцефалопатии
- •12.4. Повреждение мозга,
- •12.5. Расстройства функций нервной системы, обусловленные повреждением миелина
- •12.6. Нарушение нервных механизмов управления движениями
- •12.6.1. Расстройства движений,
- •12.6.1.1. Болезни моторных единиц
- •12.6.1.2. Расстройства движений
- •12.6.1.3. Нарушение движений при повреждении мозжечка
- •12.6.1.4. Нарушение движений
- •13.1. Нарушение механизмов регуляции артериального давления
- •13.2. Расстройства функций мочевого пузыря
- •13.5. Вегетативные расстройства,
- •15.1. Нарушение центральных механизмов регуляции
- •15.2. Патологические процессы в железах
- •15.3. Периферические (внежелезистые) механизмы нарушения активности гормонов
- •15.4. Роль аутоаллергических (аутоиммунных) механизмов в развитии эндокринных нарушений
- •1]ДиОТипиЧесИиЕ ahtuteaa
- •16.1. Нарушение функций гипофиза
- •16.1.1. Недостаточность функции гипофиза
- •16.1.2. Гиперфункция передней доли гипофиза
- •16.2. Нарушение функций надпочечников
- •16.2.1. Кортикостероидная недостаточность
- •16.2.2. Гиперкортикостероидизм
- •16.2.3. Гиперфункция мозгового слоя надпочечников
- •16.3. Нарушение функций щитовидной железы
- •16.3.1. Гипертиреоз
- •16.3.2. Гипотиреоз
- •16.4. Нарушение функций околощитовидных желез
- •16.5. Нарушение функций половых желез
- •17.1. Краткие сведения
- •17.2. Атеросклероз
- •17.2.1. Теории происхождения
- •17.2.2. Регресс атеросклероза
- •17.3. Нарушение коронарного кровотока
- •17.3.1. Ишемия миокарда
- •17.3.2. Оглушенный и бездействующий миокард
- •17.4.Артериальная гипертензия
- •Гипертоническая болезнь!
- •17.4.1. Патогенез гипертонической болезни
- •17.4.2. Вторичная артериальная гипертензия
- •17.6. Механизмы развития сердечной недостаточности
- •17.6.2. Диастолическая форма сердечной недостаточности
- •17.7. Механизмы развития аритмий
- •17.7.1. Нарушение образования импульсов
- •17,7,2, Риэнтри
- •17.7.3. Нарушение проводимости
- •Внешнего дыхания
- •18.1. Определение понятия «дыхательная недостаточность»
- •18.2. Оценка функций внешнего дыхания придыхательной недостаточности
- •18.3. Патофизиологические варианты дыхательной недостаточности
- •18.3.1. Центрогенная дыхательная недостаточность
- •18.3.2. Нервно-мышечная дыхательная недостаточность
- •18.3.3. «Каркасная» дыхательная недостаточность
- •18.3.4. Механизмы дыхательной недостаточности при патологии дыхательных путей
- •18.3.5. Паренхиматозная дыхательная недостаточность
- •18.4. Показатели газового состава крови при дыхательной недостаточности
- •18.4.1. Гипоксемическая (I типа) дыхательная недостаточность
- •18.4.2. Гиперкапнически-гипоксемический (вентиляционный) тип дыхательной недостаточности
- •19.1. Основы регуляции клеточного цикла
- •19.2. Патология красной крови
- •19.2.1. Анемии
- •19.2.2. Эритроцитозы
- •19.4. Патология белой крови
- •19.4.1. Лейкоцитопении
- •19.4.2. Лейкоцитоз
- •19.5. Лейкозы (гемобластозы, лейкемии)
- •20.1. Факторы, свертывающие кровь
- •VIll/vWf I
- •20.2. Геморрагические синдромы
- •20.4. Синдром диссеминированного
- •20.5. Методы оценки нарушений системы гемокоагуляции
- •21.1. Нарушение лимфообразования
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 705
- •Глава 12. Патологическая физиология 1247
- •21.2. Недостаточность транспорта лимфы
- •21.3. Нарушение свертывания лимфы
- •21.4. Роль лимфатической системы в развитии отека
- •21.5. Функции лимфатической системы при развитии воспаления
- •22.1. Нарушение функций пищевода
- •22.2. Нарушение функций желудка
- •22.2.1. Нарушения секреции соляной кислоты и пепсина
- •22.2.2. Нарушение слизеобразующей функции желудка
- •22.2.3. Патофизиологические механизмы язвенной болезни
- •22.2.4. Нарушение двигательной функции желудка
- •22.3. Патофизиологические механизмы болей в животе
- •22.4. Нарушение экзокринной функции поджелудочной железы
- •22.4.1. Патофизиологические механизмы развития острого панкреатита
- •22.4.2. Патофизиологические механизмы развития хронического панкреатита
- •22.5. Нарушение функций кишечника
- •22.5.1. Нарушение переваривания и всасывания в кишечнике
- •22.5.2. Нарушения двигательной функции кишечника
- •23.1. Печеночно-клеточная недостаточность
- •23.2. Патофизиологические механизмы синдрома портальной гипертензии
- •23.3. Патофизиологические механизмы желтухи
- •24.1. Нарушение клубочковой фильтрации
- •24.2. Нарушение функций канальцев
- •24.3. Изменение состава мочи
- •24.4. Нефротический синдром
- •24.5. Острая почечная недостаточность
- •24.6. Хроническая почечная недостаточность
- •24.7. Мочекаменная болезнь
2.1.2. Нарушение функций клеточных структур
В табл. 2.1 перечислены изменения в свойствах отдельных клеточных структур, наблюдаемые на ранних стадиях развития неспецифической реакции клеток на повреждение.
Таблица 2.1
Ранние изменени в функционировании внутриклеточных структур
при повреждении клетки
|
Явление |
Проявление |
|
Увеличение проницаемости цитоплазматической мембраны |
Увеличение электропроводности Увеличение связывания красителей Снижение мембранного потенциала Выход ионов калия из клетки |
|
Явление |
Проявление |
|
Нарушение структуры и функций митохондрий Ацидоз Повреждение эндоплазматического ретикулума Изменение активности ферментов и рецепторов Повреждение генетического аппарата клетки |
Выход метаболитов Увеличение объема (набухание) клеток Увеличение внутриклеточной концентрации ионов кальция Снижение потребления кислорода Увеличение проницаемости внутренней митохондриальной , мембраны Набухание митохондрий Снижение кальций-аккумулирующей способности Активация ферментов лизосом Активация эндонукпеаз -> апоптоз Повреждение митохондрий, мутации,апоптоз |
Увеличение проницаемости цитоплазматической мембраны. Уменьшение электрического сопротивления ткани. Прямым методом измерения проницаемости мембран может служить изменение электрического сопротивления ткани (импеданс), которое состоит из омической и емкостной составляющих. Установлено, что импеданс ткани уменьшается при различных функциональных состояниях центральной нервной системы, при вегетативных неврозах. Уменьшение омического сопротивления тканей обусловлено в большинстве случаев возрастанием ионной проницаемости клеточных мембран.
Окраска цитоплазмы различными красителями. Большинство красителей плохо проникает через клеточную мембрану неповрежденных клеток и слабо связывается внутриклеточными структурами. Увеличение проницаемости клеточной и внутриклеточной мембран при повреждении клетки приводит к возрастанию количества красителя, вошедшего в клетку и связавшегося с компонентами цитоплазмы. На этом основаны многие! гистохимические методы определения жизнеспособности клеток.
Снижение мембранного потенциала. Для живых, нормально функционирующих клеток, характерно неравномерное распределение ионов между клеткой и окружающей средой, обеспечиваемое постоянной работой ионных насосов в мембранах клеток (рис. 2.1). Так, внутри клеток содержание Са2+ примерно в 10 ООО раз ниже, чем в окружающей среде; в клетках гораздо больше К+ и меньше Na+, чем в плазме крови или межклеточной жидкости (табл. 2.2). Благодаря различию в концентрации ионов в клетке и окружающей среде на цитоплазматической мембране имеется разность потенциалов со знаком «минус» внутри клетки (около -70 мВ для нервных и мышечных клеток). Уменьшение мембранного потенциала происходит как при неспецифическом увеличении ионной проницаемости
Клетка Митохондрия
Рис.
2.1.
Ионные насосы и каналы в клеточной
(слева) и митохондриальной (справа)
мембранах. 1 __ Na+
—
К+-
транспортная АТФаза; 2 — Са2+-транспортная
АТФаза; 3 — Na+—Н+-ионо-
обменник; 4 — ионные каналы для Na\
К+
иСа2+;
5 — протонный насос, сопряженный с
переносом электронов по дыхательной
цепи митохондрий, 6 — АТФ-синтетаза,
сопряженная с переносом протонов
внутрь митохондрий; 7 — канал для Са2+}
8 — переносчик
фосфата.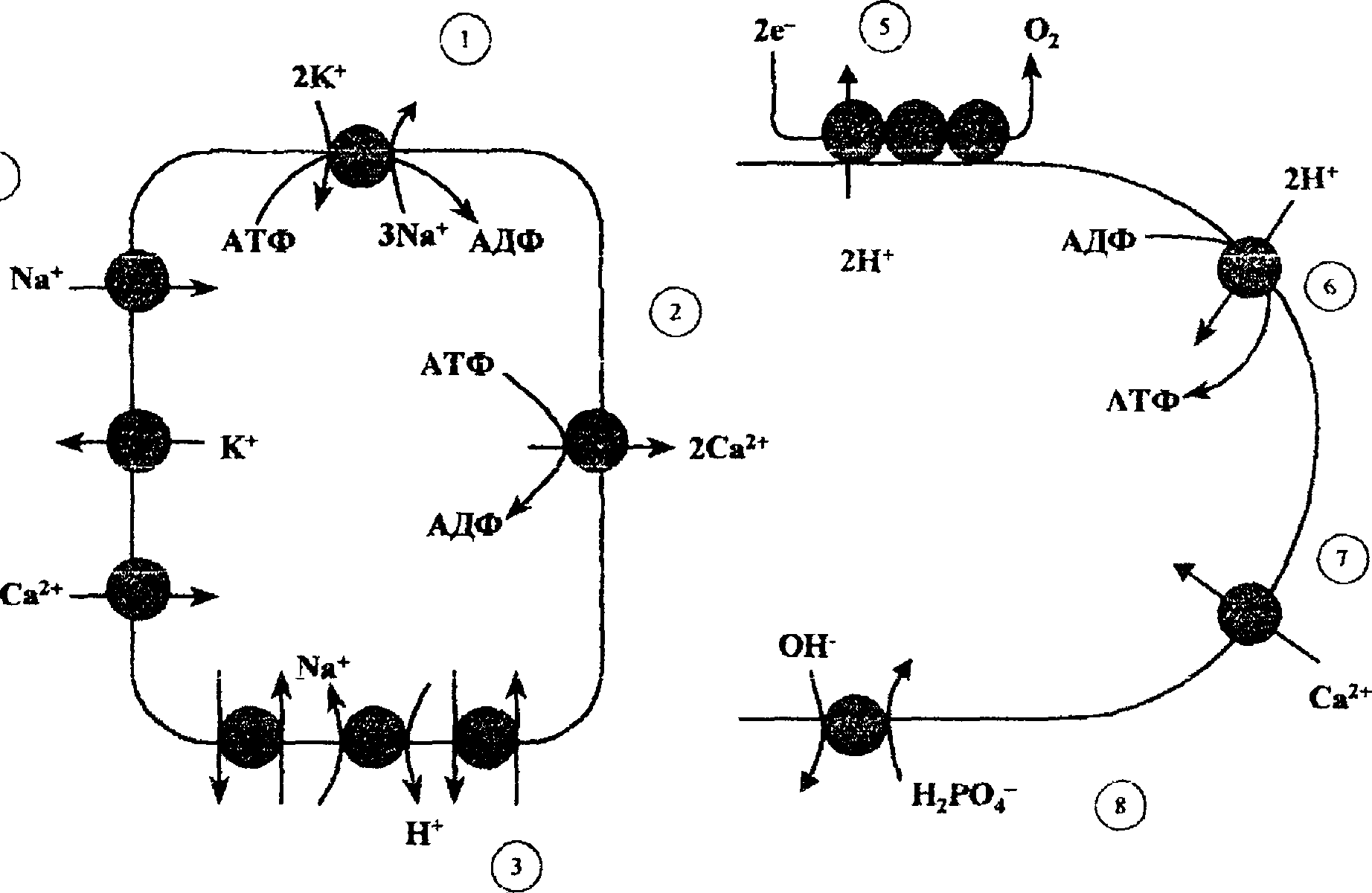
|
Таблица 2.2 Распределение ионов калия и натрия внутри и снаружи некоторых клеток Клетки |
Концентрация, моль/л |
Отношение внутренней концентрации к наружной | ||||||
|
Внутри |
Снаружи | |||||||
|
калий |
натрий |
калий |
натрий |
калий |
натрий | |||
|
Эритроциты |
|
|
|
|
|
| ||
|
человека |
112 |
37 |
5 |
143 |
22:1 |
1:3,9 | ||
|
Одиночное волокно |
|
|
|
|
|
| ||
|
портняжной мышцы |
|
|
|
|
|
| ||
|
лягушки |
125 |
15 |
2,6 |
110 |
48:1 |
1:7 | ||
|
Гигантский аксон |
|
|
|
|
|
| ||
|
кальмара |
410 |
49 |
22 |
440 |
19:1 |
1:10 | ||
мембран, так и при выравнивании концентраций ионов вследствие выключения работы клеточных насосов; последнее происходит как при прямом повреждении Na+—К4-—АТФазы, так и при снижении уровня АТФ вследствие нарушения биоэнергетических процессов в митохондриях. Например, установлено снижение мембранного потенциала клеток печени у лабораторных животных при асфиксии. Снижение мембранного потенциала наблюдается также при холодовом, радиационном, аллергическом и других повреждениях клеток, лизосом и прочих субклеточных структур.
Выход ионов калия из клеток. При активно работающей Na+—К+— АТФазе ионы калия постоянно накачиваются в клетку. Этот поток К+ внутрь компенсирует спонтанный выход калия наружу, который происходит в силу диффузии этих катионов из области с более высокой концентрацией калия в область с более низкой его концентрацией. Повреждение клетки сопровождается снижением содержания АТФ и выходом калия из клеток. Освобождение калия из тканей в кровь описано при механической травме, различных интоксикациях, аллергических состояниях, гипоксии и многих других повреждениях органов и тканей. Понижение содержания ионов калия в клетке может происходить также под влиянием больших доз ми- нералокортикоидов, при действии некоторых лекарственных веществ, например сердечных гликозидов. В свою очередь увеличение концентрации калия во внеклеточной среде приводит к снижению мембранного потенциала соседних клеток, что при электровозбудимости тканей может обусловить генерацию потенциалов действия. Так, увеличение концентрации калия в очаге инфаркта миокарда может стать одной из причин возникновения фибрилляции сердца.
Накопление ионов кальция в гиалоплазме. В нормальных клетках концентрация ионов кальция в клеточном соке отличается исключительно низкими значениями — 10*7 или даже 10~8 моль/л, тогда как в окружающей клетку среде содержится Ю-3 моль/л ионов кальция. При этом следует иметь в виду, что ионы Са2+ проходят в клетку не только самопроизвольно (процесс «утечки» через мембрану), но и через кальциевые каналы в мембране, которые открываются в ответ на изменение мембранного потенциала (потенциалзависимые кальциевые каналы, например в нервных клетках) или в ответ на присоединение гормонов и медиаторов к мембранным рецепторам (например, адреналина к адренорецепторам в клетках сердечной мышцы). Компенсирует вход ионов Са2+ в клетку работа трех типов кальциевых насосов: кальциевая помпа (Са2+—АТФаза) в мембранах эндоплазматической сети и клеточной мембране, система аккумуляции Са2+ в митохондриях, в некоторых клетках Na+—Са2+- обменник, встроенный в цитоплазматическую мембрану.
При повреждении клетки нарушается работа митохондрий: снижается мембранный потенциал и прекращается окислительное фосфори- лирование. При снижении мембранного потенциала в митохондриях уменьшается накопление Са2+. Снижение уровня АТФ в клетке приводит к выключению работы саркоплазматической Са2+-АТФазы. Все это способствует накоплению кальция в цитоплазме. Увеличение концентрации Na+ в клетке вследствие угнетения Ыа+-насоса при недостатке АТФ приводит к выключению также и системы Ыа+-Са2+-обмена через клеточную мембрану. В результате всего этого увеличивается концентрация кальция от 10-8— 10-5моль/л (в норме) до 10~6— Ю-5 моль/л. Это приводит к нарушениям цитоскелета, активации сократительных структур, образованию нерастворимых включений кальция в матриксе митохондрий, повреждению внутриклеточных мембран и общей дезорганизации метаболизма. Морфологически это проявляется в замедлении броуновского движения различных включений внутри клетки (увеличение «вязкости протоплазмы») и возрастании светорассеяния; красители начинают легче проникать в клетку и связываются в большом количестве с внутриклеточными структурами — все эти признаки типичны для «неспецифической реакции клетки на повреждение» по Д.Н. Насонову и В.Я. Александрову (см. выше).
Выход метаболитов. Увеличение проницаемости мембран клеток и ухудшение работы насосов приводят к тому, что компоненты цитоплазмы выходят в окружающую среду. Вышедшие из клеток вещества отнюдь не безразличны для других клеток, тканей и органов. Так, среди веществ, выходящих из клеток, поврежденных в результате ишемии (нарушения кровотока) или ожога, имеются полипептиды, обладающие способностью останавливать сокращение сердца (ишемический, ожоговый токсины). Эти вещества обнаруживают различными методами, включая измерение хемилюминесценции плазмы крови, интенсивность которой снижается в присутствии полипептидных токсинов.
Увеличение объема (набухание) клеток. Увеличение объема клеток — один из наиболее ранних признаков ее повреждения, который проявляется, например, при недостатке кислорода в ткани (тканевая гипоксия). Сохранение нормальной формы и объема клеток связано с состоянием цитоскелета и поддержанием определенного соотношения между осмотическим давлением белков и электролитов внутри и вне клетки. При этом форма клетки определяется в значительной мере цитоске- летом, тогда как объем — поддержанием осмотического баланса. Поскольку все биологические мембраны хорошо проницаемы для воды, но плохо проницаемы для растворенных в воде веществ (включая соли), клетки, так же как и внутриклеточные структуры, например митохондрии, обладают свойством осмометра: их объем изменяется при изменении концентрации ионов и молекул внутри и вне клетки или органеллы. При этом строго поддерживается равенство общей концентрации всех ионов и молекул внутри и вне клетки.
Как только в клетке начинают накапливаться новые ионы и молекулы, ее объем возрастает, так как вода входит внутрь клетки. Выкачивание ионов мембранным насосом сопровождается уменьшением ее объема за счет самопроизвольного выхода избытка воды.
В нормальной клетке имеется, как правило, избыточное по сравнению с окружающей средой количество белков, что могло бы привести к появлению избыточного осмотического (онкотического) давления и увеличению объема клетки, если бы одновременно не происходило удаление (выкачивание) ионов натрия из клетки за счет работы Na+—К+—АТ- Фазы (см. рис. 2.1). Вместе с натрием, который выкачивается ионной помпой за счет энергии гидролиза АТФ, происходит выход ионов СГ за счет электрического поля, создаваемого диффузией ионов К+ и переносом Na+, так как мембрана клетокхорошо проницаема для ионов С1\ Иначе говоря, натриевый насос (Na+—К+—АТФаза) удаляет из клетки Na+, уменьшает концентрацию ионов в ней, что приводит к уменьшению клеточного объема.
Этому процессу противостоит процесс самопроизвольного входа, или утечки, натрия внутрь клетки через дефекты в липидном бислое, через натриевые каналы и через переносчики, сопрягающие вход натрия с транспортом Сахаров и аминокислот в клетку. Таким образом, живая клетка находится в состоянии динамического равновесия, при котором «протечка» клеточной мембраны компенсируется постоянной работой ионной помпы (это так называемая leak and pump-гипотеза).
При патологии может происходить либо увеличение ионной проницаемости клеточной мембраны (возрастание «протечки»), либо нарушение работы ионных помп (например, при недостатке энергообеспечения, т.е. при снижении уровня АТФ). В опытах с изолированными тканями печени, почек, мозга было установлено, что отравление солями ртути или других тяжелых металлов приводит к увеличению ионной проницаемости мембран клеток (увеличению «протечки») и возрастанию объема клеток (т.е. набуханию ткани). Увеличение объема клеток можно вызвать и другим способом — нарушением системы их энергообеспечения. Действительно, было показано, что объем клеток возрастает при гипоксии, действии дыхательных ядов — цианида или окиси углерода — и разобщителей окислительного фосфорилирования, таких, как динитрофенол.
' Набухание клеток — процесс, далеко не безразличный для функционирования клеток и ткани в целом. Первым его результатом оказывается сдавливание кровеносных сосудов и затруднение кровообращения.
Так, при ишемии происходит набухание клеток, и последующее общее возобновление кровообращения не сразу и не всегда приводит к восстановлению жизнедеятельности, потому что кровь не проникает в мелкие кровеносные сосуды, сдавленные набухшими клетками. То же происходит при трансплантации органов. Иногда применяют предварительное промывание пересаженного органа гипертоническим раствором, который восстанавливает прежний объем клеток и нормализует микроциркуляцию.
Нарушение структуры и функций митохондрий. Нарушение биоэнергетических функций митохондрий — одно из наиболее ранних проявлений повреждения клеток. Например, после прекращения кровообращения происходит нарушение окислительного фосфорилирования в митохондриях через 20—30 мин в печени и через 30—60 мин в почках. Приблизительно в эти же сроки появляются и другие признаки повреждения клеток.
Нарушение
функций митохондрий изучают после
выделения этих органелл из ткани, при
этом важно не повредить митохондрий в
ходе их выделения. Один из способов
изучения функции митохондрий — изме-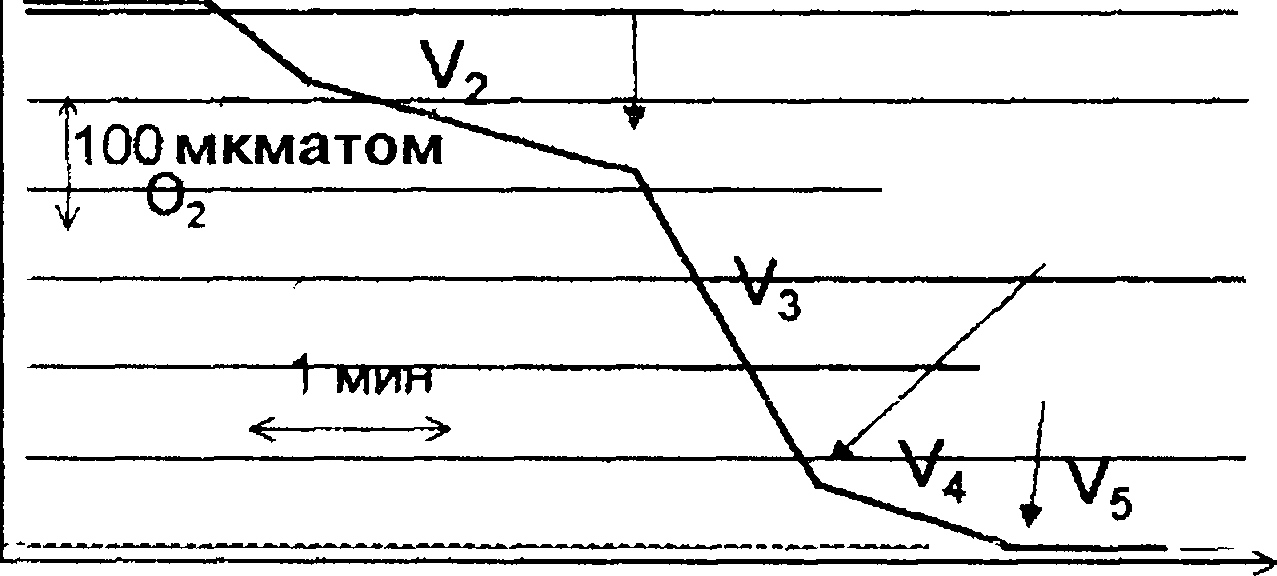
f
Добавлены
митохондрии
Добавлен
сукцинат
Закончилась
АДФ
Исчерпан
кислород
Время
инкубации суспензии без доступа
кислорода
Рис.
2.2.
Типичная кривая потребления кислорода
митохондриями
в
различных состояниях (по Б. Чансу).
Суспензия митохондрий в изотоническом
растворе KCI
содержала
ортофосфат и АДФ, а также растворенный
в среде кислород, но не содержала
субстратов дыхания (V2,
де-
энергизованные митохондрии) При
добавлении сукцината митохондрии
энергично потребляют кислород и
происходит синтез АТФ (V окислительное
фосфорилирование) Если АДФ было немного,
оно быстро расходуется, фосфорилирование
прекращается и скорость дыхания резко
снижается (V4,
дыхательный
контроль, митохондрии энергизо- ваны,
на мембране поддерживаеися высокая
разность потенциалов). Когда в среде
кончается кислород, митохондрии
перестают дышать и деэнергизуются
(V5).
Тангенс
угла наклона участков этой ломаной
линии представляет собой скорость
потребления кислорода в различных
состояниях (V2—V5).
ей
П
О
Он
§
о
в
*
к
я
я
аЗ
э-
ж
а> ея
ж
о
«
О
Снижение потребления кислорода. Уменьшение скорости потребления кислорода митохондриями, связанное с нарушением работы переносчиков электронов, наблюдается при действии многих токсичных соединений, например ионов тяжелых металлов, таких, как ртуть или серебро, ряда гидрофобных соединений, производных различных углеводорода, при перекисном окислении липидов. Оно может быть также следствием набухания митохондрий и разрыва их наружных мембран, в результате чего из митохондрий выходит цитохром С, который является одним из переносчиков электрона по дыхательной цепи
.
Увеличение проницаемости внутренней митохондриальной мембраны. Низкая скорость дыхания митохондрий в состоянии 4 связана с тем, что высокий мембранный потенциал (создаваемый в отсутствие АДФ и при наличии кислорода и субстратов) препятствует переносу протонов через внутреннюю мембрану, связанному с работой дыхательной цепи, и тем самым останавливает поток электронов по этой цепи. Утечка ионов снимает мембранный потенциал и приводит к нарастанию скорости дыхания (V4). Поэтому рост V4 свидетельствует об увеличении проницаемости внутренних мембран митохондрий. В митохондриях V4 растет при повреждении органелл в результате гипоксии или пероксидации ли- пидов.
Анализ полярографических кривых (см. рис. 2.2) позволяет определить два взаимосвязанных показателя работоспособности митохондрий. Первый — это коэффициент Р/О, который рассчитывают как отношение:
Р _ Синтезированный АТФ, моль О Поглощенный кислород, моль
Второй показатель — коэффициент дыхательного контроля (ДК), который находят как отношение:
ДК = V3/V4.
Снижение ДК до единицы сопровождается снижением коэффициента Р/О до нуля и является свидетельством разобщения процессов окисления и фосфорилирования в митохондриях при их повреждении.
Снижение способности накапливать кальций. Параллельно разобщению окислительного фосфорилирования наблюдается потеря способности митохондрий к накоплению ионов кальция. В присутствии избытка субстратов дыхания и при наличии кислорода и ортофосфата митохондрии клеток печени способны накопить в матриксе количество фосфата кальция, по массе превышающее массу митохондрий в сотни и даже в тысячу раз! Повреждение митохондрий приводит к падению разности потенциалов на митохондриальной мембране. Положительно заряженные ионы кальция, удерживаемые в матриксе электрическим полем, начинают выходить наружу из поврежденных митохондрий.
Разобщение окислительного фосфорилирования и выход
кальция из митохондрий имеют самые драматические последствия для клетки.
Снижение уровня АТФ в клетке приводит к выключению ионных насосов, выходу калия и вхождению ионов натрия и кальция в клетку из окружающей среды. Это в свою очередь приводит к активации целого комплекса ферментных систем, активируемых ионами кальция, включая фосфолипазы, многие системы биосинтезов и протеинкиназы; метаболизм клетки вначале активируется, а затем дезорганизуется. Именно повреждение митохондрий является, согласно современным представлениям, тем переломным моментом, после которого изменения в клетке, вызванные повреждающим агентом, становятся необратимыми и клетка погибает.
Набухание митохондрий. Весьма важным морфологическим признаком повреждения митохондрий является их набухание; оно наблюдается, например, в клетках миокарда при сердечной недостаточности, а также при многих инфекционных, гипоксических, токсических и других патологических процессах. Набухание митохондрий происходит при помещении клеток в гипотоническую среду, под влиянием ионизирующей радиации, бактериальных токсинов, при действии химических ядов и других патогенных агентов на клетку. Набухание приводит сначала к разрывам наружных мембран митохондрий, а затем — к их полному разрушению.
В опытах с изолированными митохондриями выявлены два типа набухания: пассивное и активное. В противоположность клеточным мембранам, сравнительно хорошо проницаемым для К+ и CI, внутренние мембраны митохондрий непроницаемы для заряженных частиц (ионов), за исключением Са2+ и, возможно, ионов железа. В изотоническом растворе KCI неповрежденные митохондрии сохраняют свой объем, несмотря на то что концентрация ионов калия и хлора внутри существенно меньше, чем снаружи: осмотическое давление внутри создается и другими ионами, а также белками матрикса. При одновременном увеличении проницаемости для ионов калия и хлора они начинают диффундировать в митохондрии, что приводит к повышению внутриосмотического давления, входу воды и набуханию органелл, которое называется пассивным, так как не зависит от дыхания и энергизации. К агентам, вызывающим пассивное набухание, относятся ионы тяжелых металлов, включая ртуть, серебро, свинец. Таким же действием обладает далеко зашедшее перекис- ное окисление липидов в мембранах митохондрий.
В живой клетке чаще отмечается иной тип — активное набухание, связанное с работой цепи переноса электронов. Повреждение митохондрий под действием малых доз тяжелых металлов, активации собственной фосфолипазы в условиях гипоксии, при перекисном окислении липидов сопровождается прежде всего повышением проницаемости внутренней мембраны для катионов. В присутствии источников энергии (субстраты дыхания и кислород, АТФ) на мембранах митохондрий генерируется разность потенциалов величиной около 170—180 мВ со знаком «минус» в матриксе, под действием которой К+ поступает внутрь поврежденных митохондрий. Вместе с калием в матрикс поступает ортофосфат, который переносится в электронейтральной форме через внутреннюю мембрану с помощью специального белкового переносчика. Активное (т.е. связанное с затратой энергии) накопление фосфата калия в матриксе сопровождается набуханием митохондрий.
Ацидоз. Любое повреждение клетки сопровождается ацидозом ее цитоплазмы (рН падает до 6,0 и ниже). Первичный ацидоз в поврежденной клетке следует отличать от вторичного ацидоза в воспаленной ткани, который возникает значительно позднее (через несколько часов) после нанесения повреждения. Первичный ацидоз повреждения — следствие накопления в клетке определенных продуктов метаболизма, таких, как продукт гликолиза — молочная кислота и др. Первичный ацидоз в по- вреждеииой ткани возникает при действии различных повреждающих агентов: механического воздействия, действия химических агентов (например такого, как горчичное масло), бактериального (дизентерийная палочка, гемолитический стафилококк). Ацидоз повреждения возникает в тканях также при гипоксии.
Изменение активности ферментов и рецепторов. Активация ферментов лизосом. В поврежленных клетках выходят в цитоплазму и активизируются гидролитические ферменты, заключенные в фосфоли- пидные везикулы — лизосомы. Лизосомы содержат катепсины, рибонук- леазу, кислую фосфатазу, дезоксирибонуклеазу, гиалуронидазу и другие ферменты. Различные повреждающие агенты, например эндотоксины бактерий кишечно-тифозной группы, а также мелкие неорганические частицы (двуокись кремния, двуокись титана, алмазная пыль), попадая в лизосомы, разрушают их. Активация лизосомальных ферментов может происходить не только под действием тех или иных специфических факторов, но и в результате ацидоза, характерного для неспецифической реакции клетки на то или иное повреждающее воздействие. Одним из процессов, вызывающих выход лизосомальных ферментов, является также активация пероксидации липидов в лизосомальных мембранах.
Пока до конца неясно, является ли активация лизосом механизмом удаления содержимого погибшей клетки или причиной ее повреждения при действии неблагоприятных факторов.
Апоптоз. Смерть клеток далеко не всегда является признаком патологии. Развитие организма требует в ряде случаев удаления клеток одного типа и замены их другими. Второй процесс связан с клеточным делением. Первый — запрограммированная смерть клетки — называется апоптозом и связан с запуском синтеза ферментов, разрушающих клеточные структуры, под влиянием внешнего сигнала, который сам по себе для клеток безвреден. В разных случаях сигналом для апоптоза могут служить совершенно разные вещества, например определенные гормоны или, наоборот, прекращение их поступления извне. Цепь событий, приводящих к апоптозу, в норме включает следующие стадии:
связывание сигнальной молекулы с рецептором на поверхности клетки;
запуск каскада реакций внутриклеточной сигнализации;
активация синтеза деструктивных ферментов, в частности таких, как эндонуклеазы, которые гидролизуют нуклеиновые кислоты;
нарушение функционирования клетки;
автолиз.
Различные факторы, оказывающие повреждающее действие, могут непосредственно усиливать то или иное звено системы внутриклеточной сигнализации, что сопровождается синтезом ферментов апоптоза.
Повреждение генетического аппарата клетки. Нуклеиновые кислоты весьма чувствительны к прямому действию повреждающих агентов, таких, как облучение ионизирующей радиацией, ультрафиолетовым и видимым светом в присутствии некоторых окрашенных соединений — фотосенсибилизаторов. В значительной мере повреждения нуклеиновых кислот исправляются в результате репарации. В противном случае возникают нарушения в геноме (мутации) и в работе систем биосинтеза белка. Многие необратимые изменения в клетках (например, при интоксикациях или в ходе процесса старения) связывают с повреждением генетического аппарата митохондрий.
Повреждение рибосом и полисом. При токсических воздействиях на клетки изменяются конфигурация эндоплазматической сети и связанными с ней рибосомы. Например, при отравлении тринитротолуолом в клетках печени мембраны эндоплазматической сети и расположенные на них рибосомы принимают форму различных завитков в нормальных клетках. Синтез белков осуществляется на полисомах. При угнетении синтеза определенных белков, например синтеза гемоглобина при апласти- ческой анемии в клетках костного мозга, уменьшается число полисом и наблюдается их распад на отдельные рибосомы.
Последовательность нарушений в клетке при гипоксии. Последовательность изменений в клетке в результате прекращения доступа кислорода одинакова для самых различных тканей. Это показали опыты со срезами тканей, изолированными клетками и изолированными клеточными органеллами, в частности митохондриями. В печени, находящейся в условиях аноксии при комнатной температуре, последовательность событий такова:
0—5 мин аноксии — снижение уровня АТФ в клетке в 2—4 раза, несмотря на активацию гликолиза;
5—15 мин — появление Са2+ в цитоплазме клетки, активация гидролитических ферментов, в том числе фермента фосфолипазы А2 митохондрий. Содержание Са2+ в митохондриях повышается, так как они еще не повреждены (стадия 1 на рис. 2.3);
15—30 мин — гидролиз митохондриальных фосфолипидов фосфо- липазой А2 и нарушение барьерных свойств митохондриальной мембраны. Реоксигенация ткани на этой стадии приводит к активному набуханию митохондрий. Дыхательный контроль в митохондриях нарушен, окислительное фосфорилирование разобщено, способность митохондрий накапливать ионы кальция снижена (стадия 2 на рис. 2.3);
30—60 мин — частичное восстановление функций митохондрий, временное повышение дыхательного контроля, способности накапливать кальций, (стадия 3 на рис. 2.3). Механизм компенсаторных процессов, приводящих к временному улучшению функций митохондрий, неизвестен, но связан с функцией клетки в целом, так как при анаэробной инкубации изолированных митохондрий это явление не наблюдается;
60—90 мин: необратимое повреждение митохондрий и полная гибель клеток (стадия 4 на рис. 2.3).
