
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Вода, ее содержание и роль в организме
Вода составляет 75% биомассы Земли, 65% общей массы животного организма. Вода обеспечивает всасывание, механическое передвижение питательных веществ, продуктов обмена, является универсальным растворителем. Участвует в процессах набухания, осмоса, создает онкотическое добавление в крови, тканях. Для воды характерна высокая удельная теплоемкость, теплопроводность; она обеспечивает поддержание температуры тела. Вода высокополярное соединение, вызывает диссоциацию электролитов, обуславливает гидратацию, участвует в гидролитическом распаде, вода сама является конечным продуктом обмена в процессе биологического окисления.
Все основные химические реакции в клетке – биосинтез, ферментативный катализ происходят с участием воды. Молекула воды – электрический диполь, дипольный момент 1,86. Для молекул воды характерна водородная связь, определяющая в значительной степени ее свойства и значение. Водородные связи возникают между частичным отрицательным зарядом атома кислорода одной молекулы воды и частичным положительным зарядом атома водорода соседней. Каждая молекула воды связана с четырьмя молекулами H2O, образуя сетку водородных связей ( рис. 13.1.).
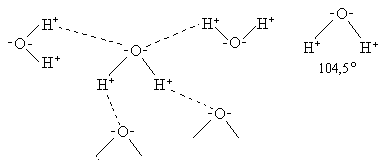
Рис. 13.1. Образование сетки водородных связей.
При внешних воздействиях сетка водородных связей перестраивается (растворение различных веществ, образование пара, льда), этим определяется ряд свойств воды. Между молекулами воды имеются пустоты, которые могут заполняться частицами растворенного вещества. Это очень важное свойство воды как растворителя. Так, в одном литре воды лишь 370 мл занято ее молекулами, а 630 мл составляет межмолекулярное пространство, где протекают различные процессы в ходе растворения, диффузии, гидролитического расщепления.
Для воды характерна очень низкая вязкость, что придает водным растворам хорошую текучесть и быстрое перемещение жидкостей.
В организме вода находится в свободном и связанном (иммобилизованном) виде. Свободная вода содержится в плазме крови, лимфе, спинномозговой жидкости, в пищеварительных соках, моче. В межклеточном пространстве свободной воды мало, она там удерживается капиллярными силами. Свободная вода обеспечивает приток к тканям питательных веществ и удаление из них конечных продуктов обмена.
Связанная вода не способна к свободному перемещению. Часть воды связана с белками (с полярными группами) – это гидратационная вода. Каждые 100 г белка могут связывать 18-20 г воды. На 1 молекулу нуклеиновой кислоты приходится 100000 молекул воды, белка – 40000 и липидов – 1500 молекул воды. Гидратационная вода не замерзает при охлаждении до Oо C и ниже, имеет повышенную плотность (1,48-2,4), в ней не растворяются вещества, обычно растворимые в воде. Эти отличия обусловлены упорядоченным расположением молекул (диполей) воды вокруг полярных групп гидрофильных коллоидов.
Часть иммобилизованной воды находится в надмолекулярных клеточных структурах (мембраны, органеллы, фибриллярные агрегаты). Такая вода сохраняет способность растворять соли и растворимые вещества, обеспечивает высокую скорость химических реакций в тканях, способствует сохранению постоянной формы этих органелл. Так, от степени набухания митохондрий зависит интенсивность окислительногфосфорилирования, от насыщения рибосом водой – скорость белкового синтеза (до 80-90%).
Количество гидратационной воды в организме с возрастом снижается, как результат снижения у коллоидов способности к гидратации. Коллоиды цитоплазмы постепенно подвергаются синерезису, вследствие этого ткани теряют упругость, сморщиваются.
Животные лишенные воды погибают быстро. Например, хорошо упитанная собака может выдержать голодание в течение 100 дней, а без воды – погибает через 10 дней. Животное может жить при полном отсутствии запасов жира и потере до 50% белков, но потеря 10% воды вызывает тяжелые изменения, а потеря 15-20% воды – влечет за собой смерть. Потребность в воде и распределение ее в тканях изменяется в зависимости от состава корма, физиологического состояния, продуктивности и т.д. Животные в пустыне могут обходиться без воды довольно долго, за счет эндогенной воды. При окислении 1 г углеводов образуется 0,55 г воды; 1 г белков – 0,41 г воды; 1 г жиров – 1,07 г воды.
Среди представителей низшего животного и растительного мира есть формы, которые могут продолжительное время оставаться без воды и далее высыхать. При этом они не погибают, а переходят в состояние анабиоза. В случае повышения влажности внешней среды они вновь возвращаются к активной жизни. К таким формам относятся черви коловратки, бактерии, некоторые насекомые, лишайники.
Потребность животных в воде удовлетворяется в основном за счет поступления ее извне непосредственно и при поедании сочных кормов. Организм коровы, например, за сутки принимает 40-50 л воды, кроме этого в желудочно-кишечный тракт в составе кишечных соков выделяется еще 120-130 л воды, из этого количества лишь 10% выделяется с калом, а остальная часть обратно всасывается в кровь. Вода постоянно теряется из организма с мочой, потом, секретами (молоко), с выдыхаемым воздухом.
Регуляция водного обмена осуществляется центральной нервной системой, действием некоторых гормонов. Например, вазопрессин нейрогипофиза (антидиуретический гормон) способствует реадсорбции из первичной мочи воды; альдостерон (гормон коры надпочечников) способствует задержанию натрия в организме, тем самым удержанию воды в организме, т.к. катионы натрия повышают гидратацию тканей.
Количество воды в тканях повышается при заболеваниях почек, нарушении сердечно-сосудистой системы, при белковом голодании, при циррозе печени. Увеличение задержания воды в межклеточном пространстве приводит к отекам.
Электролиты тканей. Обмен воды тесно связан с обменом электролитов. Значение минеральных солей в питании животных и человека изучено достаточно подробно. Животные получают минеральные вещества в составе кормов и питьевой воды. Поэтому имеется прямая связь минерального питания с окружающей средой. Почти все элементы земной коры встречаются в составе растений и животных тканях. Недостаточность или избыточное содержание отдельных элементов в окружающей среде, и как результат – в кормах – приводит к различным нарушениям (учение В.И. Вернадского, А.П. Виноградова, Я.В. Пейве, В.В. Ковальского и др.). Проблемы биогеохимии изучались особенно интенсивно в последние десятилетия. Отдельные области земли отличаются между собой химическим составом почв и природных вод – в них может быть повышенное или пониженное содержание отдельных химических элементов. На этой почве у животных и человека развиваются эндемические заболевания (endemos – местный). В нашей стране изучены эндемические районы по зобу из-за недостатка йода. В районах Нечерноземья РФ описано пониженное содержания кобальта, йода, меди как результат – акобальтозы, авитаминоз В!2, анемия, эндемический зоб. Между отдельными элементами при их действии на организм существует антагонизм, например, между Ca2+ и Zn2+; Zn2+ и Cu2+; Cu2+ и Mo2+; Mo2+ и S2+; Co2+ и Mn2+ и т.д. Нарушение минерального обмена у животных отмечается в связи с загрязнением окружающей среды, интенсивной технологией земледелия.
Ионы металлов в организме рассматриваются в качестве «комплексообразователей». Они в таком виде находятся в составе ферментов, известно свыше 300 ферментов, содержащих в своем составе металлы. В одних случаях металлоферменты с прочной связью с металлом (истинные), в других случаях металлы связаны непрочно.
«Истинные металлоферменты» участвуют в окислительно-восстановительных процессах организма. В активные центры этих ферментов, как правило, входят строго определенные катионы, которые не удается заменить другими. В составе истинных металлоферментов чаще всего находятся медь, молибден, цинк (Cu2+, Mo2+, Zn2+).
В ферментах, где металл с апоферментом связан непрочно, минеральный компонент не представляет строгой специфичности и может заменяться другими близкими по химическим свойствам металлами.
Биологическая активность элементов в организме во многом зависит от их атомного строения: с нарастанием атомной массы, как правило, увеличивается токсичность элементов, уменьшается их процентное содержание.
В организме всего 2-3% минеральных веществ, но они распределяются неравномерно. Натрий – содержится в больших количествах в различных жидкостях организма. Калий – внутри клеток, кальций, магний, фтор – в костной ткани.
Минеральные вещества усваиваются в основном в тонком отделе кишечника, а некоторые ионы всасываются уже в желудке, а также в толстом отделе кишечника. Всасывание их – активный, контролируемый, сложный процесс. После всасывания солей, их ионы откладываются избирательно.
Кальций, магний, фтор, стронций, цезий, рубидий, бериллий, алюминий, свинец, олово, титан откладываются в костной ткани. Натрий, калий – в мышцах, коже. Железо, медь, кобальт, марганец, никель, молибден, селен и др. – накапливаются в печени.
Основное значение минеральных веществ – это регуляция физико-химических процессов в тканях организма. Они принимают участие в формировании третичной и четвертичной структуры биополимеров, что обеспечивает нормальное функционирование ферментативной активности, гормональной активности, реализации генетической информации, заложенной в нуклеиновых кислотах, формирование надмолекулярных структур клеточных образований. Например, активная форма инсулина образуется с ионами цинка; биологическая активность рибонуклеиновых кислот проявляется с участием ионов цинка, марганца, никеля; ассоциация и диссоциация рибосом на 60 S и 40 S субчастицы, образование третичной структуры транспортных рибонуклеиновых кислот связана с ионами магния, окислительное фосфорилирование в митохондриях и свободное окисление происходит с участием ионов железа и меди.
Минеральные вещества принимают участие в ферментативном катализе. Многие ферменты проявляют активность при участии ионов металлов. Часто связь иона металла непрочная, т.е. ион металла является кофактором. В виде комплекса с металлом фермент проявляет максимальную активность, приобретая соответственную пространственную конфигурацию: ион металла участвует в образовании третичной и четвертичной структуры белков и нуклеиновых кислот. Известно около 100 ферментов, активность которых обуславливается ионами Na+, K+, Сl-, Zn2+, ферменты мультимеры образуются с участием ионов металлов Mg+, Mn +, Zn +, Ca2+ и др.
В ряде случаев ионы металлов прочно соединены с ферментами, т.е. являются коферментами. К ним относятся ферменты-металлопротеины, содержащие ионы Cu2+, Fe2+ – железосерные белки, цитохромы и т.д.
Минеральные вещества имеют тесную связь с обменом нуклеиновых кислот. Так вторичная и третичная структура ДНК и РНК поддерживается ионами Fe2+, Cu2+, Mn2+, Mg2+,Co2+. Ферменты ускоряющие распад и синтез нуклеиновых кислот, нуклеотидов, нуклеозидов, пуринов, пиримидинов, активируются ионами металлов, где особенно важную роль играют ионы магния. Важную роль играют металлы в обмене белков, липидов, углеводов.
