
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Буферные системы крови
Биохимические процессы в организме животных могут происходить только при строго определенных значениях рН. Даже незначительное изменение рН среды вызывает изменение активности ферментов и нарушение течения биохимических процессов. Смещение рН крови на 0,5 единицы приводит к агонии. Допустимые физиологические колебания рН крови не выше 0,05-0,07 единицы. В процессе жизнедеятельности постоянно образуются промежуточные продукты окисления, в том числе значительное количество CO2. Из пищеварительного тракта всасываются органические кислоты, продукты брожения углеводов. Много кислот образуется в тканях в результате распада и окисления фосфорных эфиров и углеводов, нуклеотидов и других фосфор- и серосодержащих соединений с образованием соответственно H3PO4, H2SO4 . Усиленное образование кислых продуктов происходит при нарушении углеводного, липидного и белкового обмена, когда в крови в больших количествах появляются кетоновые тела (ацетоуксусная и β-оксимасляная кислоты, ацетон).
Постоянно образуются также соединения, имеющие щелочную природу: аммиак, креатин, основные аминокислоты и т.д. Однако кислоты и основания, попадая в кровь, не изменяют рН крови благодаря наличию регуляторных механизмов – буферных систем крови и органов выделения.
Сила буферных систем крови (буферная емкость) весьма велика. Например, для смещения рН крови к ней нужно добавить в 320 раз больше кислоты, чем к такому же количеству воды.
В крови имеются как органические, так и минеральные буферные системы. К органическим буферным системам относятся: гемоглобиновый-оксигемоглобиновый буфер эритроцитов, белки плазмы крови, аминокислоты, органические кислоты и их соли.
К минеральным буферным системам относятся гидрокарбонатный и фосфатный буферы. Гидрокарбонатная буферная система крови состоит из (в соотношении объем % CO2): CO2 – 2,7; H2CO3 – 1; NaHCO3 – 47; Na2CO3 – следы.
Образующиеся в процессе обмена кислоты взаимодействуют с гидрокарбонатом натрия, и в результате образуются соли, а протон водорода связывается с анионом гидрокарбоната, в результате образуется слабо диссоциирующая угольная кислота H2CO3. В легких она разлагается на H2O и CO2. CO2 удаляется из организма с выдыхаемым воздухом:
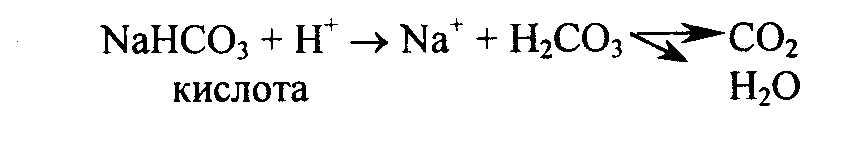
Второй компонент гидрокарбонатной буферной системы – H2CO3 будет нейтрализовать анионы гидроксила в случае защелачивания:
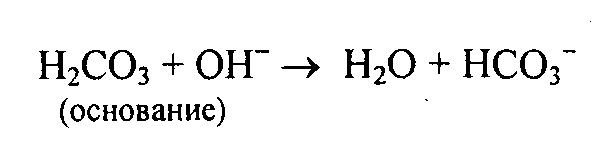
Для поддержания постоянства рН крови необходим определенный запас гидрокарбоната и других веществ, определяющих щелочной резерв.
Щелочной резерв определяют по методу Ван-Слайка, и выражают количеством выделившегося CO2 в мл на 100 мл плазмы. Количество выделившегося СО2 определяют разрушением H2CO3 более сильной кислотой. При этом выделяется CO2 в норме в %: у лошади 56-80, крупного рогатого скота – 50-67%. Резервную щелочность можно выражать также кислотной емкостью, т.е. количеством щелочи в мг, идущей на титрование избытка кислоты, которую добавляют к крови (расчет ведется на 100 мл крови, выражается в мг% щелочи). Кислотная емкость в мг% составляет в норме: у лошади – 420-640; коров – 540-600; овец – 440-540; свиней – 450-660.
Понижение щелочного резерва – ацидоз наблюдается при кетозах, сердечной недостаточности, рахите и т.д. Ацидоз может быть компенсированным, если нет изменений в рН крови. Если же кислот много и они не могут быть нейтрализованы буферными системами, то рН крови смещается в кислую сторону.
Алкалоз – наблюдается при повышенном содержании гидрокарбонатов, избыток которых выделяется с мочой: при рвоте, гипервентиляции легких, отравлении окисью углерода.
Неорганический фосфатный буфер имеет большое значение в клетках, а в крови занимает незначительное место, т.к. количество неорганических фосфатов крови составляет 3-4 мг%. Органические фосфаты играют большую роль в создании буферной емкости крови.
Буферное действие белков плазмы занимает 10%, гемоглобин эритроцитов обеспечивает 70% буферной емкости крови.
Действие гемоглобина как буфера тесно связано с его функцией в процессе дыхания. Гемоглобин не только выполняет роль переносчика кислорода, но и оказывает существенное влияние на связывание СО2 в тканях и выделение его в легких. Основное количество углекислоты переносится из тканей в легкие при участии катионов эритроцитов (калий), связанных с гемоглобином. Кроме того, углекислота может присоединяться к гемоглобину непосредственно через свободные аминогруппы при помощи карбаминовой связи, при этом образуется карбгемоглобин. Считают, что 15% СО2 переносится в легкие в виде карбгемоглобина.
