
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Строение ферментов
Ферменты относятся к простыме и сложныме белкам. Ферменты однокомпонентные – простые белки. К ним относятся гидролитические ферменты – пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др.
Ферменты двухкомпонентные (сложные белки) – кроме белкового компонента, содержат небелковый компонент – кофермент, белковая часть называется апоферментом, а все вместе называется холоферментом.
Кофермент может быть связан с белковой частью ковалентной связью, но могут быть и слабые связи – водородные, электростатические взаимодействия и др.
В случаях слабой связи между коферментом и белковой частью при выделении может происходить диссоциация – отделение небелковой части и изолированный белковый компонент оказывается лишенной ферментативной активности. Такими коферментами являются витамины B1 – тиамин, B2 – рибофлавин, B6 – пиридоксол, PP – никотинамид и другие. Ферменты, содержащие их, при выделении, очистке, как правило, теряют активность и лишь при добавлении кофактора вновь приобретают активность. Многие двухвалентные металлы (Mg2+, Mn2+, Ca2+) выполняют роль кофакторов, хотя их не относят к коферментам; в ряде случаев ионы металлов прочно связаны с белковой молекулой и выполняют функции простетической группы. Например: фермент, катализирующий окисление витамина С (аскорбиновой кислоты) в дезоксиаскорбиновую кислоту, содержит 8 атомов меди на молекулу. Все они прочно связаны с белковой молекулой, даже не обмениваются ионообменными смолами и не отделяются путем диализа. Доказано, что ионы меди принимают участие в переносе электронов.
Коферментами являются витамин PP (никотинамид), B2 (рибофлавин), пантотеновая кислота, фолиевая кислота, биотин (витамин H), B1 (тиамин), B6 (пиридоксин), B12 (цианкобаламин), витамин Q (убихинон); они связаны с нуклеотидами (НАД, НАДФ, ФМН, ФАД, KoA, ТДФ, ПФ и т.д.).
Кофакторами могут быть соединения, не являющиеся витаминами: HS -глутатион, АТФ, липоевая кислота, производные нуклеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат), порфиринсодержащие вещества и др. Сюда же могут быть отнесены т-РНК, которые в составе фермента аминоацил-т-РНК-синтетазы принимают участие в синтезе белка.
Следует подчеркнуть, что ни кофермент, ни апофермент в отдельности каталитической активностью не обладают. Лишь в виде комплекса они проявляют свою активность фермента.
Активный центр фермента
Молекула фермента, особенно у сложных ферментов, является очень крупной и при взаимодействии с субстратом в контакт входит лишь ее ограниченная часть – активный центр фермента. В активном центре фермента различают каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом и "контактную" (якорную) площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом (рис. 4.1.).
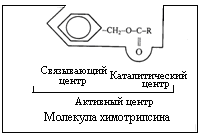
Рис.4.1. Образование фермент-субстратного комплекса.
Выявление химической природы и топографии групп активного центра является важной проблемой – необходимо определить первичную структуру и взаиморасположение аминокислот в активном центре. Для решения этого вопроса применяют различные приемы (ингибиторы, частичный гидролиз и т.д.).
Сейчас известно, что первичная структура активного центра определяется генетически, что реализуется при синтезе белка в рибосомах. Любое воздействие, связанное с денатурацией, приводит к нарушению активного центра и соответственно к потере ферментативной активности. Если удается восстановить третичную структуру фермента, то восстанавливается функция активного центра, что было доказано для рибонуклеазы поджелудочной железы.
Ферменты имеют 1,2 и более активных центра. Фермент уреаза имеет 3 активных центра, а холинэстераза – 20 активных центров. Активный центр состоит из 8-10 аминокислотных остатков, чаще всего в него входят серии, гистидин, тирозин, триптофан, глутаминовая кислота.
В молекуле фермента различают также аллостерический центр (греч. аллос – другой, стериос – пространственный). Ферменты, активность которых контролируется состоянием как активного, так и аллостерического центра, получили название аллостерических ферментов, их называют также регуляторными ферментами.
Ферменты, имеют множественные молекулярные формы, которые называют изоферменты и гетероферменты.
Изоферментами (изоэнзимами) называют белки, обладающие ферментативной активностью и катализирующие одну и ту же реакцию. Они встречаются у одного и того же вида, но отличаются между собой физико-химическими свойствами. Некоторые из них различаются между собой сродством к субстрату, коферменту и ингибитору. Например, лактатдегидрогеназа (ЛДГ) осуществляет превращение молочной и пировиноградной кислот, имеет Мм 140000 Да, ее молекула состоит из четырех субъединиц. Различают ЛДГ-1, содержащийся в мышечной ткани сердца, и ЛДГ-2 в мышечной ткани скелета; они различаются по электрофоретической подвижности.
Гетероферментами называют каталитические молекулы белков, различающиеся по размерам молекул. Ферменты, выполняющие одинаковые функции, могут встречаться в различных формах не только у различных животных, у различных органов одного и того же животного, но и в разных частях клетки.
Изоферментам принадлежит роль в регуляции отдельных звеньев обмена веществ. Например: изофермент лактатдегидрогеназы из сердечной мышцы (ЛДГ-1) резко тормозится пируватом, а скелетной мышцы – ЛДГ-2- менее чувствителен к нему.
