
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Структура белковой молекулы
Способы связи аминокислот в белковой молекуле
Основной структурной единицей белка являются α-аминокислоты.
Впервые, еще в 1888 г. А.Я.Данилевский установил, что аминокислоты в белковой молекуле соединяются -COOH и -NH2 группами, образуя связи, в последующем названные пептидными связями. Пептидная связь образуется при взаимодействии карбоксильной группы первой аминокислоты с аминогруппой при α-углероде второй аминокислоты. При этом отщепляется молекула воды: например, из двух молекул аланина образуется дипептид аланил-аланин:
![]()
Соединение из двух аминокислот называют дипептидом, из трех – трипептидом и т.д. Связь –CO-NH- называется пептидной связью.
Если число аминокислотных остатков больше 10, то называют полипептидом, свыше 50 – белками. Различают N-конец, где имеется свободная -NH2 группа и С-конец пептида, где свободная -COOH группа аминокислоты. Кроме -COOH и -NH2 групп, участвующих в образовании пептидной связи, аминокислоты содержат другие функциональные группы, размещенные в боковых ответвлениях белковой молекулы:
|
-COOH |
аспарагиновой и глутаминовой кислот |
|
-NH2 |
лизина, оксилизина, |
|
|
гуанидиловая группа аргинина |
|
|
имидазольная группа гистидина |
|
-ОН |
серина и треонина |
|
|
фенольная группа тирозина |
|
-SH |
сульфгидрильная группа цистеина |
|
-S—S - |
цистина |
|
-S-CH3 |
тиоэфирная группа метионина |
|
|
бензольное кольцо фенилаланина |
|
|
алифатические цепи других аминокислот и т.д. |
Группу атомов в молекулах аминокислот, не принимающих участие в образовании пептидной связи, называют радикалами аминокислот. Различают аминокислоты с ионами-радикалами. К этой группе относятся 7 аминокислот с радикалами, обладающими отрицательными или положительными зарядами, в т.ч. аспарагиновая и глутаминовая кислоты с "-" зарядом, тирозин и цистеин также могут нести "-" заряд; лизин, аргинин и гистидин несут "+" заряд.
Полярные радикалы имеют серии и треонин (-ОН). Сюда же относятся аспарагин, глутамин. Третья группа аминокислот имеет неполярные алифатические или ароматические радикалы (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин, оксипролин). Таким образом, в построении структуры белковой молекулы кроме образования пептидной связи имеют значение свойства радикалов аминокислот.
Пептиды - имеют Мм до 5000 дальтон (50 аминокислотных остатка), проходят через полупроницаемую мембрану. В природе известно свыше 200 пептидов, в том числе в организме животных и человека различают:
1.Пептиды-гормоны: вазопрессин, окситоцин, кортикотропин, глюкагон, кальцитонин, меланостимулирующий гормон.
2.Пептиды, принимающие участие в пищеварении, – гастрин, секретин – всего 12 пептидов.
З.Ангиотензин (сосудосуживающий), брадикинин.
4.Нейропептиды.
5.Пролинсодержащие ди- и трипептиды, образующиеся из коллагена и эластина путем гидролиза, обладающие антикоагулянтным действием, защищающие слизистую оболочку желудка.
б.Низкомолекулярные (Мм 4 кДа) пептиды, обуславливающие устойчивость животных к разным инфекциям, обладающие широким спектром антимикробной активности.
Существуют пептиды, полученные путем синтеза. Например, синтетическая пептидная вакцина против ящура получена из 16-ти аминокислотных остатков. Небелковая часть фермента окислительно-восстановительных реакций является трипептидом: это глутатион (γ-глутамил-цистеинил-глицин):
![]()
Карнозин: β-аланил-гистидин и ансерин – метил-карнозин являются дипептидами: они усиливают мышечные сокращения, обладают антиоксидантными и мембраностабилизирующими свойствами. Пептиды из глицина и пролина влияют на свертывание крови, защищают слизистую оболочку желудка, влияют на головной мозг. Пептиды эндотелины регулируют тонус сосудов.
Дипептид аспартам (аспарагин + фенилаланин) получают методом генной инженерии. Он в 300 раз слаще сахара, его добавляют в напитки вместо сахара (кока-кола).
Различают 4 уровня структуры белковой молекулы.
Первичная структура белка – это последовательность (чередование) аминокислотных остатков в пептидной цепи. В образовании этой структуры участвуют пептидные связи, частично дисульфидные. Первичная структура закодирована в генах, она определяет остальные уровни организации белка. Впервые первичная структура белка инсулина была определена Сэнджером (1953 г.). Сейчас изучена первичная структура большого числа белков. Например, молекула инсулина состоит из двух частей: А-21, В-30 аминокислотных остатков.
Строение его можно представить в следующем виде:
 асп.
COOH
А цепь (21 аминокислотный остаток)
асп.
COOH
А цепь (21 аминокислотный остаток)
..... COOH В цепь (30 аминокислотных остатков)
Между цепями А и В и внутри А-цепи возникают дисульфидные связи. Первичная структура РНКазы из 124 аминокислотных остатков показана на рис. 2.2.
Исследование первичной структуры гемоглобина позволило установить, что серповидная анемия (рис.2.3.) – болезнь крови – обусловлена заменой лишь одной единственной аминокислоты в В цепи из 146 аминокислотных остатков.
Если в 6-положениии от N-конца находится валин вместо глутаминовой кислоты, то такой гемоглобин не выполняет функцию транспорта кислорода:
4 5 6 7 - положение аминокислот
- тре - про - глу - лиз - норма
- тре - про - вал - лиз - патология
Вторичная структура белка – это способ укладки полипептидной цепи в спиральную конфигурацию. Эта укладка происходит по программе, заложенной в первичной структуре.

Рис 2.2. Первичная структура РНКазы. Цветом выделены четыре дисульфидные связи.
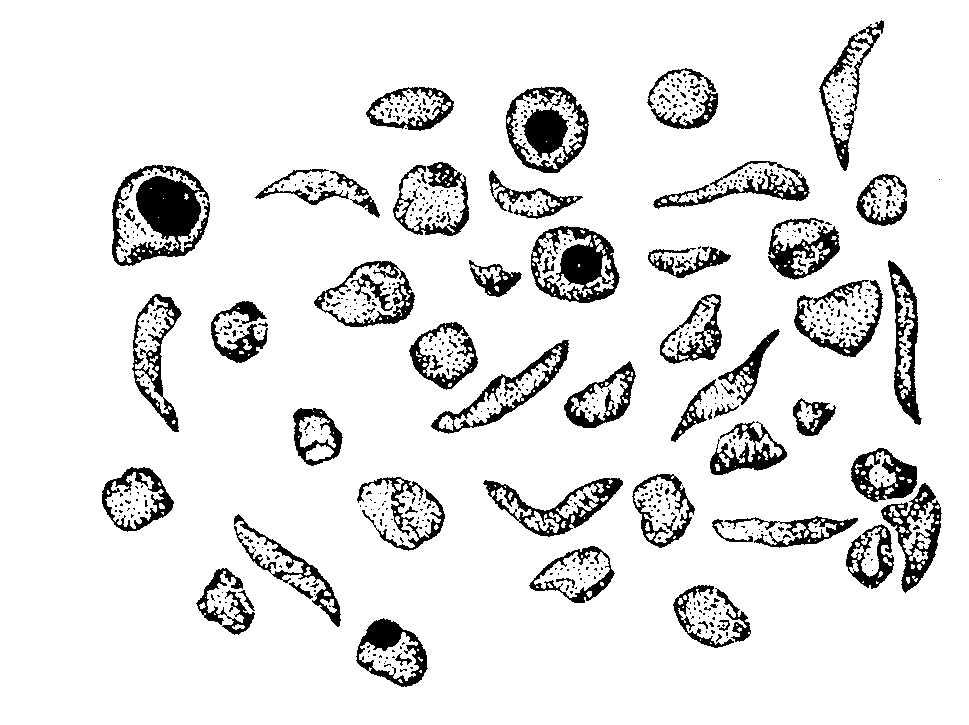
Рис 2.3.Нормальные и серповидные эритроциты
Полинг и Кори установили, что глобулярные белки образуют α-спираль за счет водородных связей между радикалами аминокислот. Водородная связь возникает за счет карбонильной группы одного радикала и аминной группы другого радикала, между атомами кислорода и водорода, азота и водорода:
![]()
Карбонильная группа и NH-группа способны образовывать водородную связь между собой. Атомы кислорода и водорода пептидной группы занимают транс-положение, а вокруг - CH возможно свободное вращение:

В результате этого образование водородных связей обуславливает определенную форму пептида. Различают три типа вторичной структуры пептидных цепей: α-спираль, β-структура (складчатый слой), беспорядочный клубок.
α-спираль – это виток по часовой стрелке (рис.2.4).
Каждый виток содержит 3,6 аминокислот 5,4 А (1,5 А на 1 аминокислоту), через каждые 5 витков (18 аминокислотных остатков) структурная конфигурация повторяется, α-спиральную структуру имеют фибриллярные белки – кератины волос, шерсти, кожи, где -S-S- связи придают высокую прочность.
В складчатом слое (β-структура) пептидные цепи расположены параллельно друг другу в один слой, образуя фигуру гармошки или листа. Слой может быть образован двумя или большим числом пептидов.
Домены представляют собой надвторичную структуру (рис.2.5).
Водородная связь может образоваться не только между карбонильной группой (отрицательный заряд кислорода) и атомом водорода иминогруппы =NH другой полипептидной цепи, но и между двумя гидроксильными группами
![]()
и гидроксильной группой серина и тирозина.
Вторичная структура коллагена. Количество коллагена в организме составляет 1/3 (сухожилия, связки, суставные капсулы и т.д.) от общего количества белков.
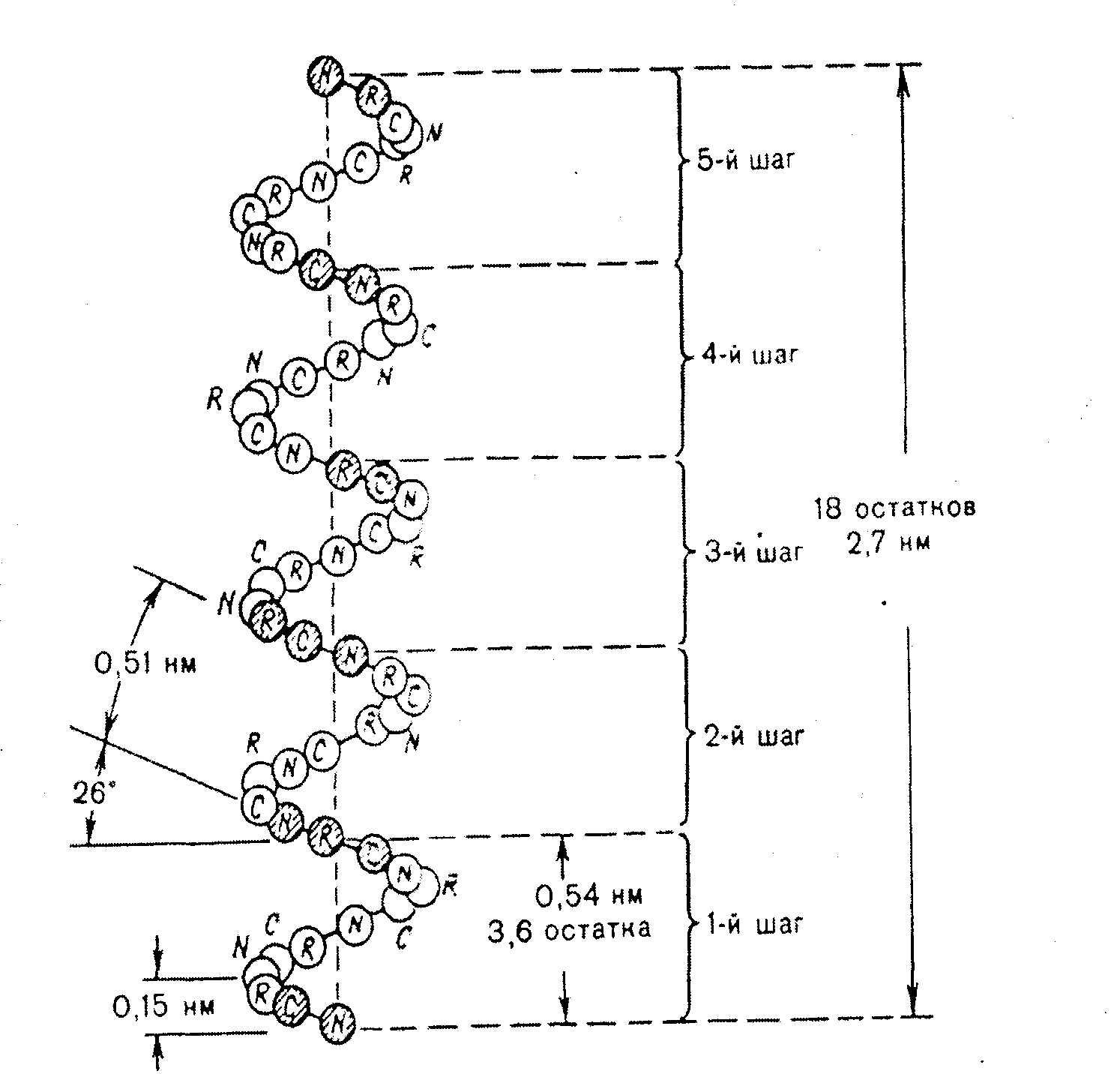
Рис. 2.4. Структура и параметры α-спирали.
В отличие от α- спирали кератинов коллаген плохо поддается растяжению. В составе коллагена много глицина - 1/3 из общего количества аминокислотных остатков, 1/4 и более составляют пролин и оксипролин. Эти аминокислоты нарушают способность полипептидных цепей образовывать α-спираль. В коллагене каждые 3 полипептидные цепи скручены и образуют тройную спираль.
Третичная структура белка. Это пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
Первый белок, третичная структура которого была выяснена англичанином Дж. Кендрью. Это миоглобин кашалота, молекулярная масса 16700 Да, содержит 153 аминокислотных остатка. Имеет одну полипептидную цепь. Полипептидная цепь представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелкового компонента, содержащего железо).
В настоящее время благодаря повышению эффективности рентгеноструктурного анализа расшифрована третичная структура многих белков.

Складчатый слой Домены
Рис. 2.5. Схема складчатого слоя и доменов.
Некоторые типы связей, стабилизирующих третичную структуру представлены на рис.2.6. пептид
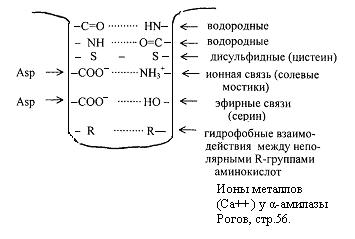
Рис.2.6. Связи, стабилизирующие вторичную и третичную структуру.
Третичная структура обеспечивается за счет пептидных и дисульфидных связей, но основную роль играют нековалентные связи – водородные, межмолекулярные силы Ван-дер-Ваальса-Лондона, гидрофобные взаимодействия и т.д.
Третичная структура белка возникает после завершения синтеза его на рибосомах, автоматически. Она определена первичной структурой – последовательностью аминокислотных остатков в полипептидной цепи. Третичная структура связана с биологической активностью белковой молекулы (каталитической, гормональной, антигенной и т.д.). Любые физико-химические воздействия, приводящие к разрыву водородных связей, а также других некоторых связей, и тем самым разрушающие нативную конформацию молекулы, сопровождаются частичной или полной потерей белком его биологических свойств (рис. 2.7.).
Четвертичная структура белка. Это укладка в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной и третичной структурой, и формирование единого макромолекулярного образования. Каждая отдельная полипептидная цепь (протомер) чаще всего не обладает биологической активностью. Эту способность биологическая молекула приобретает при определенном способе пространственного объединения входящих в его состав протомеров, при этом образуется мультимер.

Рис.2.7. Денатурация и ренатурация рибонуклеазы (по Анфинсену).
а - развертывание (мочевина + меркаптоэтанол);
б - повторное свертывание
Например, молекула гемоглобина состоит из α- и β- субчастиц, каждая из которых состоит из двух полипептидных цепей. Каждая из 4-х полипептидов окружает группу гема, содержащего атом двухвалентного железа. При определенных условиях в присутствии солей, мочевины, изменении рН, молекул; гемоглобина обратимо диссоциирует на 2 α- и 2 β-цепи, что связано с разрывом водородных связей. После удаления солей, мочевины при изменения рН происходит автоматическое восстановление исходной молекулы (рис.2.8).

Рис.2.8. Обратимая диссоциация молекулы гемоглобина.
Белок вируса табачной мозаики имеет гигантскую молекулу с молекулярной массой около 40 х10б Да, вирус состоит из 1 молекулы РНК и 2130 белковых субъединиц с молекулярной массой каждой 17500 Да. Вокруг РНК расположены белковые субъединицы, образующие спиральную структуру, которая имеет 130 витков. После добавления детергентов РНК может быть удалена; что самое удивительное - вирусная частица вновь может быть собрана автоматически после удаления детергентов. При этом восстанавливаются и биологические свойства вируса инфекционность, антигенная активность и т.д. (рис. 2.9.).
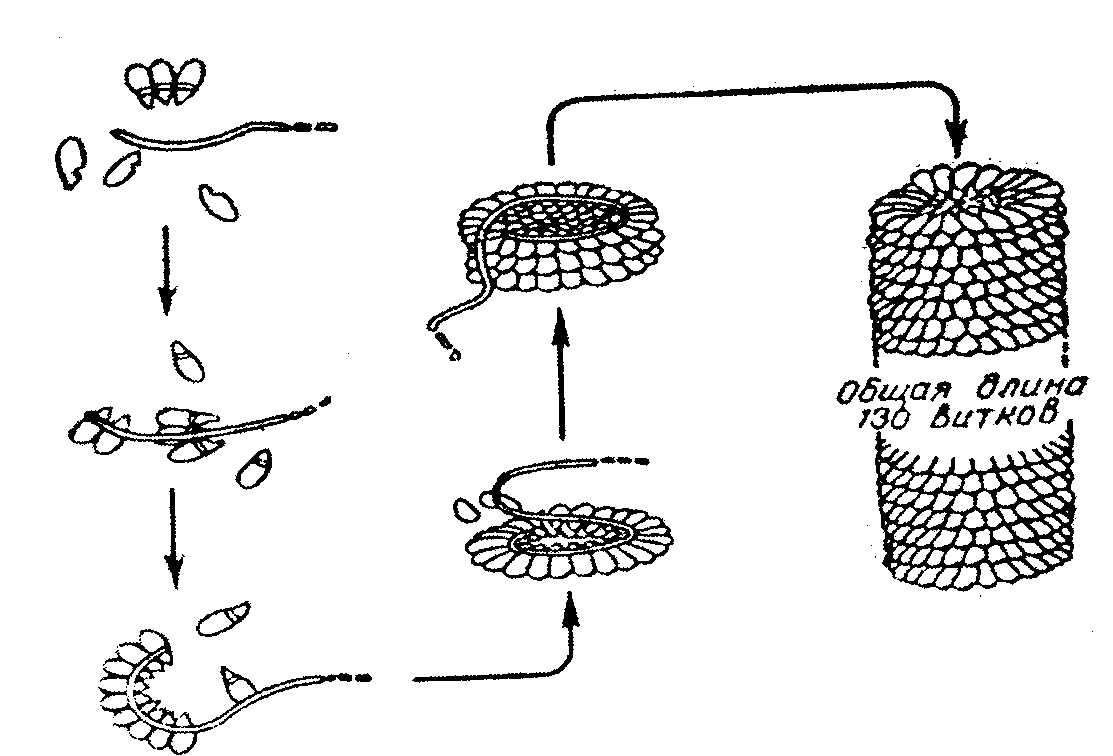
Рис. 2.9. Самосборка вируса табачной мозаики.
Микротрубочки имеются во всех клетках. Постоянно то распадаются, то вновь образуются, принимают участие во внутриклеточном транспорте веществ, в движении хромосом при делении клеток. Они построены из тубулина, который состоит из двух пептидов с Мм 111500 Да. Их можно выделить из клеток; под действием Mg 2+ образуются микротрубочки.
Рибосомы, клеточные мембраны также образованы из нескольких полипептидов (протомеров), которые взаимно укладываются и создают четвертичную структуру.
В середине 80-х годов было обнаружено, что в клетке существует особая категория белков, основной функцией которых является обеспечение правильного характера сворачивания полипептидных цепей в нативную структуру. Эти белки получили название "молекулярные шапероны". Они состоят из полипептидов, организованных в два семичленные кольца, лежащих одно под другим. В центре построенного таким образом цилиндра имеется полость – канал (диаметром 45 ангстрем), в котором происходит сворачивание полипептидной цепи. Кроме того, в укладке белковой молекулы участвуют ферменты фольдазы, катализирующие образование дисульфидных связей и изомерные превращения некоторых стабильных транс-пептидил-пролильных связей в цис-конфигурацию, необходимую для функциональной активности.
