
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Активная реакция водных растворов
Под активной реакцией среды понимают концентрацию водородных ионов. В числе различных физико-химических защитных констант организма таких, как изотермия, изотония и другие постоянство концентрации водородных ионов – изогидрия – имеет особо важное значение для биологических процессов организма. Физико-химическое состояние белков, каталитическая функция ферментов, активность солевых ионов зависят от концентрации ионов водорода.
Ионное произведение воды. Водородный показатель
Точные измерения показывают, что чистая дистиллированная вода в незначительной степени электропроводна. Следовательно, вода в некоторой степени диссоцирована, что можно представить уравнением:
![]()
Для обратимых процессов константа диссоциаций (К) выражается уравнением:
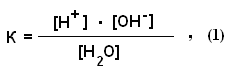
где [Н+ и [OH-] - концентрации ионов Н+ и ОН- при установившемся равновесии диссоциированных и недиссоциированных: молекул воды. Выражается эта концентрация в г-ионах на литр (г-ион/л), 1 г-ион Н+ = I г, I г-ион ОН- = 17 г. [Н2О] - равновесная концентрация недиссоцированных молекул воды, моль/л.
Принимая во внимание, что из 555 млн. молекул воды диссоцирует только одна, можно допустить, что концентрация недиссоцированных молекул воды практически равна общей концентрации воды.
Концентрация воды определяется количеством г-молей воды в I л. Таким образом, зная значения К и [H2O], из уравнения I можно определить величину произведения |Н+] и [OH-]:
|Н+].[OH-] = К . [H2O] = 1,8.10-16 . 55,56 = 1 . 10-14, т.е.
|Н+].[OH-] = 10-14 (2)
Произведение концентрации ионов водорода и ионов гидроксида для воды при постоянной температуре есть величина постоянная и называется ионным произведением воды.
Таким образом, связанные между собой концентрации гидроксид-ионов и ионов водорода являются величинами сопряженными. Следовательно, если добавлением кислоты увеличить концентрацию ионов водорода, то одновременно во столько же раз уменьшится концентрация гидроксид-ионов. Следовательно, по концентрации ионов водорода можно судить о характере среды:
|Н+]= [OH-] = 10-7 - среда нейтральная;
|Н+] > [OH-] > 10-7 - среда кислая;
|Н+] < [OH-] < 10-7 - среда щелочная.
Следует отметить, что характеризовать кислотностъ и щелочность раствора числами с отрицательными показателями степени очень неудобно. Поэтому степень кислотности растворов принято выражать не концентрацией ионов Н+, а ее десятичным логарифмом, взятым с обратным знаком. Эту величину называют водородным показателем и обозначают через рН:
рН = -lg |Н+] (3)
Следовательно, диапазон концентраций ионов водорода, выраженных через рН, будет представлен рядом натуральных чисел по схеме:
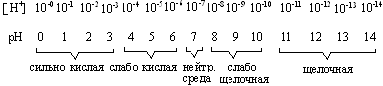
Рис. 1.2. Диапазон концентраций ионов водорода и значений
рН среды
При переводе сН+ в рН следует пользоваться таблицами логарифмов.
Методы определения рН среды
Кислотность среды оценивают рН-метрией. Один из способов определения рН основан на способности некоторых веществ, называемых индикаторами, изменять свою окраску в зависимости от рН среды. Каждый индикатор характеризуется определенным интервалом перехода окраски. Так, фенолфталеин меняет свою окраску от бесцветной до красной в пределах рН 8,2-10,0, а метилоранж – в пределах 3,1-4,4.
Методы определения рН среды, основанные на изменении окраски индикаторов, называют колориметрическими. В настоящее время чаще всего используют универсальные индикаторы. Это смесь обычных индикаторов, изменяющая окраску в пределах рН от 2,0 до 10.
При определении рН раствора универсальным индикатором каплю индикатора вносят в исследуемый раствор. Появившуюся окраску сравнивают с прилагаемым к индикатору спектром цветов, соответствующих определенным значениям рН. Точность измерения pН среды колориметрическим методом ± 0,1. В качестве индикатора может служить и бумага, пропитанная индикатором (бумажные индикаторы).
Другим более точным методом определения рН является электрометрический метод, для определения концентраций водородных ионов в растворе злектрометрическим методом используются гальванические элементы, составленные из двух электродов – электрода сравнения с устойчивым и известным потенциалом и индикаторного (электрода измерения), потенциал которого зависит от концентрации ионов Н+в растворе. В качестве электродов сравнения часто применяют водородный, хингидронный, сурьмяный и стеклянный электроды. Стеклянный электрод хорошо работает в агрессивных средах, потенциал его быстро устанавливается.
Электродвижущая сила гальванического элемента может измеряться либо включением в цепь вольтметра, либо компенсационным методом. На практике пользуются только вторым из указанных методов. Сущность его состоит в том, что э.д.с. исследуемого гальванического элемента уравновешивается разностью потенциалов, которая получается на части реохорда компенсационной установки, питаемой двухвольтовым аккумулятором. Оба элемента присоединяются друг к другу одноименными полюсами.
