
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Физико-химические свойства белков
Молекулярная масса белков колеблется в широких пределах: от нескольких тысяч дальтон (инсулин – 5700) до сотен миллионов (белок вируса гриппа – 322∙106). Форма белковых молекул бывает глобулярная (шаровидная) и фибриллярная (нитевидная), рис.2.1.
Форма белковых молекул изменяется под влиянием различных факторов: рН, температуры среды, ионной силы, природы растворителя, концентрации раствора.

Рис. 2.1. Глобулярные и фибриллярные белки.
А. В глобулярных белках полипептидная цепь свернута так, что образуется компактная структура. Эти белки обычно растворимы в водной среде.
Б. В кератине, фибриллярном белке шерсти, полипептидные цепи вытянуты вдоль одной оси. На рисунке показаны три молекулы кератина, навитые одна на другую наподобие каната. Фибриллярные белки нерастворимы в воде.
Большинство белков растворяется в воде. Они образуют лиофильные коллоидные растворы. Молекулы белков имеют большие размеры и не проходят через поры полупроницаемых мембран.
Молекулярно-кинетические свойства коллоидных растворов белков связаны с размерами и перемещением мицелл в среде, рН раствора и т.д. Белки имеют низкий коэффициент диффузии, низкое осмотическое давление, высокую относительную вязкость и большую степень набухания – белки связывают до 80-90% всей воды организма.
Вода обеспечивает формирование структуры белков. Общее количество связанной воды составляет в миоглобине, лизоциме, цитохроме около 22% от общей массы белка. Под влиянием различных факторов белки могут выпадать из коллоидных растворов в осадок (коагулировать); это легче происходит в изоэлектрической точке белка.
Коагуляция бывает обратимая, когда нарушается в коллоидной частице только сольватная оболочка и необратимая, когда произошли глубокие нарушения структуры белковой молекулы. Необратимую коагуляцию называют денатурацией. Она вызывается кипячением, действием солей тяжелых металлов, алкалоидов, минеральных кислот и т.д.
Кислотно-щелочные свойства белков связаны с катионообразующими (-NH3+) и анионобразующими (-COO-) группами. Суммарный заряд молекулы можно представить как:
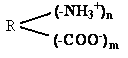
Знак заряда зависит от соотношения аминных и карбоксильных групп, соответственно различают белки кислые, нейтральные и щелочные (основные).
Аминокислоты
Для изучения аминокислотного состава белков пользуются кислотным (HCl), щелочным (NaOH) и ферментативным гидролизом. При гидролизе чистого белка высвобождается до 20 различных α-аминокислот. Все другие аминокислоты, открытые в тканях животных, растений и микроорганизмов, их свыше 200, существуют в свободном состоянии или же в составе коротких пептидов или комплексов с другими органическими веществами.
Способы получения аминокислот:
1.Гидролиз из соответствующих белков.
2.Методом химического синтеза, в том числе с использованием иммобилизованных ферментов.
3.Методом микробиологического синтеза. Таким способом производят аминокислоты для нужд животноводства, – это многотоннажный промышленный способ.
α-аминокислоты представляют собой производные карбоновых кислот, у которых один атом водорода, у α-углерода замещен на аминогруппу (-NH2):
![]()
жирная кислота α-аминокислота
Все аминокислоты, входящие в состав природных белков, являются α-аминокислотами.
Общим свойством аминокислот является их амфотерность, т.е. каждая из них содержит, как минимум, одну кислую и одну основную группу (исключение составляет пролин и его производное гидроксипролин, являющиеся иминокислотами).
Общий тип строения α-аминокислот может быть представлен в виде следующей формулы:

Аминокислоты отличаются друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка.
Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковой молекулы связано с химической природой и физико-химическими свойствами радикалов аминокислот.
Все аминокислоты – бесцветные кристаллические вещества, на вкус сладковатые или кисло-сладкие.
Большинство аминокислот хорошо растворимо в воде. В тканях организма, в клетках, в крови среда слабощелочная – рН 7,3, поэтому карбоксильные группы находятся в форме R-COO- , а аминные – в форме R-NH3+ (в протонированной форме), поэтому правильная ионная форма аминокислоты:
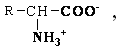
то есть амфиона (цвитериона) (в пределах рН 4-9).
Аминокислоты в виде недиссоциированных молекул:

т.е. в неионизированной форме приводятся для удобства восприятия. В кислой среде аминогруппа присоединяет протон, получает положительный заряд и под действием электрического тока движется к катоду:

В щелочной среде аминокислота ведет себя как кислота и диссоциирует по такой схеме:

В этом случае при пропускании тока через раствор ионизированная молекула аминокислоты движется к аноду.
Для каждой аминокислоты существует своя изоэлектрическая точка (ИЭТ), т.е. такое состояние, при котором сумма положительных зарядов равна сумме отрицательных зарядов и под действием электрического тока аминокислота не движется ни к аноду, ни к катоду. Для моноаминомонокарбоновых кислот ИЭТ будет близка к реакции нейтральной среды, моноаминодикарбоновых - к кислой и диаминомонокарбоновых – к щелочной.
Для определения количественного содержания аминокислот важное значение имеют следующие методы:
1. Формольное титрование – оно основано на способности формальдегида реагировать с аминогруппой в результате чего аминокислота превращается в основание Шиффа. В этой реакции аминогруппа аминокислоты блокируется остатком формальдегида, а карбоксильная группа не затрагивается и может быть оттитрована щелочью:

2. Реакция с азотистой кислотой – при действии азотистой кислоты аминогруппа разрушается, при этом выделяющийся азот собирают и по его количеству рассчитывают содержание аминокислоты (метод Ван-Слайка) - газометрический метод:

диазосоединение оксикислота
3. Нингидриновый метод определения широко применяется:
а) при хроматографическом разделении аминокислот на бумаге;
б) в автоматических анализаторах аминокислот;
в) для определения аминного азота.
4. Существуют реакции для обнаружения и полуколичественного определения аминокислот:
• реакция Миллона (тирозин);
• ксантопротеиновая реакция (фенилаланин, тирозин)
• реакция Сакагучи (аргинин).
Аминокислоты природных белков (кроме глицина) обладают оптической активностью, т.е. способностью вращать плоскость поляризованного света. Различают D- и L-формы аминокислот, например:

D (-) - Аланин L (+) - Аланин
Все природные белковые аминокислоты относятся к L-ряду. Лишь в белках некоторых микроорганизмов встречаются некоторые D-аминокислоты (также в грибах, антибиотиках).
Аминокислоты D-ряда или совершенно не усваиваются организмом или же усваиваются плохо, т.к. ферментные системы животного организма специфически приспособлены к обмену L-аминокислот. Это важно при учете балансирования рациона животных по незаменимым аминокислотам синтетическими аналогами, которые, как правило, содержат в равных количествах L- и D- формы (рацематы).
Аминокислоты обозначают трехбуквенными символами, например: Алании Ала, Гистидин Гис, Аргинин Apr, и т.д. Кроме того, принято однобуквенное обозначение аминокислот; например, глицин - G, аланин - А, валин - V, лейцин - L и т.д.
Важным свойством аминокислот является их способность синтезироваться в тканях организма животных. Различают аминокислоты заменимые, которые могут синтезироваться в тканях животного организма и незаменимые, которые не могут синтезироваться в организме, а должны поступать с кормом.
