
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Регуляция активности ферментов
Аллостерическая регуляция сопровождается изменением сродства фермента к субстрату без изменения максимальной скорости реакции. Это очень распространенная и чувствительная регуляция.
Широко представлены такие коферменты как АМФ, АДФ, АТФ, НАД, НАДН, НАДФ, НАДФН, лимонная кислота, ацетил-KoA и ряд других, которые одновременно являются субстратами, продуктами и регуляторами ферментативных реакций.
Регуляция активности ферментов происходит также ковалентной модификацией. Открытие этого пути – важнейшее достижение биохимии. Активирование и ингибирование активности ферментов фосфорилированием их киназами, участие циклической АТФ в процессах действия гормонов, наличие специфических рецепторов гормонов в мембранах клеток – все это является новым этапом в изучении регуляции обмена веществ.
Общая схема регуляции при этом заключаются в следующем: циклический АМФ (ц-АМФ) присоединяется к регуляторной субъединице, что ведет к освобождению его активной каталитической субъединицы, то есть концентрация ц-АМФ, его образование под влиянием циклазы и расщепление под влиянием фосфодиэстеразы лежат в основе регуляции целого ряда путей обмена веществ. Фосфорилирование также является распространенным механизмом регулирования активности ферментов обмена веществ.
Гормональная регуляция активности ферментов заключается в том, что имеется связь между влиянием гормонов на процессы транскрипции и модификацией негистоновых белков ядра. Гормоны могут выступать как эффекторы (сенсорные участки) ДНК и т.д.
Нервная регуляция активности ферментов изучается давно (обмен веществ). На животных с перерезкой нервов доказано, что при этом ряд ферментов мышечной ткани меняет свои свойства.
Механизм действия ферментов
Проблемы структуры и функции ферментов, вопросы механизма их действия являются предметом изучения ведущих лабораторий мира. Повышение скорости реакции под действием ферментов объясняют тем, что при ферментативном катализе фермент соединяется (в принципе обратимо) со своим субстратом, образуя нестойкий промежуточный ферментсубстратный комплекс, который в конце реакции распадается с освобождением фермента и продуктов реакции (Арни, Михаэлис, Ментен, 1910-1915 гг.). Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации субстрата на скорость реакции.
В процессе реакции различают следующие стадии:
1. Присоединение молекулы субстрата к ферменту.
2. Преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов.
3. Отделение конечных продуктов реакции от фермента.
![]()
Пример:
E - фермент
S – субстрат
P - продукт
В реакциях анаболизма, допустимА+В
AB,
фермент может соединяться как с одним,
так и с другим субстратом или обоими
субстратами:
реакциях анаболизма, допустимА+В
AB,
фермент может соединяться как с одним,
так и с другим субстратом или обоими
субстратами:
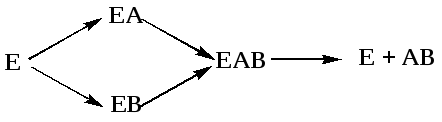
В
 реакциях катаболизма, допустим:AB
А+В
реакциях катаболизма, допустим:AB
А+В
а )АВ+Е
АВЕ
)АВ+Е
АВЕ
б
 )ABE
А+ВЕ
(а+б+в)
АВ+Е
А
+ В E
)ABE
А+ВЕ
(а+б+в)
АВ+Е
А
+ В E
в )BE
В+Е
)BE
В+Е
Схема образования промежуточного фермент-субстратного комплекса представлена на рисунке 4.2. Если фермент в активном центре содержит кофермент, то образуется тройной комплекс (рис.4.2.).
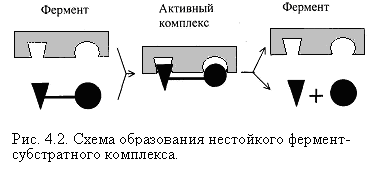
Фермент вступает во взаимодействие с субстратом на очень короткий период. Существование такого комплекса получило доказательство лишь в последние годы. В образовании фермент-субстратного комплекса участвуют водородные связи, электростатические и гидрофобные взаимодействия, а также, в ряде случаев, ковалентные, координационные связи. Информация о природе связей может быть получена методами электронного парамагнитного резонанса (ЭПР), ядерного магнитного резонанса (ЯМР), ультрафиолетовой и инфракрасной спектроскопии. Для каталитической активности существенное значение имеет пространственная структура ферментного белка, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. В каталитическом процессе существенное значение имеют точное соответствие между ферментом и субстратом, а также термодинамические и каталитические преимущества подобного соответствия. Это означает, что между ферментом и субстратом должна быть не только пространственная или геометрическая комплементарность, но и электростатическая – спаривание противоположных зарядов (групп) субстрата и активного центра фермента.
Таким образом, в механизме ферментативного катализа ведущую роль играют промежуточные фермент-субстратные комплексы, образование которых определяется тонкой структурой активного и эффекторного центров и уникальной структурой всей молекулы фермента, обеспечивающими высокую каталитическую активность и специфичность действия биокатализаторов.
Кинетика ферментативных реакций зависит от природы реагирующих веществ – фермента, субстрата и условий их взаимодействия – концентрации, рН среды, температуры, присутствия активаторов или ингибиторов.
