
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Основные свойства ферментов
К ферментам применимы три основных критерия, характерных для неорганических катализаторов:
1) они остаются относительно неизменными после реакции, то есть освобождаются вновь и могут реагировать с новыми молекулами субстрата;
2) ферменты оказывают свое действие в ничтожно малых концентрациях;
Например: 1 молекула реннина (содержится в слизистой оболочке желудка теленка) створаживает около 106 молекул казеиногена молока за 10 минут при 37 0C;
3) наличие фермента (катализатора) не оказывает влияния как на величину константы равновесия, так и на изменения свободной энергии. Катализаторы лишь повышают скорость реакций (точку равновесия не сдвигают).
1. Термолабильность ферментов. Скорость химической реакции зависит от температуры. Реакции, катализируемые ферментами, так же чувствительны к изменениям температуры. Скорость химической реакции повышается в два раза при повышении температуры на 10 0C. Ускорение реакции идет до 45 0C, затем, в связи с денатурацией белка-фермента, снижается. При 100 0C почти все ферменты полностью утрачивают свою активность.
Оптимальной температурой для ферментов теплокровных является 37-40 0C. При низких температурах (0° и ниже) ферменты не разрушаются, не денатурируют, но активность их снижается до нуля рис. 4.3.).
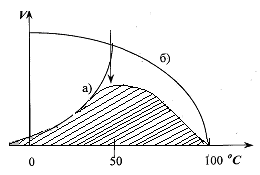
Рис.4.3. Влияние температуры на скорость катализируемой ферментом реакции.
а - повышение скорости реакции как функция температуры;
б - понижение скорости реакции как функция денатурации белка-фермента; стрелка (→) указывает оптимум температуры.
2. Зависимость активности ферментов от рН среды.
Ферменты обычно активны в узких пределах значений рН, как правило, рН 6,0-8,0. Каждый фермент имеет свой оптимум рН. рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключением является пепсин, рН-оптимум которого – 2,0. Объясняется это функцией пепсина, т.к. в желудочном соке содержится свободная соляная кислота, создающая кислое значение рН.
Влияние изменений рН среды на активность фермента заключается в том, что изменяется степень ионизации кислотных и основных групп (-COOH, -SH, имидазольной, -NH2 и т.д.).
При разных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса (рис.4.4).
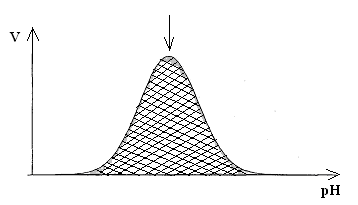
Рис.4.4. Влияние рН на скорость катализируемой ферментом реакции (стрелка указывает оптимум рН).
3. Специфичность ферментов. Ферменты обладают высокой специфичностью действия и этим существенно отличаются от неорганических катализаторов. Например: измельченная платина или палладий могут катализировать восстановление десятков соединений различной структуры. А фермент обычно проявляет свою активность только при полном соответствии активного центра и субстрата, только при «узнавании» обычно протекает одна высокоспецифичная реакция среди тысячи других химических реакций, осуществляемых в живой клетке. В зависимости от механизма действия различают ферменты с относительной или групповой и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов характерна относительная специфичность.
Например, пепсин расщепляет белки животного и растительного происхождения, хотя они могут отличаться по химическому строению, аминокислотному составу и физико-химическим свойствам. Однако пепсин не расщепляет жиры и углеводы; пепсин разрывает пептидную связь - СО–NH - между аминокислотами.
Липаза, катализирующая гидролиз жиров на глицерин и жирные кислоты, разрывает сложноэфирные связи. Аналогично групповой специфичностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидролизирующие α-гликозидные связи в полисахаридах. Указанные ферменты пищеварительные, их групповая специфичность имеет биологический смысл.
Абсолютная специфичность – это способность фермента катализировать превращение только единственного субстрата. Например: аргиназа, расщепляющая в организме аргинин; уреаза, катализирующая распад мочевины и др.
Стереохимическая специфичность: оксидазы (аминокислот) действуют только на свой специфический стереоизомер – L- или D-аминокислот. Специфичностью обладают также ферменты, катализирующие синтетические реакции.
