
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме
РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
 Краткие теоретические сведения
Краткие теоретические сведения
Практически все клеточные метаболические реакции протекают с участием белков-ферментов. Ферменты — это биологические катализаторы белковой природы, которые контролируют все химические процессы, протекающие в живых организмах. В отличие от небелковых катализаторов каждый фермент способен катализировать лишь очень небольшое число реакций, часто только одну. Как и все белки, ферменты – это биополимеры, состоящие из остатков аминокислот.
Образование фермент-субстратного комплекса – необходимое условие ферментативной реакции. Конечным этапом ферментативной реакции является освобождение фермента от продукта. Свободный фермент может вновь вступить во взаимодействие с очередной молекулой субстрата. Превращение субстрата в продукт происходит в активном центре фермента.
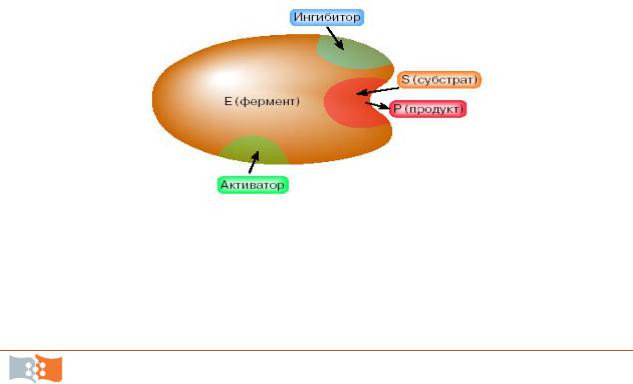
Активный центр фермента состоит из каталитического центра, ответственного за проведение химической трансформации, и субстратсвязывающего центра, призванного сорбировать субстрат на ферменте.
Молекула фермента может иметь специальные центры для увеличения активности катализа или ее снижения (рис. 9.1). Для изменения активности фермент должен связаться соответствующими центрами с молекулами ингибиторами или активаторами (эффекторами).
Рис. 9.1. Схематическое изображение взаимодействия фермента с субстратом и эффекторами
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
407 |
РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Ферменты функционируют лишь при определенной температуре, концентрации веществ, кислотности среды. Изменение условий приводит к изменению пространственной структуры белковой молекулы, при этом нарушается пространственная конфигурация активного центра и фермент теряет свою активность.
Ферментативная кинетика
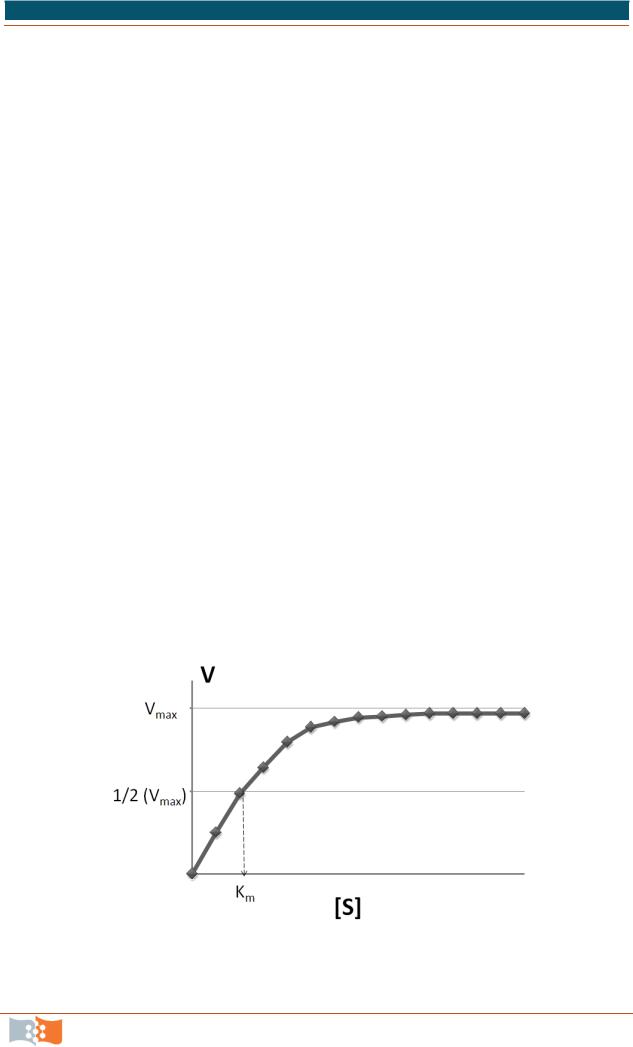
Первые эксперименты по изучению кинетики ферментативных реакций показали, что скорость реакции E + S→ E + P не зависит от концентрации фермента (Е) и субстрата (S) таким образом, как в случае обычной реакции второго порядка (рис. 9.2).
В 1913 г. Михаэлис и Ментен опубликовали свою теорию общего механизма ферментативных реакций:
k1 →
← |
(9.1) |
k2 |
|
E + S k−1 |
ES → E + P |
Они ввели понятие максимальной скорости и показали, что кривая насыщения, то есть зависимость скорости реакции от концентрации субстрата, является равнобочной гиперболой. Михаэлис и Ментен предположили, что скорость реакции определяется распадом комплекса ES, то есть константой
k2 . Это возможно только при условии, что k2 - наименьшая из констант.
Рис. 9.2. Гиперболическая зависимость начальных скоростей катализируемой ферментом реакции от концентрации субстрата
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
408 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
В этом случае равновесие между фермент-субстратным комплексом, свободным ферментом и субстратом устанавливается быстро по сравнению со скоростью реакции.
v0 =Vmax [S] |
(Ks +[S]) |
(9.2) |
|
|
– константа диссоциации фермент-субстратного комплекса,
Ks = k−1 |
(9.3) |
|
k1 |
Классическое уравнение Михаэлиса-Ментен правильно описывает кинетику реакции (рис. 9.2), катализируемой ферментом только при условии выполнения всех следующих ограничительных условий: а) образуется кине-
тически устойчивый фермент-субстратный комплекс; б) Ks является константой диссоциации фермент-субстратного комплекса, это справедливо, только
если k2 << k−1 ; в) концентрация субстрата не меняется в ходе реакции; г) продукт реакции быстро отщепляется от фермента, то есть не образуется кинетически значимого количества EP-комплекса; д) вторая стадия реакции необратима; е) с каждым активным центром фермента связывается только одна молекула субстрата; ж) для всех реагирующих веществ вместо активностей можно использовать их концентрации.
Предполагая, что концентрация фермент-субстратного комплекса в процессе реакции не изменяется, можно вывести уравнение МихаэлисаМентен, которое объясняет гиперболический характер зависимости скорости ферментативной реакции от концентрации субстрата:
|
v |
0 |
=Vmax[S] |
(9.4) |
где |
|
(Km +[S]) , |
||
|
|
|
||
– константа Михаэлиса, – максимальная скорость, |
– концен- |
|||
трация субстрата. Механизм ферментативных реакций на самом деле гораздо более сложен, чем тот, который используется для элементарного вывода формулы Михаэлиса-Ментен. Но даже при более сложном механизме зави-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
409 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
симость между начальными скоростями и концентрацией фермента имеет гиперболический характер. Уравнение феноменологически хорошо описывает практически все ферментативные реакции, а отклонения, как правило,
связаны с усложнением простейшей кинетической схемы. Для описания ги- |
||||||
перболической кривой необходимы два параметра: |
|
и |
|
. |
||
|
Константа Михаэлиса характеризует сродство |
фермента к субстрату. |
||||
|
|
|
|
|
||
|
численно равна той концентрации субстрата [S], при которой скорость ре- |
|||||
акции достигает половины максимальной величины ( |
|
|
|
|
||
|
|
рис. 9.2). Высокое срод- |
||||
ство фермента к субстрату характеризуется низкой величиной Кm, и наоборот. Определенные по экспериментальным данным Кm и Vmax хорошо характеризуют фермент по отношению к соответствующему субстрату.
Для простого графического определения кинетических параметров ферментативных реакций часто используются различные линеаризации уравнения Михаэлиса-Ментен. Наиболее часто используется линеаризация Лайнуивера-Берка (рис. 9.3).
1 |
= |
Km +[S] |
(9.5) |
v |
|
vmax[S] |
|
Рис. 9.3. График Лайнуивера-Бэрка
Уравнение Лайнуивера–Бэрка:
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
410 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
1 |
= |
Km |
|
+ |
1 |
(9.6) |
|
v |
vmax[S] |
vmax |
|||||
|
|
|
|||||
Биолюминесцентная реакция, катализируемая бактериальной люциферазой
Биолюминесценция in vivo и in vitro нашла широкое применение в качестве аналитических методов и биотестов для решения проблем охраны окружающей среды, в научных исследованиях, в образовании. Биолюминесцентные методы используются для анализа метаболитов, ключевых ферментов, токсинов, мутагенов и других веществ, воздействующих на живые организмы.
Химической основой свечения бактерий является ферментативное окисление люциферазами восстановленного флавинмононуклеотида ФМН Н2 и длинноцепочечного алифатического альдегида RCHO кислородом воздуха. Способность люцифераз трансформировать энергию химических связей в световую относит ее к уникальному классу ферментов. Все бактериальные люциферазы – флавин-зависимые монооксигеназы. Несмотря на незначительные различия в структуре люцифераз из различных видов все они представляют собой ферментαβ -гетеродимер, состоящий из двух субъединиц, α и β , молекулярная масса которых соответственно 40 000 и 35 000. Индивидуальные субъеденицы неактивны. Эти две субъединицы гомологичны, но активный центр фермента расположен, главным образом, α насубъединице.
Суммарное уравнение процесса может быть записано так:
люцифераза |
(9.7) |
ФМН Н2 + RCHO + O2 → ФМН + RCOOH + H2O + hν, |
где ФМН и RCOOH – флавинмононуклеотид и карбоновая кислота соответственно.
Ни один из исходных реагентов обсуждаемой реакции не может существовать в бактериальной клетке в свободном виде (ФМН Н2 – по причине быстрого автоокисления, тетрадеканаль – потому что является ядом и не производится организмами). Поэтому бактерии имеют специальные ферментативные системы, способствующие восстановлению ФМН и карбоновой
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
411 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
кислоты исключительно для нужд биолюминесценции. Считается, что восстановление ФМН в бактериях происходит в реакции, катализируемой НAД(Ф)H:ФMН-оксидоредуктазой:
НАД(Ф)Н:ФМН-оксидоредуктаза |
(9.8) |
ФМН + НАДН + Н+ → НАД+ + ФМН Н2 |
Вопрос о механизме переноса восстановленного флавина между оксидоредуктазой и бактериальной люциферазой остается до сих пор открытым. Существуют косвенные свидетельства как независимой работы этих ферментов, так и образования прочного комплекса между ними.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
412 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА9.1. КИНЕТИКАФЕРМЕНТАТИВНЫХРЕАКЦИЙНАПРИМЕРЕ БАКТЕРИАЛЬНЫХБИОЛЮМИНЕСЦЕНТНЫХСИСТЕМ
 Цель лабораторной работы
Цель лабораторной работы
•экспериментальное изучение особенностей кинетики ферментативных реакций различного уровня сложности на примере бактериальных биолюминесцентных систем.
 Краткие теоретические сведения
Краткие теоретические сведения
Особенности функционирования моноферментной биолюминесцентной системы
Способы измерения активности моноферментной биолюминесцентной бактериальной системы имеют отличительную особенность: время, требуемое для одного каталитического цикла системы намного больше, чем время жизни одного из субстратов реакции – FМNН2, который автокаталитически окисляется кислородом менее чем за 1 с:
FМNН2 + O2 → FMN + H2O2 |
(9.9.) |
Поэтому в условиях запуска реакции одной порцией предварительно восстановленного FMN фермент успевает совершить всего один оборот. Наблюдается люминесцентная вспышка, затухающая по экспоненте реакция протекает в нестационарном режиме.
Восстановление FMN можно осуществлять и химически с помощью восстанавливающего реагента NADН. В этом случае в системе на протяжении довольно большого интервала времени присутствует FMNН2, в результате чего поддерживается постоянное (стационарное) свечение.
Второй субстрат – RCHO – подвержен медленному неферментативному окислению, и скорость окисления зависит от температуры и начальной концентрации. При комнатной температуре раствор альдегида, используемый для измерения биолюминесценции, стабилен в течение 8 ч. Неферментативное окисление альдегида в отличие от FМNН2 не оказывает влияния на ход люминесцентной реакции, поскольку его скорость значительно меньше скорости ферментативного окисления. Все бактериальные люциферазы проявляют биолюминесцентную активность с альдегидами, длина цепи которых от восьми до шестнадцати углеродов. Существует предположение, что сродство альдегида к люциферазе обусловлено гидрофобными взаимодействиями
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
413 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
между каждым участком алифатической цепи альдегида и гидрофобными группами фермента. Благодаря этому с увеличением длины углеродной цепи альдегид прочнее связывается с люциферазой. Это обеспечиваетóльшуюб эффективность превращения химической энергии в световую. Однако эту гипотезу нельзя считать всеобъемлющей, поскольку не для всех люцифераз соблюдается монотонная связь параметров биолюминесцентной реакции с длиной цепи альдегида. Специфичность люцифераз к альдегидам проявляется в том, что другие алифатические длинноцепочечные соединения (кетоны, кислоты, спирты) не обнаруживают с люциферазой биолюминесцентной активности, хотя не исключено, что они реагируют с ней без излучения. Природным субстратом бактериальной люциферазы считается тетрадеканаль, поскольку в бактериях ферментативная система, восстанавливающая для нужд биолюминесценции карбоновую кислоту, имеет специфичность именно к миристиновой кислоте.
Кинетические особенности функционирования биферментной системы НАДН:ФМН- оксидоредуктаза- люцифераза
Любые ферменты, катализирующие синтез субстратов люциферазы, могут образовывать с ней сопряженную ферментную систему. Одной из первых была исследована и описана сопряженная ферментная система NAD(P)H:FMN-оксидоредуктаза-люцифераза, осуществляющая следующую цепь ферментативных реакций:
FMN + NAD(P)H + FMN H2 + NAD(P), |
(9.10) |
л ю ц и ф е р а |
(9.11) |
FMN Н2 + RCHO + O2 → FMN + RCOOH + Н2О + hν |
В результате первой реакции, катализируемой NADH:FMNоксидоредуктазой, происходит восстановление FMN с помощью восстанавливающего реагента NADН.
Вторая реакция, катализируемая люциферазой, является биолюминесцентной. В этой реакции восстановленный флавин и алифатический альдегид окисляются кислородом воздуха. В результате реакции образуется окисленная форма флавина, жирная кислота, а также испускается квант света. При проведении биолюминесцентной реакции с использованием химически вос-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
414 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
становленного FМNН2 наблюдается длительное свечение, обусловленное множественными оборотами фермента.
Сродство и специфичность ферментов
Константа Михаэлиса Кm характеризует сродство фермента к субстрату. Кm численно равна той концентрации субстрата [S], при которой скорость реакции достигает половины максимальной величины Vmax (рис. 9.3). Высокое сродство фермента к субстрату характеризуется низкой величиной Кm и наоборот. Модель Михаэлиса-Ментен основывается на нескольких не совсем реальных допущениях таких, как необратимое превращение ES в E + Р, достижение равновесия между E, S и ES, отсутствие в растворе других форм фермента, кроме E и ES. Только при соблюдении этих гипотетических условий Km соответствует константе диссоциации комплекса, а kkat — константе скорости реакции ES→E+Р.
Специфичность, т. е. выбор ферментом только одного из двух конкурирующих субстратов, определяется отношением kkat/Km.
Увеличение скорости ферментативных реакций происходит при увеличении отношения kkat/Km за счет повышения комплементарности фермента переходному состоянию субстрата, а также при увеличении концентрации свободного фермента за счет повышения Km.
Трехмерная структура белков поддерживается комплексом невалентных взаимодействий, среди которых основными являются гидрофобные и электростатические (солевые мостики, водородные связи, силы Ван-дер- Ваальса, диполь-дипольные, ион-ионные и т. д. взаимодействия). Для осуществления каталитической функции ферментам требуется строго определенное расположение групп активного центра, и, следовательно, факт наличия каталитической активности указывает на сохранность (полную или практически полную) активного центра. При этом наиболее чувствительны к изменениям в активном центре специфические субстраты. Таким образом, проявление каталитической активности ферментами в тех или иных условиях служит индикатором существования активного центра.
Активные центры ферментов – более «хрупкие» и более подвержены «возмущениям», чем вся белковая молекула, и поэтому обладают большей конформационной гибкостью, чем остальная часть молекулы. Вероятно, на протяжении каталитического цикла фермент проходит через определенные стадии с различными конформационными состояниями молекулы, особенно
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
415 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
в области активного центра. Поэтому быстрые переходы между различными конформационными состояниями и, следовательно, гибкость активного центра – обязательное условие для максимального проявления ферментативной активности. Однако роль гибкости активного центра в ферментативном катализе остается еще не выясненной.
Порядок выполнения работы
Биолюминесцентная моноферментная реакция, катализируемая бактериальной люциферазой, при инициировании ее химически восстановленным FMNН2 при добавлении NADH, а также реакция растворимой биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза представляют собой длительное свечение с монотонным спадом биолюминесценции. Максимум интенсивности свечения (I0) характеризует начальную скорость реакции и концентрацию фермент-субстратных комплексов, образуемых в ходе реакции. Спад биолюминесценции определяет скорость распада фер- мент-субстратного комплекса во времени и подчиняется экспоненциальному закону. Константа спада биолюминесценции (kcat) вычисляется по спаду свечения от 80 до 20 % от максимальной интенсивности: kcat=(lnI80-lnI20)/t. Общее число квантов Q=Io/kcat пропорционально общему числу молекул фермент-субстратного комплекса, распавшихся с излучением. Как правило, проводится не менее пяти измерений. Статистическая обработка полученных экспериментальных результатов проводится методом наименьших квадратов с использованием пакета программ Excel for Windows-98.
 Материалы и оборудование
Материалы и оборудование
Лиофилизованные препараты высокоочищенных ферментов, произведенные в лаборатории бактериальной биолюминесценции Института биофизики СО РАН. Один флакон лиофилизованного препарата содержит 0,4 мг/мл люциферазы (L) EC 1.14.14.3 из рекомбинантного штамма E.coli и 0,18 ед.активности НАДH:ФМН-оксидоредуктазы (R) EC 1.5.1.29 (Photobacterium leiognathi). Перед измерениями лиофилизованные ферменты растворяют в 0,05 М калий фосфатном буфере (рН 6,8).
Для исследования кинетики моноферментной реакции в работе могут быть использованы люциферазы из Photobacterium leiognathi (штамм 208), Vibrio harveyi (штамм 1212) и рекомбинантного штамма Е.coli, высокоочи-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
416 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
щенные методами ионообменной хроматографии и гель-фильтрации в лаборатории бактериальной биолюминесценции ИБФ СО РАН.
Реактивы: НАДH и ФМН фирмы Serva (Германия), тетрадеканаль фирмы Merck (Германия). Для приготовления растворов необходимо использовать 0,05 М калий фосфатный буфер (рН 6,8).
В качестве альдегидных субстратов необходимо приготовить растворы следующих длинноцепочечных алифатических альдегидов: деканаля (С10) (Sigma, США), додеканаля (С12) (Merck, ФРГ) и тетрадеканаля (С14) (Merck,
ФРГ) как описано ниже. В качестве второго субстрата реакции используется фотовосстановленный флавинмононуклуотид (FMNН2) (Sigma, США).
Люминометр GloMax®-20/20 фирмы «Turner BioSystems» (Sunnyvale,USA) (рис. 9.4).
Жидкостной циркуляционный ультратермостате VT-8 (Термэкс-2, Рос-
сия) (рис. 9.5).
Автоматические пипетки.
рН-метр МР 220 Meter (METTLER TOLEDO, США).
Рис. 9.4. Люминометр GloMax®-20/20 (Turner BioSystems, Sunnyvale, США)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
417 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
 Характеристики оборудования
Характеристики оборудования
 Люминометр
Люминометр
Люминометр The GloMax®-20/20 позволяет проводить высокоточный и высокочувствительный биолюминесцентный и хемилюминесцентной анализ.
Основные характеристики GloMax®-20/20:
•спектральный диапазон 350-–650 нм;
•максимальная спектральная чувствительность 420 нм;
•чувствительность к концентрациям ATP 3.10-18 М;
•чувствительность к концентрациям люциферазы 1. 10-21 М;
•температурный диапазон 15 – 40 оС;
•операционная система Windows XP SP2 или выше;
•параметры образцов – 1,5 мл кюветы, 35 мм чашки Петри
•вес – 3,5 кг.
Видеоинструкцию по работе с биолюминометром GloMax®-20/20, представленную компанией-разработчиком Turner BioSystems, Sunnyvale, США, м ожно н а с айте к опании http://www.luminometer.com/videos/GloMax/Perf-LUM.php
 ТермостатVT-8
ТермостатVT-8
Термостат VT-8 (рис. 9.5) предназначен для поддержания заданной температуры жидкого теплоносителя, циркулирующего во внутренней ванне термостата и в подключенных внешних потребителях. В качестве внешних потребителей к термостатам могут быть подключены термостатирующие контуры лабораторных химических реакторов, измерительных приборов и другого оборудования.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
418 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
Технические характеристики |
|
Масса термостата без тепло- |
||
Диапазон регулирования температу- |
носителя: 12 кг. |
|||
ры, °С: 20...100. |
|
|
|
Потребляемая мощность: 2,5кВт. |
Нестабильность |
поддержания |
уста- |
|
|
новленной температуры, °С: |
±0.1. |
|
||
Неоднородность температурного по- |
|
|||
ля во внутренней ванне, °С: |
±0.1. |
|
||
Объём ванны: |
8 л. |
|
|
|
Габаритные размеры: |
380×275×430 |
|
||
мм. |
|
|
|
|
Открытая часть ванны: |
120×200 |
|
||
мм. |
|
|
|
|
Глубина ванны: 150 мм. |
Рис. 9.5. Термостат Vt8 termex |
|
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 9.1.1. Методика регистрации моноферментной биолюминесцентнойреакции ирасчеткинетических параметров
Порядок выполнения работы
1)Для регистрации кинетики бактериальной моноферментной биолюминесцентной системы реакция запускается химически восстановленным FMNH2. Для восстановления этого субстрата используется NADH.
2)Реакцию для измерения контроля проводят в смеси следующего состава: 10 мкл (0,07–0,13) 10-5 М люциферазы, 50 мкл водного раствора соответствующего алифатического альдегида (Merck, ФРГ), 840 мкл 0,02 М фос-
фатного буфера, 50 мкл 7,2 10-4 М водного раствора флавинмононуклеотида
(FMNH2) (Sigma, США), 50 мкл 0,1М NADH (Serva, CША), рН 7. Концентрации люциферазы Ph.leiognathi в реакционной смеси рекомендуется использовать в диапазоне (0,1–1,5)·10-7 М, люциферазы V.harveyi – (0,007 – 0,013)·10-7,М.
Концентрации субстратов в реакционной смеси приготовить следующие:
С14=47·10-6 M, С12=5,4·10-6 M, C10=12,8·10-3 M, FMN=7,6·10-5 М.
3)Используемые реактивы готовят так:
•FMNH2: 4,5 мг FMNH2 разбавлялись до 10 мл воды и 10 мМ ЭДТА.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
419 |
