
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.2. ЭЛЕКТРОФОРЕЗ В АГАРОЗНОМ ГЕЛЕ. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ДНК
4.Система видеодокументирования гелей «Molecular Imager Gel Doc XR » производства «Bio-Rad» (США) с трансиллюминатором.
5.Спектрофотометр кюветный Bio-Rad SmartSpec plus с кварцевыми кюветами на 0,1, 0,7, 1.4 и 3,5 мл.
6.Центрифуга с охлаждением Eppendorf 5417R с роторами для микропробирок FA-45-24-11 и ПЦР-стрипов F-45-48-PCR в комплекте.
7.Микроволновая печь.
8.Лабораторный шейкер-вортекс «Вортекс V-1» фирмы
«BioSan«.
9.Пипетки автоматические Gilson Pipetman (комплект из 5
штук: Р-10, Р-20, Р-100, Р-200, Р-1000).
10.Гидрофобная пленка Parafilm.
11.Мерные стаканы и колбы, наконечники для автоматических дозаторов.
12.Буферы и реактивы для проведения электрофореза.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
Порядок выполнения работы
1.Приготовить 0,5х ТВЕ (ТАЕ) буфер путем разведения стокового раствора 10хТВЕ (ТАЕ).
2.Приготовить 1% агарозный гель. Для этого взять 0,35 г агарозы и 35 мл 0,5хТВЕ (ТАЕ) буфера (маленький гель), либо 1,9 г агарозы и 190 мл 0,5хТВЕ (ТАЕ) буфера (большой гель). Нагреть до кипения в микроволновой
печи. Остудить до 60°С (колбу такой температуры можно держать рукой не обжигаясь), залить в подготовленную форму, стоящую строго горизонтально, установить гребенки. Следует избегать появления пузырьков.
3. Смешать 8 мкл деионизированной воды, 3 мкл ДНК и 1 мкл 6х буф е- ра и поместить полученную смесь в лунку агарозного геля. Перемешивание компонентов можно производить в ячейках иммуноферментных плашек либо на поверхности гидрофобной пленки Parafilm.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
84 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.2. ЭЛЕКТРОФОРЕЗ В АГАРОЗНОМ ГЕЛЕ. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ДНК
4.Через 30-40 мин, когда гель сформируется, осторожно убрать гребенки. Заливку проб лучше осуществлять на горизонтальной темной поверхности. В крайние лунки следует поместить ДНК-маркер.
5.Перенести гель в электрофорезную камеру, предварительно заполненную 0,5хТВЕ (ТАЕ) буфером. Гель должен быть покрыт буфером на 1-2- мм.
6.Провести электрофорез при 50 В (мини-гель) либо 125 В (большой
гель).
7.Поместить гель на 20 мин в раствор этидиумбромида (250-500 мкл стокового раствора этидиумбромида на 1 л дистиллированной воды), периодически покачивая его, затем промыть в дистиллированной воде в течение 1-2 мин.
ВНИМАНИЕ! С раствором этидиумбромида и окрашенным гелем необходимо работать только в перчатках!
8. Поместить окрашенный гель в камеру трасиллюминатора и рассмотреть проходящем УФ-свете. Зафиксировать результат с помощью системы гель-документирования Bio-Rad Gel Doc XR.
Задание 2.2.3. Определение качества иколичества ДНК с помощью электрофореза
Порядок выполнения работы
1.Оценить качество выделенной ДНК и определить длину основной массы растительной ДНК, сравнивая последнюю с известной длиной фрагментов ДНК-маркера.
2.Оценить примерную концентрацию растительной ДНК путем сопоставления интенсивности свечения полос выделенной ДНК с интенсивностью свечения полос ДНК-маркера.
3.Рассчитать количество полученной ДНК на общий объем пробы.
Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
Порядок выполнения работы
1. Развести образец ДНК ТЕ-буфером (деионизированной водой).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
85 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.2. ЭЛЕКТРОФОРЕЗ В АГАРОЗНОМ ГЕЛЕ. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ДНК
2.Поместить ТЕ-буфер (деионизированную воду) в кварцевую кювету 80-100 мкл и установить «0».
3.Поместить разведенный образец ДНК в кювету и замерить поглоще-
ние при 260, 280, 320 нм.
4.Рассчитать концентрацию ДНК в растворе, сделать вывод о чистоте
пробы.
5.Рассчитать количество ДНК в общей неразведенной пробе.
 Контрольные вопросы
Контрольные вопросы
1.Какие принципы положены в основу электрофоретического разделения молекул ДНК?
2.Каким образом рассчитывают объем агарозного геля?
3.Назовите последовательность основных этапов проведения электрофореза ДНК в агарозном геле.
4.Каким образом с помощью электорофореза можно определить количество и качество выделенной ДНК?
5.Какие принципы положены в основу спектрофотометрического определения количественных и качественных характеристик ДНК, выделенной из растительных образцов?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
86 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА2.3. ИЗУЧЕНИЕМЕТОДОВ, БАЗИРУЮЩИХСЯНАВЫЯВЛЕНИИ АНОНИМНОГОПОЛИМОРФИЗМАДНК
 Цель лабораторной работы:
Цель лабораторной работы:
•ознакомление с RAPD и ISSR методами анализа полиморфизма ДНК растений.
 Задачи лабораторной работы:
Задачи лабораторной работы:
•Осуществить подбор праймеров для проведения анализов по ме-
тодам RAPD и ISSR.
•Разделить амплифицированные фрагменты ДНК с помощью электрофореза.
•Провести амплификацию и электрофорез всех образцов ДНК с выбранным праймером.
•Составить и проанализировать матрицу фенетических признаков.
 Краткие теоретические сведения
Краткие теоретические сведения
К группе методов, анализирующих анонимный полиморфизм ДНК, от-
носятся следующие: RFLP, RAPD, ISSR, АFLP, DAF, SCAR, CAPS и метод микроса-
теллитов. Данные методы различаются по воспроизводимости, трудоемкости, стоимости и природе полиморфизма, который они выявляют. Эти различия сильно влияют на возможности их применения в различных исследованиях. В основу этих методов могут быть положены принципы гибридизации (например, RFLP) или полимерной цепной реакции (PCR) (например, RAPD, АFLP, ISSR), другие методы могут выявлять уникальные участки ДНК (например, SCAR, CAPS) или участки ДНК, встречающиеся многократно в геноме (микросателлиты). Выявленные признаки могут быть проанализированы в матрицах на базе принципа присутствия/отсутствия, т. е. фенетическими методом анализа.
RAPD- и ISSR-методы используются для выяснения генетического родства между близкородственными таксонами на основе анализа всего ядерного генома. Оба метода основаны на ПЦР и не требуют ни секвенирования, ни клонирования. С их помощью можно довольно быстро получить большое количество фрагментов ДНК различной длины (признаков).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
87 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
RAPD-метод (random amplified polymorphic DNA – случайно амплифи-
цированный полиморфизм ДНК) заключается в амплификации фрагментов ДНК с использованием праймеров с низкой температурой отжига в ПЦР. Праймер связывается с геномной ДНК в двух различных участках инвертированных повторов [10]. Для проведения RAPD используют короткие праймеры длиной 10 нуклеотидов со случайной последовательностью, желательно содержащие 50-70 % ГЦ-нуклеотидов. Существует множество коммерческих видов RAPD-праймеров, которые обычно разделены на серии по буквам латинского алфавита и помечены соответствующей цифрой. Например серия «B» – B1, B2, BЗ и т. д. (табл. 2.1). Один и тот же RAPD -праймер работает на обеих цепях ДНК.
Таблица 2.1
Примерыпраймеров, используемых для проведения RAPD-анализа
|
Последовательность 5- |
Назва- |
Последовательность |
Название |
3′ |
ние |
5-3′ |
|
|
|
|
A01 |
CAG-GCC-CTT- C |
B01 |
GTT-TCG-CTC-C |
|
|
|
|
A02 |
TGC-CGA-GCT-G |
B02 |
TGA-TCC-CTG-G |
|
|
|
|
A03 |
AGT-CAG-CCA-C |
B03 |
CAT-CCC-CCT-G |
|
|
|
|
A04 |
AAT-CGG-GCT-G |
B04 |
GGA-CTG-GAG-T |
|
|
|
|
A05 |
AGG-GGT-CTT-G |
B05 |
TGC-GCC-CTT-C |
|
|
|
|
A06 |
GGT-CCC-TGA-C |
B06 |
TGC-TCT-GCC-C |
|
|
|
|
A07 |
GAA-ACG-GGT-G |
B07 |
GGT-GAC-GCA-G |
|
|
|
|
A08 |
GTG-ACG-TAG-G |
B08 |
GTC-CAC-ACG-G |
|
|
|
|
A09 |
GGG-TAA-CGC-C |
B09 |
TGG-GGG-ACT-C |
|
|
|
|
A10 |
GTG-ATC-GCA-G |
B10 |
CTG-CTG-GGA-C |
|
|
|
|
При проведении электрофореза с продуктами амплификации выявляются фрагменты ДНК (так называемые ДНК паттерны), длина которых может варьировать от 100 до 5000 п.н. Данные фрагменты представляют собой анонимную (с невыясненным нуклеотидным составом) последовательность ДНК, заключенную между двумя инвертированными повторами. Различия в ДНК-паттернах определяются различиями в одном или обоих праймер-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
88 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
связывающих сайтах (наличие или отсутствие полосы ПЦР-продукта в спектре) или присутствием инсерции/делеции в амплифицируемом фрагменте (различия ПЦР-продуктов по размеру). Большинство RAPD-маркеров являются признаками с доминантным типом наследования.
Минусом метода RAPD является ограничение количества анализируемых образцов (не более 80–90). Дело в том, что весьма трудно определить гомологические фрагменты, полученные при разных ПЦР-реакциях. Поэтому рекомендуется проводить сравнение фрагментов ДНК, полученных с помощью одного праймера, в одной ПЦР-реакции и одного элекрофорезного геля.
Также как и RAPD, ISSR-метод (Inter-Simple Sequence Repeats – межмик-
росателлитные повторы последовательностей) анализирует анонимный полиморфизм ДНК, однако в отличие от последнего он хорошо воспроизводим.
Таблица 2.2
Примеры праймеров, используемых для проведения ISSR-анализа
Название |
Последовательность 5-3′ |
Название |
Последовательность 5-3′ |
|
|
|
|
|
|
814 |
CTC-TCT-CTC-TCT-CTC-TTG |
UBC808 |
AGA-GAG-AGA-GAG-AGA- |
|
GC |
||||
|
|
|
||
|
|
|
|
|
844A |
CTC-TCT-CTC-TCT-CTC-TAC |
UBC810 |
GAG-AGA-GAG-AGA-GAG- |
|
AT |
||||
|
|
|
||
|
|
|
|
|
844B |
CTC-TCT-CTC-TCT-CTC-TGC |
UBC811 |
GAG-AGA-GAG-AGA-GAG- |
|
AC |
||||
|
|
|
||
|
|
|
|
|
17898A |
CAC-ACA-CAC-ACA-AC |
UBC814 |
CTC-TCT-CTC-TCT-CTC-TA |
|
|
|
|
|
|
17898B |
CAC-ACA-CAC-ACA-GT |
UBC816 |
CAC-ACA-CAC-ACA-CAC-AT |
|
|
|
|
|
|
17899A |
CAC-ACA-CAC-ACA-AG |
UBC820 |
GTG-TGT-GTG-TGT-GTG-TC |
|
|
|
|
|
|
17899B |
CAC-ACA-CAC-ACA-GG |
UBC824 |
TCT-CTC-TCT-CTC-TCT-CG |
|
|
|
|
|
|
HB8 |
GAG-AGA-GAG-AGA-GG |
UBC826 |
ACA-CAC-ACA-CAC-ACA-CC |
|
|
|
|
|
|
HB9 |
GTG-TGT-GTG-TGT-GG |
UBC827 |
ACA-CAC-ACA-CAC-ACA-CG |
|
|
|
|
|
|
HB10 |
GAG-AGA-GAG-AGA-CC |
UBC828 |
TGT-GTG-TGT-GTG-TGT-GA |
|
|
|
|
|
Для создания ISSR-маркеров используют праймеры, комплементарные микросателлитным повторам (4–12 единицам) и несущие на одном из кон-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
89 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
цов последовательность из двух-четырех произвольных нуклеотидов (так называемый якорь). Примеры таких праймеров приведены в табл. 2.2. ISSRпраймеры позволяют амплифицировать фрагменты ДНК, которые находятся между двумя достаточно близко расположенными микросателлитными последовательностями (как правило, это уникальная ДНК).
В результате амплифицируется большое число фрагментов, представленных на электрофореграмме дискретными полосами. ISSR-маркеры также относятся к маркерам доминантного типа наследования, полиморфизм которых тестируется по наличию/отсутствию полосы. Аналогично RAPD-, для создания ISSR-маркеров не требуется предварительного знания нуклеотидной последовательности аналищируемой ДНК. Метод может быть с успехом использован для выявления межвидовой и внутривидовой генетической изменчивости, идентификации видов, популяций, линий, а в ряде случаев и для индивидуального генотипирования.
Протоколы проведения исследований при использовании RAPD- и ISSRметодов сходны.
На первом этапе осуществляют подбор праймеров, которые дают достаточное количество фрагментов ДНК на объекте исследования. Для этого используют обычно ДНК от 2-4 образцов, относящихся к разным видам или популяциям. На следующем этапе проводят амплификацию всех образцов ДНК с выбранными праймерами (RAPD-программа амплификации приведена в табл. 2.3) и разделяют амплифицированные фрагменты ДНК с помощью электрофореза.
|
|
|
Таблица 2.3 |
|
|
RAPD-программа для ПЦР-реакции |
|
|
|
|
|
|
|
|
Шаг |
Температура, |
Продолжительность |
Количество |
|
°С |
циклов |
|
||
|
|
|
||
|
|
|
|
|
1 |
95 |
0:02:30 |
|
|
2 |
95 |
0:00:30 |
|
|
3 |
34 |
0:00:45 |
35 |
|
|
|
|
|
|
4 |
72 |
0:02:00 |
|
|
|
|
|||
|
|
|
|
|
5 |
72 |
0:10:00 |
|
|
6 |
4 |
∞ |
|
|
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
90 |
РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
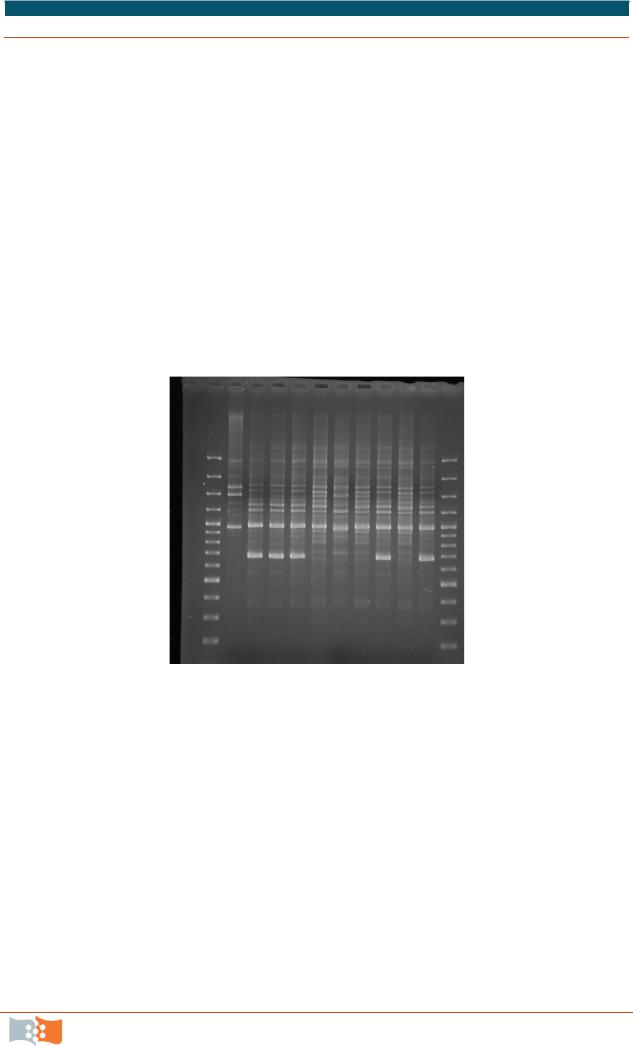
Окрашенные этидиумбромидом электрофорезные гели визуализируют в ультрафиолетовых лучах и документируют (рис. 2.3).
Для более надежных результатов обычно используется несколько праймеров. На основе присутствия или отсутствия фрагментов одинаковой длины составляется матрица для фенетического анализа. С помощью линейки для каждого образца отмечаются наличие или отсутствие фрагментов ДНК одинаковой длины на фотографии электрофорезного геля (здесь подразумевается, что фрагменты, имеющие одинаковое количество нуклеотидов, гомологичны), наличие отмечается цифрой «I», отсутствие цифрой «О». Полученную матрицу анализируют с помощью программ для фенетического ана-
лиза (NTSYSpc 2.1 T, Treecon и др.).
Рис. 2.3. Результат электрофореза фрагментов ДНК, полученных при использовании праймера В-1 для байкальской популяции Anemone baikalensis
 Материалы и оборудование
Материалы и оборудование
1.Амплификатор компактный 48х0,2 мл с градиентом 1–16 ºС, MJ Mini Bio-Rad.
2.Центрифуга с охлаждением Eppendorf 5417R с роторами для микропробирок FA-45-24-11 и ПЦР-стрипов F-45-48-PCR в комплекте.
3.Центрифуга Eppendorf MiniSpin на 12 микропробирок.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
91 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
4.Лабораторный шейкер-вортекс «Вортекс V-1» фирмы
«BioSan«.
5.Источник питания Bio-Rad PowerPac HV (1-400 Вт, 0,01-500 мА, 20-5000 В).
6.Камера для горизонтального электрофореза стандартного формата (гель 15х25 см, 10-120 образцов) Sub-Cell GT, BioRad.
7.Система видеодокументирования гелей «Molecular Imager Gel Doc XR» производства «Bio-Rad» (США) с трансиллюминатором.
8.Спектрофотометр кюветный Bio-Rad SmartSpec plus с кварцевыми кюветами на 0,1, 0,7, 1,4 и 3,5 мл.
9.Микроволновая печь.
10.Пипетки автоматические Gilson Pipetman (комплект из 5
штук: Р-10, Р-20, Р-100, Р-200, Р-1000).
11.Мерные стаканы и колбы, 1,5 и 0,2 мл микропробирки, наконечники для автоматических дозаторов.
12.Буферы и реактивы для проведения ПЦР-реакции и электрофореза.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 2.3.1. Подбор праймеровдля проведения анализов по методамRAPD и ISSR
Порядок выполнения работы
1.Приготовить десять 1,5 мл и двадцать 0,2 мл микропробирок, расставить в 3 ряда по 10 штук в каждом, подписать.
2.Для анализа необходимо взять ДНК образцов, относящихся к разным популяциям или видам. В 0,2 мл пробирки 1 ряда помещается по 2 мкл ДНК растений популяции (одного вида), во второй – 2 популяции (другого вида). ДНК предварительно необходимо разморозить, встряхнуть на вортексе и отцентрифугировать в течение нескольких секунд.
3.Приготовить реакционную смесь (Master mix) для каждого праймера по приведенной в табл. 2.4 схеме:
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
92 |
