
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
|
|
|
|
|
|
Табл. 2.4 |
|
Состав реакционной смеси для пробной амплификации |
|||||||
|
|
|
|
|
|
|
|
|
Деионизи- |
|
MgCl2 |
|
Смесь |
Taqполи- |
|
|
10x |
Праймер |
dNTPs |
||||
|
рованная |
мераза |
|||||
|
буфер |
25 мM |
10 мМ |
10-20 |
|||
|
H2O |
(5ед./мкл). |
|||||
|
|
||||||
|
|
|
|
|
мМ |
|
|
На 1 обра- |
15 мкл |
2,5 мкл |
2,5 мкл |
2 мкл |
1 мкл |
0,2 мкл |
|
зец |
|
|
|
|
|
|
|
На 3 об- |
45 мкл |
7,5 мкл |
7,5 мкл |
6 мкл |
3 мкл |
0,6 мкл |
|
разца |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
4. В пробирки 1,5 мл последовательно поместить все 6 компонентов (в каждую пробирку помещается свой праймер, название которого следует указать на крышке пробирки). Смесь встряхнуть на вортексе и отцентрифугировать в течение нескольких секунд. Taq-полимеразу добавить в последнюю очередь (предварительно не размораживая), и поместить реакционную смесь на лед.
5. В каждую ПЦР пробирку 0,2 мл с ДНК добавить по 23 мкл реакцио н- ной смеси. Встряхнуть на вортексе. Центрифугировать 30 с при 10 000 об/мин.
5. Поставить пробирки 0,2 мл в амплификатор и включить программу амплификации RAPD или ISSR.
Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
Порядок выполнения работы
1.Приготовить 1,5%-й агарозный гель.
2.В пробирки 0,2 мл с амплификатом добавить по 1 мкл 6х буфера, п е- ремешать. Полученную смесь поместить в лунки агарозного геля. В крайние лунки добавить ДНК-маркер (3 мкл ДНК маркера, 8 мкл деионизированной воды, 1 мкл 6х буфера).
3.Перенести гель в электрофорезную камеру, предварительно заполненную 0,5хТВЕ (ТАЕ) буфером. Гель должен быть покрыт буфером на 1-2- мм.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
93 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
6.Провести электрофорез в течение 2,5–3,5 часов при 40 В (маленький гель) или 75 В (большой гель).
7.Поместить гель на 20 мин в раствор этидиумбромида (250-500 мкл стокового раствора этидиумбромида на 1 л дистиллированной воды), постоянно покачивая его, затем промыть в дистиллированной воде в течение 1-2 мин.
Внимание! С раствором этидиумбромида и окрашенным гелем необходимо работать только в перчатках!
8.Поместить окрашенный гель в камеру трасиллюминатора и рассмотреть проходящем УФ-свете. Зафиксировать результат с помощью системы гель-документирования Bio-Rad Gel Doc XR.
9.Используя полученные результаты отобрать праймеры, дающие достаточное количество фрагментов ДНК на объектах исследования.
Задание 2.3.3. Проведение амплификации и электрофореза всех образцов ДНК свыбранным праймером
Порядок выполнения работы
1.Для каждого образца подготовить одну стерильную пробирку 0,2 мл, подписать и поставить в ряд на подставку для пробирок.
2.Поместить в пробирки 0,2 мл по 2 мкл ДНК исследуемых растений (ДНК предварительно необходимо разморозить, встряхнуть на вортексе и отцентрифугировать).
3.Рассчитать и приготовить реакционную смесь по следующей схеме :
Деионизи- |
|
|
|
Смесь |
Taq поли- |
|
MgCl2 |
Праймер |
dNTPs |
||
рованная |
10 буфер |
мераза |
|||
H2O |
× |
25 мM |
10 мМ |
10-20 |
(5ед./мкл) |
мМ |
|||||
15 мкл n |
2,5 мкл |
2,5 мкл |
2 мкл n |
1 мкл |
0,2 мкл n |
|
n |
n |
|
n |
|
Примечание: n – число образцов плюс один на каждые 10 образцов
4. В пробирку 1,5 мл последовательно добавить все 6 компонентов, тщательно перемешать на вортексе и отцентрифугировать в течение не-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
94 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
скольких секунд. Taq полимеразу добавить в последнюю очередь (предварительно не размораживая), и поместить реакционную смесь на лед.
5.В каждую ПЦР пробирку 0,2 мл с ДНК добавить по 23 мкл реакцио н- ной смеси. Встряхнуть на вортексе. Центрифугировать 30 с при 10 000 об/мин.
6.Поставить пробирки 0,2 мл в амплификатор и включить программу амплификации RAPD или ISSR.
7.По аналогии с предыдущим протоколом (Задание 2.3.2) провести электорофорез продуктов амплификации в 1,5 %-м агарозном геле при напряжении 2,5 В/см. Зафиксировать результат с помощью системы гельдокументирования Bio-Rad Gel Doc XR.
Задание 2.3.4.Составление и анализ матрицы фенетических признаков
Порядок выполнения работы
1.Составить матрицу фенетических признаков. Для этого с помощью линейки для каждого образца отметить наличие или отсутствие фрагментов ДНК одинаковой длины на фотографии электрофорезного геля. Наличие отмечается цифрой «I», отсутствие – цифрой «О». Данные занести в программу
NTSYSpc2.1 T (приложение NTedit).
2.С помощью программы NTSYSpc2.1 T построить различные варианты филогенетических деревьев, используя методы UPGMA (метод попарного внутригруппового невзвешенного среднего) и NJ (метод объединения соседей).
3.Проанализировать полученные данные и сделать вывод о сходстве изученных видов (популяций).
 Контрольные вопросы
Контрольные вопросы
1.Какие методы анализируют анонимный полиморфизм ДНК? Какие принципы положены в их основу?
2.Назовите достоинства и недостатки использования RAPD и ISSR ме-
тодов.
3.Какие участки ДНК амплифицируются при проведении RAPD и ISSR анализов?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
95 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.3. ИЗУЧЕНИЕ МЕТОДОВ, БАЗИРУЮЩИХСЯ НА ВЫЯВЛЕНИИ АНОНИМНОГО ПОЛИМОРФИЗМА ДНК
4.Какие требования предъявляются к праймерам, используемым для создания RAPD- и ISSR-маркеров?
5.Назовите последовательность основных этапов работ при проведении RAPD- и ISSR-анализов.
6.Каким образом анализируется матрица фенетических признаков?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
96 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА2.4. КОЛИЧЕСТВЕННОЕОПРЕДЕЛЕНИЕПРИСУТСТВИЯГМОВ ПРОДУКТАХПИТАНИЯМЕТОДОМПЦР
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с постановкой определения генетически модифицированных организмов (ГМО), с процедурами выделения ДНК из пищевых продуктов, проведения полимеразной цепной реакции (ПЦР) и анализа продуктов ПЦР с помощью гель-электрофореза.
 Краткие теоретические сведения
Краткие теоретические сведения
Достижения современной биотехнологии позволили выведение новых сортов сельскохозяйственных культур с полезными свойствами: устойчивостью к вредителям и грибковым заражениям, повышенными пищевой ценностью, урожайностью, засухоустойчивостью и пр. – с помощью генетических манипуляций, т. е. введением в геном растения генов, обеспечивающих соответствующий признак, или модификацией существующих. В обществе имеются как сторонники так и противники генно-модифицированных культур. Первые указывают на полезные свойства, которые позволяют интенсифицировать сельское хозяйство, избежать использования гербицидов, получать более высокие урожаи и т. п. Вторые опасаются проявлений аллергических реакций на такие продукты, снижения природного биоразнообразия, утечки трансгенов в дикую природу и других неопределенных отдаленных во времени последствий.
В настоящий время не обнаружено однозначных доказательств, что генетически модифицированные продукты способны принести вред человеку. Хотя выгода от применения ГМ-растений очевидна, существует много противников трансгенных растений, убежденных в их опасности и использующих в своих аргументах невозможность ученых дать полную гарантию безопасности подобных продуктов. В каждой стране мира вопрос об использовании трансгенных растений решается по-разному местными законодателями.
Примерно в 30 странах мира действует правило, согласно которому упаковки продуктов, при изготовлении которых использовались достижения генной инженерии, должны содержать информацию об этом, чтобы потребители самостоятельно делали свой выбор. Однако во многих случаях, например, когда соя используется при производстве мясных полуфабрикатов, производители не сообщают об этом покупателям.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
97 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.4. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИСУТСТВИЯ ГМО В ПРОДУКТАХ ПИТАНИЯ МЕТОДОМ ПЦР
С 1 июня 2004 г. в Российской Федерации установлен новый допустимый порог наличия таких примесей в 0,9 %, который требуется количественно точно детектировать и указывать на упаковке.
Генетически-модифицированные продукты абсолютно ничем не отличаются по внешнему виду от своих природных аналогов. Установить генетическую модификацию проще всего методами генетичесокго анализа, а именно методом полимеразной цепной реакции (ПЦР). Если просто наличие ГМ-примесей (принцип да-нет) можно установить обычной ПЦР, то для количественной оценки примесей требуется более сложный метод ПЦР в реальном времени (real time PCR). Последний получает все более широкое распространение, поскольку законодательство требует количественной маркировки присутствия ГМ-примесей в пищевых продуктах.
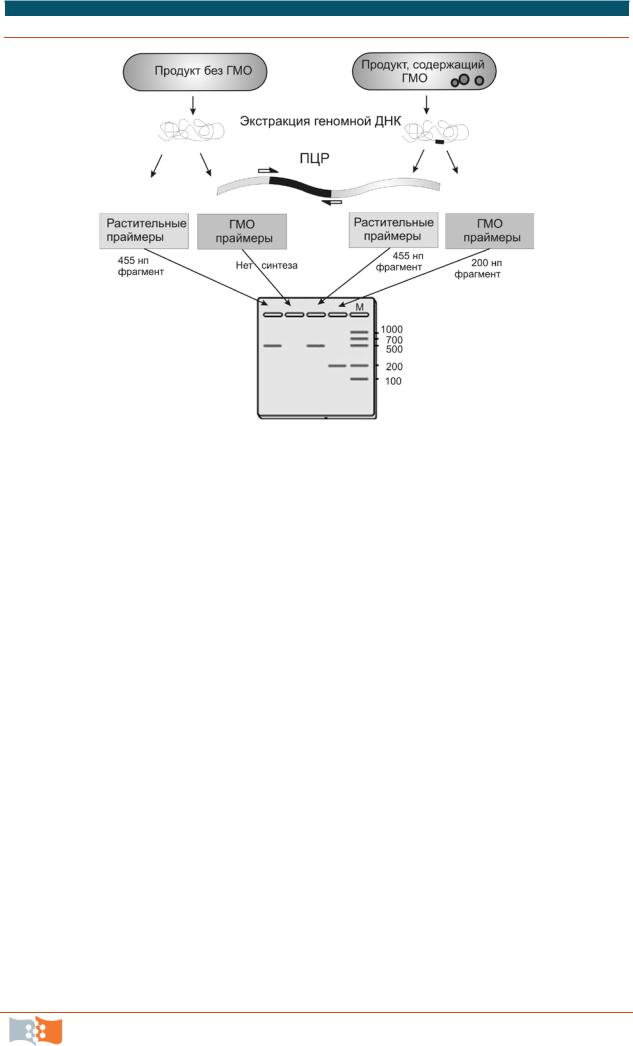
ПЦР-анализ основан на поиска последовательностей, общих для большинства генно-модифированных организмов. На рис. 2.4 схематически показано, как с помощью ПЦР проводится определение ГМО. При этом используют специфические праймеры, которые комплементарны характерным участкам в геноме ГМО. Генетики используют практически одни и те же регуляторные участки (промотор и терминатор транскрипции) для контроля экспрессии вставленного гена.
Для получения ГМ растений используют, как правило, 35S промотор вируса мозаики цветной капусты (CaMV), который присутствует во всех известных и выращиваемых в промышленных масштабах ГМО и ДНК NOS терминатора T1 плазмиды почвенной бактерии Agrobacterium tumefaciens, который также присутствует во многих промышленно выращиваемых ГМрастениях.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
98 |
РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.4. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИСУТСТВИЯ ГМО В ПРОДУКТАХ ПИТАНИЯ МЕТОДОМ ПЦР
Рис. 2.4. Определение наличия ГМО в продуктах с помощью ПЦР. М – маркеры молекулярных весов
В данной работе используются праймеры, комплементарные именно этим последовательностям. Размеры ДНК, которые при этом синтезируются – 200 тыс. п.о. Чтобы проконтролировать, что экстрагированная из тестового образца ДНК содержит гены растительных белков, в работе предусмотрена контрольная ПЦР с «растительным» праймером к гену хлоропласта PSII. Размер синтезируемого при этом фрагмента – 455 тыс. п. о.
 Материалы и оборудование
Материалы и оборудование
1.Набор реагентов для проведения анализа GMO-Investiator kit #166-2500EDU (BioRad), включающий: сертифицированный контрольный ГМО-отрицательный образец; контрольный ГМОположительный образец; смесь для проведения ПЦР Master mix; смесь ГМО праймеров; смесь Plant PSII праймеров; набор маркерных ДНК; краситель для гелей Orange G;сорбент, хелатирую-
щий ионы Mg2+ (InstaGene™ matrix).
2.Образец продукта для исследования.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
99 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.4. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИСУТСТВИЯ ГМО В ПРОДУКТАХ ПИТАНИЯ МЕТОДОМ ПЦР
3.Набор пластиковой посуды: микропробирки 1,5 мл, пробирки для ПЦР 0,2 мл, наконечники для набора растворов, наконечники
сфильтрами.
4.Комплект автоматических пипеток, штативы.
5.ПЦР-бокс для стерильных работ с УФ-рециркулятором производства «BioSan».
6.Микроцентрифуга для пробирок «Eppendorf» 5417R c ротором для микропробирок 1,5-2 мл.
7.Лабораторный шейкер-вортекс «Вортекс V-1» фирмы BioSan.
8.Градиентный термоциклер для амплификации нуклеиновых кислот «MJ Mini» фирмы «Био-Рад» (США).
9.Градиентная реал-тайм ПЦР система «Chromo4» фирмы «БиоРад» (США) для проведения ПЦР в реальном времени.
10.Оборудование для горизонтального ДНК гельэлекторфореза фирмы «Bio-Rad» (США): источник постоянного тока «PowerPac HV Power Supply» и «Sub-Cell GT» камеры с зали-
вочными столиками.
11.Водяная баня-термостат WB-4MS фирмы «BioSan».
12.Система видеодокументирования гелей «Molecular Imager Gel Doc XR» производства «Bio-Rad» (США) с трансиллюминатором.
 Характеристики оборудования
Характеристики оборудования
 ПЦР-боксдлястерильныхработсУФ-рециркуляторомUVC/T-AR «Biosan»
ПЦР-боксдлястерильныхработсУФ-рециркуляторомUVC/T-AR «Biosan»
ПЦР-бокс для стерильных работ с УФ-рециркулятором UVC/T-AR «Biosan», оборудованный открытой УФ-лампой и УФ-проточным рециркулятором (рис. 2.5), предназначен для стерильных работ, а также работ, чувствительных к РНК- и ДНК-контаминациям, например, постановка реакций амплификации. Закрытый проточный УФ-рециркулятор позволяет осуществлять не только прямую УФ-обработку рабочей поверхности бокса, но также постоянную УФ-обработку воздушного пространства бокса, что рекомендуется при работе с опасными инфекционными и вирусными материалами.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
100 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.4. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИСУТСТВИЯ ГМО В ПРОДУКТАХ ПИТАНИЯ МЕТОДОМ ПЦР
Рис. 2.5. Внешний вид ПЦР-бокса для стерильных работ с УФ-рециркулятором фирмы «BioSan»
Технические характеристики
Освещение и обеззараживание: лампа дневного света 15 Вт и УФлампа 25 Вт без озона, УФ-рециркулятор, состоящий из УФ-лампы 25 Вт, вентилятора и антипылевого фильтра, заключенных в специальный корпус для защиты рабочей поверхности во время работы.
Длительный срок службы УФ-ламп до 8000 ч.
Автоматическое выключение УФ ламп в случае открытия передней дверцы.
Цифровой таймер на 1 мин – 24 ч/постоянно.
Вес не более 26 кг, внешние размеры 690x515x555 мм. Низкий уровень шума и энергопотребления.
 Градиентныйтермоциклердляамплификациинуклеиновых кислот«MJ MiniCycler»
Градиентныйтермоциклердляамплификациинуклеиновых кислот«MJ MiniCycler»
Градиентный термоциклер для амплификации нуклеиновых кислот «MJ MiniCycler» фирмы «Био-Рад» является компактным персональным 48луночным прибором для амплификации нуклеиновых кислот (ПЦР) (рис. 2.6). Технология температурного градиента позволяет одновременно инкубировать образцы при восьми различных температурах, что делает возможным оптимизацию условий ПЦР за одну реакцию для достижений максимальной
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
101 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.4. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИСУТСТВИЯ ГМО В ПРОДУКТАХ ПИТАНИЯ МЕТОДОМ ПЦР
эффективности реакции и точности количественного определения. Блок для образцов размером 6х8 может вмещать до 48 пробирок 0,2 мл, стрипы, 48луночные планшеты и до 12 пробирок 0,5 мл.
Рис. 2.6. Внешний вид градиентного термоциклера «MJ Mini» фирмы «Био-Рад»
Технические характеристики
Вмещаемое количество образцов: 48х0,2 мл пробирки, 0,2 мл 48луночные планшеты, 6х8 0,2 мл стрипы или 12х0,5 мл пробирки.
Диапазон инкубационных температур 0-99 °С, точность ±0,2 °С при достижении программируемой температуры в 90°С.
Скорость изменения температуры до 2,5°С в с.
Равномерность поддерживаемых температур не более ±0,4 °С между лунками в пределах 10 секунд при программируемом достижении 90 °С.
Диапазон температурного градиента 35-99 °С с возможными пределами изменений 1–16 °С.
Точность поддержания температурного градиента ±0,4 °С между лунками одного ряда при достижении программируемой цели в конце ряда температур.
Равномерность поддерживаемых градиентных температур не более ±0,4°С между лунками одного ряда пределах 30 секунд при достижении целевой температуры.
ЖК дисплей 64х128, 2 USB входа.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
102 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.4. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИСУТСТВИЯ ГМО В ПРОДУКТАХ ПИТАНИЯ МЕТОДОМ ПЦР
Память на 400 типовых программ.
 Градиентнаяреал-таймПЦР-система«Chromo4» фирмы «БиоРад»
Градиентнаяреал-таймПЦР-система«Chromo4» фирмы «БиоРад»
Градиентная реал-тайм ПЦР-система «Chromo4» фирмы «Био-Рад» предназначена для амплификации ДНК с оценкой результатов в реальном времени для количественного определения матриц с возможностью детекции до четырех мишеней в одном образце. Оптический детектор флюоресцентных проб «Chromo4» установлен на базе градиентного термоциклера «DNA Engine PTC-200» с встроенным 96-луночным модулем для образцов. Система укомплектована управляющим настольным компьютером с интегрированным программным обеспечением для анализа результатов и принтером (рис. 2.7).
Рис. 2.7. Внешний вид градиентной реал-тайм ПЦР системы «Chromo4» фирмы «Био-Рад» для количественного определения молекул нуклеиновых кислот в образцах
Технические характеристики
Вмещаемое количество образцов: 96 штук пробирок 0,2 мл, один 0,2 мл 96-луночный планшет или 12 штук 8-пробирочных стрипов 0,2 мл с объемом одного образца 10–100 мкл (20 мкл рекомендуется).
Диапазон инкубационных температур 0–105 °С, точность ±0,3 °С при достижении программируемой температуры в 90 °С.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
103 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.4. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИСУТСТВИЯ ГМО В ПРОДУКТАХ ПИТАНИЯ МЕТОДОМ ПЦР
Скорость изменения температуры до 3°С в с.
Равномерность поддерживаемых температур не более ±0,4 °С между лунками в пределах 30 с при программируемом достижении 90 °С.
Диапазон температурного градиента 30-105 °С с возможными пределами изменений 1-24 °С.
Точность поддержания температурного градиента ±0,4°С между лунками одного ряда при достижении программируемой цели в конце ряда температур.
Равномерность поддерживаемых градиентных температур не более ±0,4°С между лунками одного ряда пределах 30 секунд при программируемом достижении 90°С.
Диапазон возбуждения флюоресценции: канал 1 – 450-490 нм, канал 2
– 500–535 нм, канал 3 – 555-585 нм, канал 4 – 620-6500 нм.
Диапазон детекции флюоресценции: канал 1 – 515-530 нм, канал 2 – 560–580 нм, канал 3 – 610-650 нм, канал 4 – 675-730 нм.
Память на 400 типовых программ.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 2.4.1. Экстракция ДНКиз образцов и постановка ПЦР
Внимание! Работы с генетическим материалом и при постановке ПЦР требуют специальных условий:
1.Все работы проводятся в перчатках, спецодежде (лабораторные ха-
латы).
2.В лаборатории нельзя есть, пить, курить, разговаривать над открытыми пробирками.
3.До и после проведения работ необходимо тщательно вымыть руки.
4.Обо всех нестандартных ситуациях необходимо немедленно уведомить преподавателя.
Порядок выполнения работы
1.Подписать две микропробирки 1,5 мл «non-ГМО» и «Тест».
2.Отобрать 0,5–2 г «non-ГМО» образца, перенести в ступку, добавить по 5 мл дистиллированной воды на каждый грамм образца.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
104 |

РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
РАБОТА 2.4. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИСУТСТВИЯ ГМО В ПРОДУКТАХ ПИТАНИЯ МЕТОДОМ ПЦР
3.Растереть образец пестиком в течение 2х мин до получения однородной массы.
4.Добавить еще 5 объемов воды и снова растереть массу пестиком.
5.В пробирку»non-ГМО» внести 500 мкл InstaGene™ matrix и 50 мкл полученной после растирания массы, закрыть пробирку.
6.Повторить п.п. 2–4 для приготовления тестового образца.
7.В пробирку «Тест» внести 500 мкл InstaGene™ matrix и 50 мкл полученной после растирания тестового образца массы, закрыть пробирку.
8.Тщательно перемешать пробирки на шейкере и поместить в водяную баню на 95 °С на 5 мин.
9.Поместить пробирки в центрифугу и центрифугировать в течение 5 минут на максимальной скорости. Супернатант содержит ДНК экстракт.
10.Пронумеровать пробирки для ПЦР 1-6. Содержимое каждой пробирки указано в табл. 2.6.
11.Поместить все пробирки на лед.
12.В каждую пробирку поместить по 20 мкл соответствующей смеси Master mix, каждый раз используя свежий наконечник.
13.Соответственно надписи внести в пробирки образцы ДНК из пункта 9 (Осторожно! Нас интересует только супернатант!) и перемешать тщательно пипетированием.
|
|
|
|
Таблица 2.6 |
|
|
|
|
|
|
|
№ |
|
Смесь реагентов для ПЦР Master mix |
|
ДНК |
|
|
|
|
|
|
|
1 |
20 |
мкл растительной Мм (зеленая) |
20 |
мкл, «non-ГМО» образец |
|
|
|
|
|
|
|
2 |
20 |
мкл ГМО Мм (красная) |
20 |
мкл, «non-ГМО» образец |
|
|
|
|
|
|
|
3 |
20 |
мкл растительной Мм (зеленая) |
20 |
мкл, «тест» образец |
|
|
|
|
|
|
|
4 |
20 |
мкл ГМО Мм (красная) |
20 |
мкл, «тест» образец |
|
|
|
|
|
|
|
5 |
20 |
мкл растительной Мм (зеленая) |
20 |
мкл, «+ГМО» образец |
|
|
|
|
|
|
|
6 |
20 |
мкл ГМО Мм (красная) |
20 |
мкл, «+ГМО» образец |
|
|
|
|
|
|
|
14. Включить термоциклер по заданной программе (табл. 2.7), после нагрева термоблока до температуры денатурации поставить прибор на паузу и быстро поместить в него пробирки:
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
105 |
