
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
•RHCO: 50 мкл спиртового раствора алифатического альдегида разбавить 5 мл воды.
Задание 9.1.2. Методика регистрации биферментной биолюминесцентнойреакции и расчет кинетических параметров
Порядок выполнения работы
1)Активность растворимой биферментной системы НАДН:ФМН- оксидоредуктаза-люцифераза определяется по величине максимальной интенсивности свечения Imax, выраженной в милливольтах, в реакционной смеси следующего состава: 5 мкл раствора ферментов; 50 мкл 0,002 % раствора тетрадеканаля; 50 мкл 0,5 мМ раствора ФМН; 200 мкл 0,05 М калийфосфатного буфера, рН 6,8; 200 мкл 0,4 мМ раствора НАДН.
2)В кювету биолюминометра вносят последовательно все компоненты реакционной смеси, быстро перемешивают, помещают кювету в биолюминометр и регистрируют величину максимальной интенсивности свечения
Imax.
Задание 9.1.3. Определение константы Михаэлиса. Специфичность
Определение максимальной скорости и кажущейся константы Михаэлиса проводят в координатах Лайнуивера-Берка (рис. 9.4). Изменение константы Михаэлиса (Кm) по альдегиду для всех бактериальных люцифераз зависит, главным образом, от длины цепи альдегида. Анализ констант Михаэлиса по отношению к соответствующим субстратам (или их аналогам) под действием различных эффекторов или изменений физико-химических характеристик реакционной среды может дать информацию, например, о потере ферментативной специфичности. Если же Кm изменяется в пределах одного порядка, это значит, что внешние факторы не влияют на сродство фермента.
Кажущиеся константы Михаэлиса (Km каж) для растворимой и иммобилизованной биферментной системы определяется из анализа зависимостей скорости реакции от концентрации субстратов, например, в координатах Иди-Хофсти. Скорость биферментной реакции определяется по интенсивности свечения.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
420 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
Порядок выполнения работы
1.Получить у преподавателя лиофилизированный препарат бактериальной люциферазы одного из видов светящихся бактерий и препарат растворимой биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза. Выбрать из предложенного ряда несколько альдегидных субстратов, основываясь на их физико-химических свойствах. Обоснуйте свой выбор исходя из теоретических представлений о влиянии свойств субстратов на изменение сродства люциферазы к этим субстратам.
2.Приготовить рекомендуемые концентрации ферментативных препаратов, субстратов.
3.Получить кинетические профили моноферментной биолюминесцентной реакции и растворимой биферментной системы НАДН:ФМН- оксидоредуктаза-люцифераза при использовании альдегидных субстратов с разной длиной алифатической цепи (например, С10, С12 и С14).
4.Рассчитать по полученным экспериментально профилям кинетические параметры биолюминесцентной реакции: интенсивность свечения, константу спада светоизлучения, квантовый выход моноферментной биолюминесцентной реакции и растворимой биферментной системы НАДН:ФМН- оксидоредуктаза-люцифераза. Сравнить и объяснить полученные результаты.
5.Проверить справедливость кинетики Михаэлиса–Ментен для бактериальной биолюминесцентной реакции по отношению ко всем альдегидным
субстратам (С10, С12, С14) и FMNH2.
6.Определить графически константу Михаэлиса Кm и максимальную скорость реакции Vmax по субстратам (С10, С12, С14) и FMNH2 моноферментной биолюминесцентной реакции и растворимой биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза. Сравнить полученные значения с теоретически рассчитанными. Сделать вывод о специфичности биолюминесцентных систем по отношению к альдегидам с разный длиной цепи.
7.Рассчитать отношение kcat к Км. Сделайте вывод об эффективности биолюминесцентной реакции по отношению к соответствующим альдегидам моноферментной биолюминесцентной реакции и растворимой биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза.
8.Оценить связь полученных кинетических параметров биолюминесцентной реакции с длиной цепи альдегидного субстрата.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
421 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.1. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ НА ПРИМЕРЕ БАКТЕРИАЛЬНЫХ БИОЛЮМИНЕСЦЕНТНЫХ СИСТЕМ
 Контрольные вопросы
Контрольные вопросы
1.В чем отличие ферментов от остальных белков?
2.Почему важна жесткость молекулярной структуры фермента при его
работе?
3.Каковы преимущества ферментативного катализа перед обычным химическим катализом?
4.Объясните понятие стационарной кинетики.
5.Каким образом фермент отличает специфический субстрат от друго-
го?
6.Поясните смысл отношения kkat/Km.
7.Дайте характеристику бактериальных биолюминесцентных систем различной сложности.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
422 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА9.2. ОПРЕДЕЛЕНИЕКИНЕТИЧЕСКИХПАРАМЕТРОВИТИПОВ ВЗАИМОДЕЙСТВИЯФЕРМЕНТОВСЭФФЕКТОРАМИ
Многие соединения могут влиять на обмен веществ, модулируя активность соответствующих ферментов. Особенно важные функции при этом выполняют различного рода эффекторы (активаторы или ингибиторы) ферментов. Ингибиторами ферментов могут быть, например, многие лекарственные вещества природного или синтетического происхождения, а также метаболиты в процессах регуляции и др. Понять механизмы структурных изменений, которые происходят при образовании фермент-субстратного комплекса, а также комплексов ферментов с ингибиторами или аналогами субстратов позволяют методы формально-кинетического анализа, основы которых и предлагается освоить студентам в данной работе на примере бактериальной биолюминесцентной реакции in vitro.
 Цель лабораторной работы
Цель лабораторной работы
•определение кинетических параметров бактериальной биолюминесцентной реакции и типов взаимодействия люциверазы с эффекторами
 Краткие теоретические сведения
Краткие теоретические сведения
Если экспериментальные зависимости скорости биолюминесцентной реакции от концентрации альдегида С14 не выходят за рамки кинетики Ми- хаэлиса-Ментен, то они представляют собой кривые с насыщением по субстрату (рис. 9.7). Это значит, что в ходе ферментативной реакции образуется тот или иной тип фермент-субстратного комплекса, и скорость реакции в этом случае зависит от концентрации этого комплекса.
Биолюминесцентная вспышка представляет собой нестационарный процесс. Для кинетического анализа в этом случае используется максимальная интенсивность, при достижении которой, количество образовавшегося фермент-субстратного комплекса равно количеству распавшегося и концентрации субстратов являются насыщающими, поэтому нами были применены классические методы линеаризации уравнения Михаэлиса-Ментен. В общем случае эффектор может иметь несколько точек приложения своего действия: он может связываться не только с ферментом и субстратом, но и с ферментсубстратным комплексом.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
423 |
РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
Рис. 9.7. Гиперболические зависимости интенсивности свечения люциферазы от концентрации субстрата при конкурентном ингибировании
Сопоставление динамики кинетических параметров биолюминесценции с физико-химическими характеристиками вводимых в реакционную смесь эффекторов позволяет получить информацию о том, за счет каких взаимодействий происходит образование и распад фермент-субстратного комплекса люцифераз с субстратами, и расширить представления о самом ферменте и механизмах биолюминесценции.
Согласно «классической» концепции ингибирование может быть конкурентным, неконкурентным, бесконкурентным или смешанным. Для определения типов ингибирования при фиксированных насыщающих концентрациях одного из субстратов регистрируется кинетика реакции при разных концентрациях другого субстрата. Тип ингибирования, так же как и значения кинетических констант, обычно определяет графически. При графическом представлении Vo обозначает начальную скорость реакции с нативным ферментом, Vi – начальную скорость реакции, катализируемой ингибированным ферментом.
Использование различных графических методов позволяет более достоверно определить тип взаимодействия и конкретные кинетические параметры, так как в ряде случаев из-за разброса экспериментальных данных определенные одним методом типы взаимодействия вызывают сомнения.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
424 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
С кинетической точки зрения Диксон подразделил каждый тип ингибирования на два: полностью, например, конкурентное ингибирование и неполностью конкурентное ингибирование. Как полностью, так и неполностью конкурентное ингибирование качественно дают одни и те же графики в перечисленных выше координатах. Примеры определения линейных типов ингибирования приведены ниже.
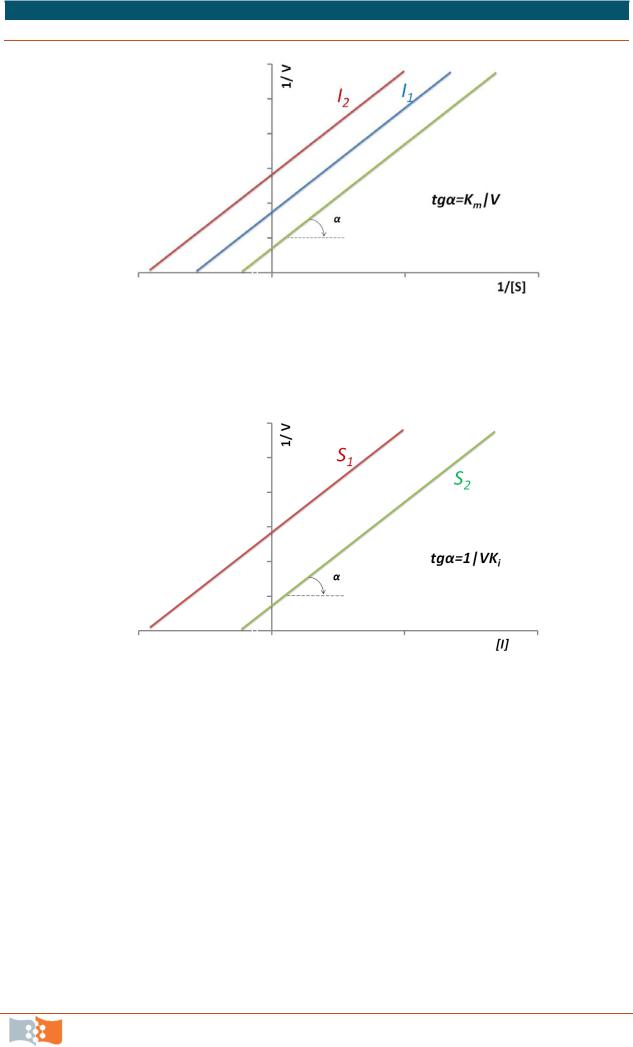
1. Конкурентное ингибирование
Координаты Иди-Хофсти для конкурентного ингибирования (или активации) дают пересекающиеся вблизи оси ординат прямые, что также согласуется с конкурентным типом ингибирования (рис. 9.8).
Рис. 9.8. Графическое представление конкурентного ингибирования в координатах
Лайнуивера-Берка
Построение графиков в координатах Хейнса дает приблизительно параллельные друг другу прямые, которые также соответствуют конкурентному типу ингибирования (рис. 9.9).
При конкурентном типе ингибирования ингибитор увеличивает значение Кm, не оказывая влияния на максимальную скорость Vmax. При достаточно высокой концентрации субстрата [S] ингибитор вытесняется молекулами субстрата из комплекса фермент-ингибитор EI. В присутствии конкурентного ингибитора изменяется только Km, но не Vmax.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
425 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
Рис. 9.9. Графическое представление конкурентного ингибирования в координатах Хейнса
2. Неконкурентное ингибирование
При неконкурентном ингибировании ингибитор снижает величину максимальной скорости (рис. 9.10).
|
1,2 |
V |
|
|
|
|
1 |
1/ |
1/V |
|
|
|
|
|
|
||
|
|
|
i |
|
|
|
0,8 |
|
|
|
|
|
0,6 |
|
|
|
|
|
0,4 |
|
|
|
|
|
0,2 |
|
1/Vmax |
|
|
|
0 |
|
|
|
|
-5 |
-0,2 |
0 |
|
5 |
1/[S]10 |
|
-1/Ki=-1/Km |
|
|
||
а |
|
|
|
б |
|
Рис. 9.10. Графическое представление неконкурентного ингибирования: а – зависимость Михаэлиса-Ментен; б – в координатах Лайнуивера-Берка
Наборы прямых, получаемых при линеаризации уравнения МихаэлисаМентен, в координатах Иди-Хофсти в случае полностью неконкурентного типа ингибирования – параллельные прямые представлены на рис. 9.11.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
426 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
Рис. 9.11. Графическое представление неконкурентного ингибирования в координатах Иди-Хофсти
3. Смешанное ингибирование
Наборы прямых, получаемых при линеаризации уравнения МихаэлисаМентен различными способами, при смешанном типе ингибирования, представлены на рис. 9.12.
Рис. 9.12. Графическое представление смешанного ингибирования в координатах Лайнуивера-Берка
4. Бесконкурентное ингибирование
Наборы прямых, получаемых при линеаризации уравнения МихаэлисаМентен различными способами, при бесконкурентном типе ингибирования представлены на рис. 9.13 и 9.14.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
427 |
РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
Рис. 9.13. Графическое представление бесконкурентного ингибирования в координатах Координаты Лайнуивера-Берка
Рис. 9.14. Графическое представление бесконкурентного ингибирования в координатах Диксона
Типы ингибирования линейные и нелинейные можно разделить с помощью графиков в координатах Диксона. Этот метод различает линейное конкурентное ингибирование (т. е. полностью конкурентное ингибирование), когда наклон прямых линий в координатах Лайнуивера-Берка является линейной функцией концентрации ингибитора [I], гиперболическое, параболическое и т. д. конкурентное ингибирование.
Выявить случаи нелинейного или неполностью конкурентного ингибирования позволяют также зависимости как угла наклонов, так и длины отрез-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
428 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
ков, отсекаемых на оси ординат, для графиков Лайнуивера-Берка от концентрации ингибитора. Подобный анализ, то есть построение вторичной зависимости ординат точек пересечения с вертикальной осью и наклонов прямых в координатах Лайнуивера-Берка, может дать новую информацию о механизме ингибирования. В этом случае, например, параболического конкурентного ингибирования наклон прямой линии в прямых обратных координатах умножается на множитель (1+а[I] +b[I]2), что отвечает процессу, в котором с одной молекулой фермента связывается две молекулы эффектора. Коэффициенты а и b обозначают константы. В случае неполностью конкурентного ингибирования ингибитор лишь частично блокирует субстрат связывающие группы фермента. По этой причине ингибитор не способен полностью помешать присоединению субстрата.
Типы ингибирования позволяют судить о последовательности связывания лигандов с ферментом. В случаях конкурентного и неконкурентного ингибирования ферменты могут образовывать комплекс фермент-ингибитор или фермент-активатор с эффектором. Если ингибирование – неполностью конкурентное, это значит, что эти эффекторы, являясь, например, аналогами альдегида, могут конкурировать за группы связывания субстрата на ферменте, но лишь частично блокируют субстрат связывающие группы фермента и не способны полностью помешать присоединению субстрата.
При полностью бесконкурентном типе ингибирования эффекторы способны присоединяться только к комплексу фермент-субстрат – образования фермент-ингибиторного комплекса не происходит. Образующийся при этом третичный комплекс полностью неактивен. При этом типе ингибирования эффектор действует и на участок связывания, и на каталитический центр фермента, независимо от того, перекрываются они или нет. Ингибитор снижает и константу диссоциации субстрата, и максимальную скорость реакции.
Как при бесконкурентном, так и при смешанном ингибировании ингибитор действует и на участок связывания, и на каталитический центр фермента, независимо от того, перекрываются они или нет, но увеличивает константу диссоциации субстрата и уменьшает начальную скорость. В данном случае образуется как двойной комплекс фермент-ингибитор, так и тройной комплекс ингибитор-фермент-субстрат, и оба комплекса каталитически неактивны.
Следует четко различать аспекты как активации, так и ингибирования, связанные с кинетикой и механизмом этих процессов. Тип кинетической
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
429 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
схемы не доказывает однозначно идентичность механизма активации или ингибирования с кинетическим поведением системы. В последние годы появились сомнения относительно одинаковой интерпретации какого-либо типа активации или ингибирования для всех случаев. Было показано, что связывание некоторых активаторов и ингибиторов с белком изменяет его стерическую структуру. Таким образом, в некоторых случаях причиной активирующего или ингибирующего эффектов может является изменение нативной конформации белка, а не изменение функции модифицированной группы.
Константа Михаэлиса и природа взаимодействия субстратов и люцифераз. Сродство ферментов к субстратам
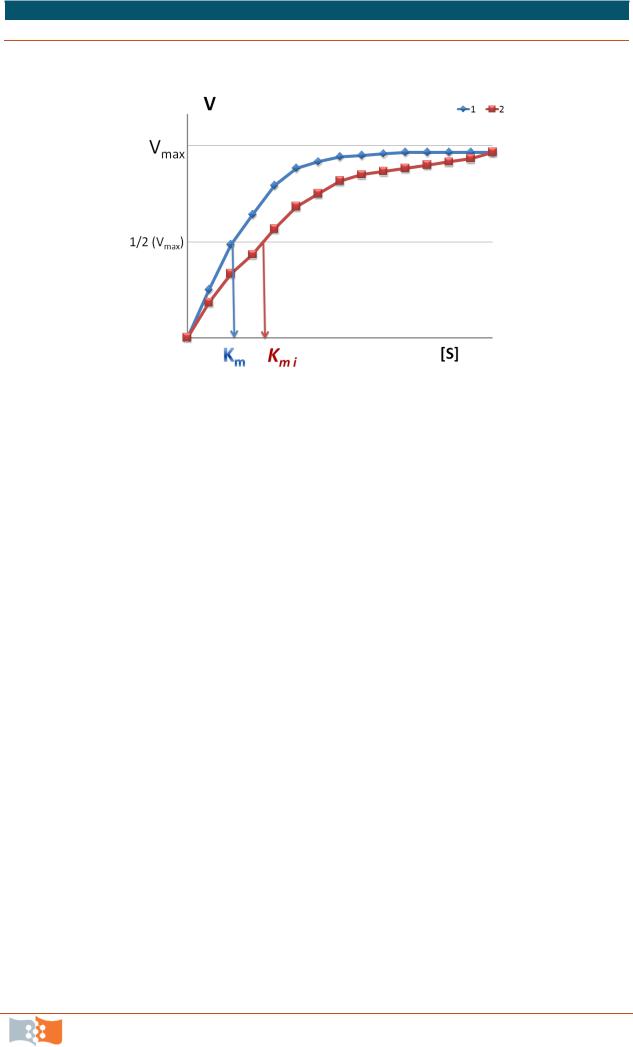
Известно, что в водной среде ферменты характеризуются различными величинами констант Михаэлиса по отношению к соответствующим субстратам (или их аналогам). Константа Михаэлиса Кm, характеризует сродство фермента к субстрату. Кm численно равна той концентрации субстрата [S], при которой скорость реакции достигает половины максимальной величины Vmax (см. рис. 9.3). Высокое сродство фермента к субстрату характеризуется низкой величиной Кm и наоборот.
Изменение константы Михаэлиса (Кm) по альдегиду для обеих люцифераз зависит, главным образом, от длины цепи альдегида. Эти различия часто превышают несколько порядков.
Исходя из известных представлений о влиянии лигандов различной природы на Кm по субстрату, можно заключить, в каком случае реализуются преимущественно гидрофобные, а с каким из субстратов – электростатические взаимодействия между люциферазой и субстратами. А также оценить изменение сродства люциферазы к субстратам при различных концентрациях эффекторов. При проведении катализа, например, в водно-органических средах значения Кm некоторых ферментов становятся приблизительно равными, то есть происходит потеря ими ферментативной специфичности. Если величина Кm для данного фермента не изменяются в пределах одного порядка при введении в реакционную среду эффектора, это значит, что изменение микроокружения фермента не влияет на его специфичность.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
430 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
 Материалы и оборудование
Материалы и оборудование
Лиофилизованные препараты высокоочищенных ферментов, произведенные в лаборатории бактериальной биолюминесценции Института биофизики СО РАН (Красноярск). Один флакон лиофилизованного препарата содержит 0,4 мг/мл люциферазы (L) EC 1.14.14.3 из рекомбинантного штамма E.coli и 0,18 ед.активности НАДH:ФМН-оксидоредуктазы (R) EC 1.5.1.29 (Photobacterium leiognathi). Перед измерениями лиофилизованные ферменты растворяют в 0,05 М калий фосфатном буфере (рН 6,8).
Для исследования кинетики моноферментной реакции в работе могут быть использованы люциферазы из Photobacterium leiognathi (штамм 208), Vibrio harveyi (штамм 1212) и рекомбинантного штамма Е.coli, высокоочищенные методами ионообменной хроматографии и гель-фильтрации в лаборатории бактериальной биолюминесценции ИБФ СО РАН.
Реактивы: НАДH и ФМН фирмы «Serva» (Германия), тетрадеканаль фирмы «Merck» (Германия). Для приготовления растворов необходимо использовать 0,05 М калий фосфатный буфер (рН 6,8).
В качестве альдегидного субстрата необходимо приготовить растворы длинноцепочечного алифатического альдегида тетрадеканаля (С14) (Merck, ФРГ) – RHCO: 50 мкл спиртового раствора алифатического альдегида разбавить 5 мл воды. В качестве второго субстрата реакции используется фотовосстановленный флавинмононуклуотид (FMNН2) (Sigma, США): FMNH2: 4,5 мг FMNH2 разбавлялись до 10 мл воды и 10мМ ЭДТА.
1.Измерения проводят при температуре 250С на следующем оборудовании: мультимодальном планшетном ридере LB 941 TriStarI(Berthold Technologies, Германия) (рис. 9.6), жидкостной циркуляционный термостат VT-8 (Термэкс-2, Россия), (рис. 9.5) , рН-метр МР 220 Meter (METLER TOLEDO, США), автоматические пипетки.
 Характеристики оборудования
Характеристики оборудования
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
431 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
 Мультимодальныйпланшетныйридер
Мультимодальныйпланшетныйридер
Мультимодальный планшетный ридер LB 941 TriStar I (Berthold Technologies, Германия), используемый для измерения поглощения и проведения широкого круга работ. Возможна установка до четырех инжекторов. Гибкость прибора в сочетании с оптимизацией под необходимый режим измерения, дают превосходные результаты. Dedicated Optical Path System (DOPS) – специализированная оптическая система, специально разработанная для приборов этого класса. Понятное устройство прибора, простота обслуживания и управления, легкость обработки данных при помощи программного обеспечения Mikrowin 2000.
Технические характеристики
Температурный контроль от 5 до 40 °С. Включает термоэлектрический охладитель для стабилизации фотокатода.
Режимы измерения:
•абсорбция;
•люминесцентные вспышки (flash);
•люминесцентное свечение (glow);
•сolour люминесценция (Сhroma-gloтм);
•BRET;
•флуоресценция;
•считывание, FRET сверху (top reading).
Характеристики считывания: Люминесценция
•предел обнаружения < 20 аттомоль (10–8 моль) ATP;
•Спектральный диапазон 340–650нм;
•флуоресценция предел обнаружения < 20 фемтоМоль (10-15 моль);
•Флюоресцеин.
Абсорбция (поглощение)
•Спектральный диапазон 340-700нм. 0 – 3,5 OD при 400-700нм (0-3OD при 340нм);
•Точность c. v. 0,6% при 2,5 OD.
Детектор – ФЭУ (флюоресценция, люминесценция). Низкошумовой фотокатод, цифровой счетчик фотонов. Кремниевый фотодиод (абсорбция). Длина волны 200–1000 нм.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
432 |

РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
РАБОТА 9.2. ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ И ТИПОВ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТОВ С ЭФФЕКТОРАМИ
Источник излучения галогеновая лапма (75W, длина волны 340-700 нм), среднее время жизни более 300 ч.
Динамический диапазон – > 6 порядков величины.
Рис. 9.6. Мультимодальный планшетный ридер
TriStar LB 941(фирма Berthold Technologies, Германия)
Программное обеспечение MicroWin Lite-MicroWin Lite позволяет задавать время считывания, объем инъекции, определенные последовательности для чтения, осуществлять долговременный и кратковременный кинетический контроль, графическое представление данных и их статистическую обработку. Возможность экспорта данных в виде файла (в том числе в формате LAN) и их вывода на печать.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 9.2.1. Проверка применимости классических методов линеаризацииуравнения Михаэлиса-Ментен к ферментативной реакции
Порядок выполнения работы
1. Получить у преподавателя лиофильно высушенный препарат бактериальной люциферазы одного из видов светящихся бактерий. Выберите из
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
433 |
