
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
 Краткие теоретические сведения
Краткие теоретические сведения
Использование клеточных культур и клеточных технологий относится к одному из наиболее актуальных направлений современных биотехнологии. Культуры клеток используют для производства биологических материалов, предназначенных для получения целевых макромолекул и технологий тканевой инженерии. В культурах клеток можно варьировать условия среды, обеспечивая получений необходимых количеств клеточной массы требуемой дифференцировки.
Клеточные культуры активно используют для тестирования биологической безопасности новых материалов, биологически активных и лекарственных веществ. Особое направление применения клеточных культур – тканевая инженерия. Следует подчеркнуть, что наиболее важным элементом успеха тканевой инженерии является наличие необходимого количества функционально активных клеток, способных дифференцироваться, поддерживать соответствующий фенотип и выполнять конкретные биологические функции. Клетки в ходе дифференцировки должны продуцировать внеклеточный матрикс (в его основе белки, в частности коллаген) соответствующей организации и структуры, выделять цитокины и другие сигнальные молекулы, а также взаимодействовать с соседними клеткам или тканями. В связи с этим возникает необходимость создания адекватных условий для роcта и дифференцировки клеток in vitro.
Изучение механизмов регенерации тканей и органов, поиск новых технологий, которые могли бы восстановить утраченную функцию органа или системы, привели к появлению новых направлений, возникших на стыке биотехнологии и медицины – тканевой инженерии (регенеративной меди-
цины и органогенеза). Эти науки изучают создание органов и тканей de novo. В их основе лежит принцип использования функционирующих клеток, трансплантируемых в места дефектов. Будущее медицины сегодня напрямую связывают с развитием клеточных технологий, которые позволяют, не меняя поврежденный орган, «обновлять» его клеточный состав. Такое «обновление» структурно-функциональных элементом органа, позволяет решать те же задачи, что и органная трансплантация. Вместе с тем, эта технология намного
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
109 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
расширяет возможности трансплантационного лечения, делая его доступным для широкого круга разных категорий пациентов. Основой для развития новейших реконструктивных технологий являются функционирующие клетки, способные в зависимости от микроокружения формировать ткани разных типов. Список болезней, лечении которых возможно с применением клеточных технологии, быстро растет.
Клеточные технологии включают различные подходы и методы, среди которых следующие:
•получение клеток, свободных от микробной контаминации;
•возможность роста и развития клеток, выделенных из различных тканей и органов;
•совершенные методы оценки состояния клеток в культуре их динамики, в том числе в условиях проточной культуры.
Список типов клеток, которые введены в культуру, достаточно велик. Это элементы соединительной ткани человека (фибробласты), скелетные ткани (кость и хрящи), скелетные, сердечные и гладкие мышцы, эпителиальные ткани (печень, легкие, почки и др.), клетки нервной системы, эндокринные клетки (надпочечники, гипофиз, клетки островков Лангерганса), меланоциты и различные опухолевые клетки. Популяция клеток, однако, не всегда гомогенна и обладает фиксированным фенотипом. Некоторые культуры, например, кератиноциты эпидермиса, содержат стволовые клетки, клеткипредшественники и кератинизированные чешуйчатые клетки. В такой культуре происходит постоянное обновление за счет стволовых клеток, пролиферация и созревание клеток-предшественников, а также необратимая дифференцировка, сопровождающаяся «слущиванием» чешуйчатых клеток в культуральную среду.
Наиболее важным элементом успеха клеточных технологий и тканевой инженерии является наличие необходимого количества функционально активных клеток, способных дифференцироваться, поддерживать соответствующий фенотип и выполнять конкретные биологические функции. Клетки в ходе дифференцировки должны продуцировать внеклеточный матрикс (в его основе белки, в частности, коллаген) соответствующей организации и структуры, выделять цитокины и другие сигнальные молекулы, а также взаимодействовать с соседними клеткам или тканями. В связи с этим, возникает первая Задание тканевой инженерии – поиск и наличие стабильного и доступного источника функционально активных клеток. Источником клеток в
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
110 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
принципе могут быть ткани организма и внутренние органы. Возможно использовать соответствующие клетки от пациента, нуждающегося в реконструктивной терапии, или от близкого родственника, то есть использовать аутогенные клетки. Например, для реконструкции сустава конкретного лица можно использовать хондроциты, ему же и принадлежащие. Возможно применение неспецифических типов клеток, например, фибробластов кожи для конструирования тканеинженерных клапанов сердца.
В клеточных технологиях реконструктивной медицины потенциально могут быть использованы различные типы клеток различного происхождения, в том числе первичные клетки и стволовые клетки.
Первичные клетки – это зрелые клетки определенной ткани. Такие клетки могут быть выделены из организма-донора в процессе хирургического вмешательства. Однако первичные клетки, как правило, являются дифференцированными неделящимися клетками, то есть не способными делиться, или их потенциал к размножению и росту низок. При культивировании таких клеток in vitro возможно проявление тенденции некоторых типов клеток к дедифференцировке при их культивации, в результате которой клетки теряют соответствующий фенотип. Так, хондроциты при ведении в культуру вне организма весьма часто продуцируют фиброзный, а не прозрачный хрящ. Эти негативные тенденции и проявления, присущие первичным клеткам, показали необходимость поиска альтернативных источников клеток для развития технологий клеточной инженерии. Такой альтернативой стали стволовые клетки.
Стволовые клетки – недифференцированные клетки, способные делиться, самообновляться и дифференцироваться в один или более типы специализированных клеток. Различают «взрослые» стволовые клетки и «эмбриональные» стволовые клетки. Главное направление современных исследований стволовых клеток – нахождение факторов стимуляции и условий выращивания для дифференцировки стволовых клеток в необходимые типы клеток. Для получения конкретного типа тканей прежде всего необходимо произвести подбор наиболее подходящей стволовой клетки для формирования необходимой ткани.
С наращиванием знаний в области изучения стволовых клеток происходит определенный пересмотр определения стволовых клеток как «недифференцированных клеток». Это связано с тем, что иногда имеет место д е- дифференцировка и трансдифференцировка некоторых зрелых клеток. В связи с этим предложено определение «стволовых клеток» сделать более
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
111 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
широким и применимым к биологической функции, которую имеет определенный диапазон типов клеток, включая дифференцированные клетки, а не одна структура.
Стволовые клетки могут быть выделены из эмбрионов, зародышей, пуповинной крови, околоплодной жидкости или взрослой ткани (липосата, нозального эпителия, костного мозга), при этом диапазон типов клеток, в которые они могут дифференцироваться, колеблется. Эмбриональные стволовые клетки являются наиболее полипотентными, они могут стать самыми различными типами клеток при соответствующих условиях культивирования. Применительно к Заданием тканевой инженерии стволовые клетки в принципе могут быть неистощимым источником клеток и тканей разных типов.
Технология культивирования стволовых клеток и состав используемых сред оказывают определяющее влияние на клеточную дифференцировку. Варьируя условия культивирования стволовых клеток и меняя набор индукторов и факторов дифференцировки, можно получать культуры с конкретным фенотипом. В качестве факторов дифференцировки и индукции клеток используют цитокины, факторы роста, аминокислоты, белки, активные ионы и др. Применяют для этого также совместное выращивание стволовых клеток с целевым типом клеток или тканей, используемых в качестве своеобразного «шаблона» дифференцировки. Известны также методы сортировки клеток, в частности, сортировка клеток с флуоресцентной меткой. При использовании этих подходов из стволовых клеток, главным образом, in vitro, возможно получение фактически всех типов клеток организма.
Различают два основных типа культуры клеток: первичную культуру и культуру стабильных клеточных линий. Первичные культуры получают не-
посредственно из тканей животных и человека; культивированию подлежат маленькие кусочки тканей или отдельные клетки, полученные после обработки тканей ферментами (например, трипсином и коллагеназой). Недостатком первичных культур является то, что они стареют физиологически, при этом клетки утрачивают способность к делению и некоторые фенотипические признаки. Преимущество первичных культур – в сохранении многих первоначальных характеристик в течение всего ограниченного срока жизни. Стабильные клеточные линии могут поддерживаться в культуре в течение ограниченного числа клеточных делений или неопределенно долгий срок.
Для роста клеток, полученных из тканей, требуется прикрепление к субстрату, в то время как клетки, полученные из крови, растут во взвеси. Клетки во взвеси (в суспензионной культуре) имеют округлую форму, в то
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
112 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
время как клетки, прикрепленные к субстрату (матриксу), морфологически гетерогенны в зависимости от происхождения. После прикрепления клеток к матриксу (адгезии) они начинают делиться и размножаться, образуя плотный непрерывный слой, покрывающий матрикс. Большинство клеток, в особенности первичные клетки, контактируя с соседними клетками, прекращают рост, однако опухолевые клетки обычно имеют тенденцию к трехмерному росту с образованием множества слоев. Клетки в культуре, занимающие 7080% матрикса, в идеале можно обрабатывать трипсином, и затем пересевать часть клеток в новый флакон со свежей культуральной средой, т. е. получать субкультуры.
Культуры клеток животных и человека предъявляют определенные требования к жидкой (питательная среда), газообразной (концентрация газов) и твердой (поверхность субстрата) фазе. Для роста in vitro клеткам необходимы ростовые субстраты и факторы роста и дифференцировки. Основная культуральная среда содержит аминокислоты, глюкозу, витамины, жирные кислоты и некоторые белки, неорганические соли. Культуральная среда должна иметь заданные значения активной реакции; большинство клеток в культуре растут при рН в пределах от 7,2 до 7,4. Клетки растут в гумидной среде (в составе которой 5% СО2). Буферная система на основе бикарбоната в сочетании с атмосферным 5% СО2 поддерживает оптимальное среднее значение рН. К основной (или минимальной среде) обычно добавляется 10– 15%-ная эмбриональная телячья сыворотка (ЭТС), обогащенная белками и факторами роста. Во избежание заражения клеток бактериями и грибами в культуре клеток необходимо использовать сочетание антибиотиков и/или антигрибковых препаратов. Клетки выращиваются во влажном термостате при 37 °С (оптимальная температура) в атмосфере, содержащей 5% СО2 при поддержании условий строгой стерильности.
Для приготовления питательных сред обычно используются солевые растворы Эрла и Хенкса. Эти растворы, как и фосфатносолевой буфер Дульбекко и Фогта используются также для орошения и промывки клеток при пассировании культур, выделении клеточных линий и других манипуляциях с культурами клеток. Важным условием культивирования является осмотическое давление. Для стабилизации рН используют бикарбонатный буфер. Растворы могут содержать малое количество бикарбонатного буфера (раствор Хенкса), они предназначены для поддержания рН в плотно закрытых сосудах. В других (растворе Эрла) бикарбоната больше, они используются в системах с повышенным парциальным давлением СО2. Если культуры ведутся
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
113 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
вне СО2-инкубатора, где рН поддерживать труднее, необходимы альтернативные буферные системы. Широко применяемым буфером является HEPES 4-(2-оксиэтил)1-пиперазинэтансульфоновая кислота. HEPES легко растворим в воде, не связывает двухвалентные катионы, не цитотоксичен до концентрации 0.05М. Применяется в концентрациях 0.01 и 0.03М.
Наиболее применяемыми для ведения клеточных культур являются среды Игла (MEM, минимальная среда) и BME (основная среда). Чаще используется МЕМ. Она содержит минеральные вещества, аминокислоты (13 незаменимых), 6 водорастворимых витаминов, холин и инозит, выполняющие роль углеводородного субстрата. МЕМ используется только с сывороткой, так как в ней отсутствуют биотин, витамин В12, ионы железа и микроэлементы; ее основой служит раствор Эрла. Среда Дульбекко DME или DMEM (двойная модификация среды Игла) используется при культивировании клеток различных типов, в том числе нетрансформированных клеток и гибридом.
Среда Искова IMDM является модификацией среды Дульбекко, в нее добавлены незаменимые аминокислоты, биотин, витамин В12, селенит натрия; введен HEPES и уменьшены концентрации NaCl и NaHCO3. Эта среда бессывороточная, обычно используется для культивирования лимфоцитов и кроветворных клеток. Среда МакКоя 5А и серия сред RPMI. Среда МакКоя 5А разработана в 1958 году для поддержания клонального роста клеток карциносаркомы Уолкера 256 в присутствии сыворотки, а затем уже других первичных культур и различных клеточных линий. Обычно производится в модификации Ивката и Грейса (RPMI) и предназначена для культивирования лейкоцитов в присутствии сыворотки, часто применяется и для культивирования гибридом. Концентрация СО2 в атмосфере при культивировании 5%. Среда 199 разработана в 1950 году для культивирования фрагментов сердца из эмбриона цыпленка. Для среды характерны широкий спектр питательных веществ и невысокая их концентрация. Используется без добавок, как поддерживающая для первичных клеток, а с сывороткой как ростовая среда для быстро размножающихся клеток. Нормальные, сохраняющие специфические функции клетки на стандартных средах не размножаются (если не трансформированы). Для оптимального роста клеток обычно добавляют 5 – 20% фетальной (эмбриональной) сыворотки.
Многие клетки млекопитающих, прежде чем приступить к пролиферации и образованию клеточного монослоя, должны прикрепиться к субстрату и распластаться на нем. В связи с этим встает вопрос о подходящем материа-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
114 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
ле. В качестве субстрата в настоящее время используют различные материалы, наиболее перспективными считаются биорезрбиреумые полимерные материалы.
Используемый в тканевой инженерии междисциплинарный подход направлен на создание новых биокомпозиционных материалов для восстановления утраченных функций отдельных тканей или органов в целом. Основные принципы данного подхода заключаются в разработке и применении при имплантации в поврежденный орган или ткань носителей из биодеградирующихся материалов, которые используют в сочетании с донорскими клетками и/или с биоактивными веществами. На первом этапе получают донорские, например, мезенхимальные клетки костного мозга (или используют клетки из банка клеточных культур), далее клетки культивируют in vitro на подложке (каркасе, матриксе) (scaffold) из биодеградируемого и биосовместимого материала и затем конструкцию имплантируют в место дефекта костной ткани (рис. 3.1). Техника получения биоактивных имплантатов и биоискусственных органов включает: 1) изготовление биосовместимых и биоабсорбируемых конструкций (инкубаторов) (scaffolds) для культивирования аутологических клеток пациента или клеток, взятых из банка, 2) выращивание клеток и формирование тканей in vitro и 3) последующую имплантацию полученных конструкций пациенту.
Рис. 3.1. Методология клеточной и тканевой инженерии
Для успешной индукции тканегеза в месте имплантации необходимо создать высокую начальную концентрацию клеток (до 107–108). Простое введение суспензии клеток зачастую оказывается малоэффективным, поэтому
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
115 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
возникает серьезная проблема поиска адекватного носителя для закрепления трансплантируемых клеток в организм реципиента. Наиболее ответственным этапом использования культивированных клеток является трансплантация их в зону повреждения, которая зависит от того, какая часть клеток попадет в зону дефекта; адгезируются ли культивированные клетки на носителе, сохранят ли они активное функциональное состояние. При этом одной из сложных проблем является выбор адекватного носителя для клеток, так как для реализации своих потенций культивируемые клетки должны определенное время находиться в фиксированном к носителю состоянии. Это может быть связано с гистогенетическим свойством данных клеток проявлять свои пролиферативные свойства, будучи организованными в сложные трехмерные структуры.
Проблема, стоящая перед тканевой инженерией, заключается в том, чтобы оптимизировать выделение, размножение и дифференцировку клеток, сконструировать каркасы (матриксы) или системы доставки, способствующие поддержанию и координации роста трехмерных тканей в лаборатории. Одна из идеальных стратегий тканевой инженерии заключается в заборе стволовых клеток у пациента, дальнейшем размножении их в клеточной культуре и высеве этих клеток на матриксы. Стволовые клетки могут дать начало множеству типов специализированных зрелых клеток в результате процесса, называемого дифференцировкой, если на них воздействовать конкретными биологическими стимулами. Матриксы (каркасы) должны выступать в качестве шаблона и стимула для размножения и дифференцировки стволовых клеток в специализированные клетки, генерирующие специфическую новую ткань. Ткань может быть либо выращена на матриксах, которые после имплантации в организм хозяина постепенно, по мере роста новой ткани, полностью исчезнут (резорбируются), при этом в месте дефекта останется только новая ткань. Возможно также имплантировать «биокомпозит», состоящий из матрикса с уже частично сформированной новой тканью. Так или иначе, после имплантации тканеинженерная конструкция должна сохранить свои структуру и функции в течение периода времени, необходимого для восстановления нормально функционирующей ткани в месте дефекта и интегрировать с окружающими тканями.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
116 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА3.1. КОНСТРУИРОВАНИЕКЛЕТОЧНЫХМАТРИКСОВИЗ ТЕРМОПЛАСТИНЫХИРЕЗОРБИРУЕМЫХМИКРОБНЫХПОЛИМЕРОВ– ПОЛИГИДРОКСИАЛКАНОАТОВ
 Цель лабораторной работы
Цель лабораторной работы
•обучение технике переработки полимера (на примере ПГА) в специализированные изделия из различных фазовых состояний (порошков и расплавов).
 Краткие теоретические сведения
Краткие теоретические сведения
Идеальные матриксы, удовлетворяющие всем необходимым свойствам, к сожалению, пока не созданы и их еще предстоит разработать. При конструировании разрабатываемый матрикс следует оценивать, исходя из следующих критериев.
Во-первых, для того чтобы выполнить свою функцию (регенерировать поврежденную ткань), матрикс (каркас будущих тканей) должен иметь структуру, которая действует как шаблон или матрица для роста ткани в трех измерениях и стимулирует новый рост в форме, заданной каркасом. Конструкцией шаблона является структура, копирующая структуру ткани организмахозяина.
Во-вторых, для того, чтобы позволить ткани расти в трех измерениях, шаблон должен быть сетью больших пор (макропор). Поры должны быть соединены друг с другом, а отверстия между порами должны иметь диаметр более 100 мкм. Взаимосвязанная сеть пор необходима для того, чтобы обеспечить клеткам способность мигрировать по матриксу и способствовать росту ткани на протяжении всего шаблона. В условиях культуры клеток in vitro и роста ткани сеть пор должна обеспечивать доставку компонентов среды ко всем клеткам, снабжая их нужными питательными веществами. После того, как тканеинженерная конструкция (матрикс плюс клетки) будет имплантирована, динамика материала матрикса должна обеспечить формирование развитой по всему объему системы взаимосоединенных пор. Это необходимо для того, чтобы во всем объеме матрикса циркулировали кровь и тканевая жидкость для обеспечения клеток и тканей питательными веществами. В конечном счете, идеальные матриксы должны стимулировать рост кровеносных сосудов (ангиогенез) внутри сети пор. Так, минимальный диаметр отвер-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
117 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
стия для ангиогенеза и для вращивания кости в случаях применения инжиниринга костной ткани составляет порядка 100 мкм.
В-третьих, для создания оптимального матрикса, помимо необходимой конфигурации и пористости, следует обеспечить требуемые структуру и свойства поверхности. Функционирующие клетки должны прикрепляться к субстрату (матриксу), чтобы далее формировать свой внеклеточный матрикс. Поверхностная текстура пор нанометрического масштаба или шероховатость поверхности в нанометрическом масштабе влияют на функциональную активность клеток.
В-четвертых, необходимое свойство идеальных матриксов – это способность к биоразрушению. Продукты разрушения (распада) материала матрикса должны представлять собой нетоксичные продукты, которые выводятся из организма или метаболизируются в нем. Скорость распада матрикса должна быть контролируемой и соответствовать скорости образования новой ткани в месте дефекта. Разрушаемые полимеры и гидрогели – наиболее часто используемые материалы для изготовления резорбируемых матриксов.
В-пятых, идеальные каркасы также должны активировать клетки ткани для саморегенерации, так как они должны функционировать в качестве системы доставки и контролируемого выхода веществ, активирующих клетки. В материал матрикса можно включать биологически активные соединения, факторы роста клеток, лекарственные препараты.
В-шестых, механические свойства матрикса должны соответствовать механическим свойствам ткани организма-хозяина. Структура и прочность рассасывающихся каркасов должны также сохраняться до тех пор, пока не будет регенерировано достаточно ткани организма-хозяина.
Из биоразрушаемых полиэфиров микробиологического происхождения (ПГА) возможно получение широкого спектра изделий различных типов, используемых в медицине (пленок, мембран, волокон, пористых матриксов, микрочастиц), различными способами, в том числе из образцов полимеров, находящихся в различных фазовых состояниях. ПГА раздичного химического состава можно перерабатывать из расплавов, а также холодным прессованием, поливом из растворов, гель-технологией и др. Наличие выраженного диапазона между температурой начала плавления (150–160 оС) и температурой начала разложения (Тразл.) (260–280 оС) является существенно важным технологическим свойством полиоксиалканоатов, так как делает возможным
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
118 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
получение из них различных изделий общепринятыми термическими методами переработки полимерных материалов.
Расплавы ПГА пригодны для переработки в изделия в промышленных условиях на стандартном оборудовании в связи с тем, что их точка плавления близка к таковой у широко применяемых термопластов типа полиэтилена и полипропилена. Установлена также применимость ряда традиционных технологических процессов для переработки расплавов ПГА, включая экструзию, литье под давлением, литье с раздувом, термопереработку, ориентированное и неориентированное литье или выдувку пленок, моно- и мультифиламетное прядение волокон, вспенивание и покрытие. Твердофазная экструзия сополимерных ПГА, имеющих более низкую температуру плавления по сравнению с ПГБ, возможна ниже температуры плавления материала (135– 150оС) в зависимости от содержания гидроксивалерата в сополимере. Полученные таким образом образцы изделий, однако, не обладали выраженной ориентацией полимерной цепи по направлению экструзии. Повышение температуры экструзии близко к температуре плавления повышает качество изделий, в частности, их механическую прочность. Литье под давлением применимо для расплавов ПГА на оборудовании для полиэтилена с фильерами, имеющими соотношение длины к диаметру у форсунок 20/1. Следует, однако, учитывать время пребывания расплава в плавильной емкости с целью предотвращения термической деградации материала. Оптимальная температура процесса литья для быстрой кристаллизации полимера при минимальном времени цикла составляет 60 оС. Процесс переработки ПГА экструзионным литьем под давлением с поддувом возможен на аппаратах с одной или нескольким насадками, оборудованными фильерами для переработки полиэтилена и соотношением длины к диаметру 24/1. Данный процесс минимизирует брак в ходе переработки ПГА.
Более доступным, но не менее востребованным является способ переработки ПГА из твердофазного состояния в изделия прямым холодным прессованием. Этот метод вызывает большой интерес в настоящее время в связи с возможностью использования ПГА для получения прочных, биодеградируемых и биоактивных конструкций и имплантатов для реконструкции дефектов костных тканей. Показано, что ПГА, главным образом полигидроксибутират и сополимеры гидроксибутирата с гидроксивалератом, образуют биосовместимые композиты с различными типами гидроксиапатитов (ГАП), а добавление гидроксиапатита улучшает остеоинтегративные свойства ПГА и улучшает взаимодействие с тканями, так как физико-механические характе-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
119 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
ристики данных композитов близки костным тканям конечностей и могут быть использованы для изготовления сложных костных протезов, включая моделирование губчато-кортикальных конструкций. Остеобласты при контакте с таким гибридным материалом, проникая в пористую структуру композита, лучше закрепляются в ней и нормально пролиферируют. По мере деградации ПГА и формирования пор в матриксе композита скорость биодеградации последнего возрастает и гибридный имплантат постепенно замещается вновь образованной костной тканью. Конструкции из ПГА и композитов ПГА с наполнителями и керамиками (волластонитом, гидроксиапатитом и др.) в силу своих хороших механо-физических свойств и биодеградабельности активно исследуется в связи с перспективами применения в медицине для восстановления дефектов повреждений костей. Помимо повышения пористости, добавление волластонита или гидроксиапатита усиливает гидрофильность ПГА, делая его более пригодным для пролиферации остеобластических клеток. Добавление к ПГА или композитам ПГА с керамиками водорастворимых наполнителей типа сахарозы или хлорида натрия позволяет получать пористые конструкции высокого качества.
 Материалы и оборудование
Материалы и оборудование
1.Образцы ПГА, полученные на опытном производстве полимеров.
2.Лабораторные весы «Adventurer»™ OH–AR2140.
3.Фарфоровая ступка, шпатель, лабораторная посуда.
4.Гидроксиапатит биологический, хлорид натрия, сахароза.
5.Автоматический лабораторный пресс Сalver 3887/4SDOBOI (США).
6.Лабораторный мини-экструдер Brabender® E 19/25 D (Германия).
7.Термостат BD-115, BINDER (Германия).
8.Ультразвуковой гомогенизатор Sonicator 3000 фирмы Misonix Incor, (США)
9.Электрическая верхнеприводная мешалка Heidolph
10.Универсальная электромеханическая испытательная машина Инстрон 5565, 5KN фирмы Instron (Великобритания)
11.Термоупаковочная машины NS 1000 фирмы «Howo Gmby» (Германия)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
120 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
12. Устройство для автоматической стерилизации медицинских изделий с использованием низкотемпературных плазменных технологий стерилизацией перекисью водорода при температуре от
+ 50 до + 55 0C Sterrad NX фирмы Johnson& Johnson, США.
 Характеристики оборудования
Характеристики оборудования
 25-тонныйавтоматическийэлектрическийнастольныйпресс
25-тонныйавтоматическийэлектрическийнастольныйпресс
Calver 3887/4SDOBOI (США)
Для переработки полимеров из твердофазного состояния в изделия прямым холодным прессованием используется 25-тонный автоматический электрический настольный пресс Calver 3887/4SDOBOI (США) (рис. 3.2).
Рис. 3.2. Автоматизированный лабораторный пресс «Calver 3887/4SDOBOI»
Технические характеристики автоматического пресса Calver 3887/4SDOBOI:
Автоматический электрический настольный пресс снабжен встроенной гидравлической системой и микропроцессорным контролем операций в комплекте с пресс-формой и вакуумным насосом.
Максимальное давление, не менее 25 т; Размер рабочих (зажимных) поверхностей, диаметр в мм: 127.
Материал зажимных поверхностей: нержавеющая сталь.
Высота пресса, 1016 мм. Расстояние между зажимными пластинами, в мм, от 38,1 до 184,1. Размеры пресс-формы, в мм, 508, 812,8.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
121 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
Имеется система цифрового контроля процесса прессования, включающая в себя программирование показателей давления, скорости его нагнетания и продолжительности, количество циклов прессования, индикацию фазы процесса, автоматическое открывание защитной панели при завершении программы.
Пресс оборудован микропроцессорной сенсорной панелью для ввода параметров процесса. Система безопасности включает:
Защитный чехол с прозрачной передней панелью, закрывающийся при помощи одновременного нажатия обеих закрывающих кнопок, клапан безопасности давления, ограничитель давления, плавкий предохранитель.
Пресс-формы из нержавеющей стали, соединяемые с вакуумным насосом, диаметром 6, 12, 25, 31 и 40 мм, Вес пресса – 148 кг. Источник питания: 230 В, 50 Гц.
 Лабораторныймини-экструдерBrabender® 19/25 D
Лабораторныймини-экструдерBrabender® 19/25 D
Для переработки полимеров из расплава используется лабораторный мини-экструдер Brabender® 19/25 D, Германия (рис. 3.3).
Технические характеристики лабораторного мини-экструдера
Brabender® 19/25 D:
Экструдер включает одношнековую перерабатывающую часть, привод, контроллер температуры и скорости, шнек для измерительного экструдера, суппорт на роликах, преобразователь давления, термопару, компьютер с программным обеспечением и картой связи.
Электропотребление: 3 x 400 В/AC + N + PE, 50/60 Гц, 32 A.
Оснащён технологией CAN-open bus. Модель состоит из следующих основных частей: одношнековая перерабатывающая часть, привод контролирование температуры и скорости.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
122 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
Рис. 3.3. Лабораторный мини-экструдер Brabender® 19/25 D, Германия. Бакалавры Дмитрий Гончаров и Илья Лебедев на лабораторном практикуме
Для нагрева предусмотрены 1 нагревательная и 2 нагревательноохладительные зоны, каждая 1,300 Вт; электрический нагрев и воздушное охлаждение.
Зона питания включает цилиндрическую секцию питания, водяное охлаждение.
Загрузочный бункер имеет объём 3 л, передвигаемый на три позиции: заполнение, остановка и разгрузка бункера
Максимальное давление 700 бар; привод 1,5 кВт, инвертный двигатель максимальный крутящий момент 150 Нм4 диапазон скоростей 2 – 150 об/мин; допускаемое давление до 700 бар, температура – до 450 °C.
Размеры экструдера 960 x 700 x 825 мм. Источник питания 230 В, 50/60 Гц, 2 А.
Для работы с полимерными растворами и микронизации полимерной субстанции предусмотрены ультразвуковой гомогенизатор Sonicator 3000 фирмы Misonix Incor, США (рис. 3.4) и электрическая верхнеприводная ме-
шалка Heidolph (рис. 3.5).
 УльтразвуковойгомогенизаторSonicator 3000
УльтразвуковойгомогенизаторSonicator 3000
Технические характеристики Sonicator 3000 Misonix Incorporated:
Высокочастотный УЗ-гомогенизатор с пьезоэлектрическим преобразователем; Обеспечивает контроль амплитуды. В комплекте: проточная ячейка; загрузочной ячейки; наличие крышки для ячейки (экспоненциальный зонд); наличие крышки для 20 и 50 мл пробирок (для 9,5 мм зонда); наличие крыш-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
123 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
ки для ячейки (9,5 мм зонд); возможность работы с объемами образцов проб от 2 мл до 100 мл; наличие таймера; наличие звуконепроницаемой камеры с прозрачной дверью; наличие титанового зонда 9,5 мм наконечника.
Рис. 3.4. УЗ – Sonicator 3000 фирмы Misonix Incor
 ВерхнеприводнаямешалкаHeidolph
ВерхнеприводнаямешалкаHeidolph
Рис. 3.5. Электрические верхнеприводные мешалки Heidolph
Технические характеристики электрической верхнеприводной ме-
шалки Heidolph:
Количество редукторов – 2 Управление аналоговое;
Скоростной диапазон 1: от 35 до 250 оборотов в минуту; Скоростной диапазон 2: от 280 до 2200 оборотов в минуту;
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
124 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
Выходная мощность: 18 Ватт; Высокий крутящий момент до 100 Нсм; Вязкость до 40000 мПс; Защита от перегрева;
Кулачковый патрон для зажима вала до 8,5 мм; Класс защиты IP 20; Размер лопастей – 50 х 12 мм
Материал – нержавеющая сталь AISI 304. Длина – 400 мм.
 Универсальнаяэлектромеханическаяиспытательнаямашина Инстрон5565, 5KN
Универсальнаяэлектромеханическаяиспытательнаямашина Инстрон5565, 5KN
Для измерения физико-механических характеристик разрабатываемых полимерных матриксов используется универсальная электромеханическая испытательная машина Инстрон 5565, 5KN фирмы Instron, Великобритания
(рис. 3.6).
Рис. 3.6. Внешний вид универсальной электромеханической разрывной машины Инстрон 5565, 5KN. Instron, Великобритания
Технические характеристики универсальной электромеханической разрывной машины Инстрон 5565, 5KN:
Комплектация включает одну зону испытаний: высота до 1122 мм; ширина рабочей зоны: 420 мм; сдвоенные винтовые предварительно натянутые
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
125 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
шаровые пары приводы; хромированные колонны диаметром 45 мм; 32битная электроника управления и обработки данных с обратной связью; цифровые каналы данных по нагрузке и перемещению; автоматическое распознавание и калибровка подключаемых датчиков; выбор системы измерения для получаемых параметров; высокоточный независимый датчик нагрузки; захваты для образцов, датчик деформации. Управляющая станция, принтер и программное обеспечение.
Высокоточный независимый датчик нагрузки (типа «сэндвич»):
•уровень нагрузки +/- 5кН. Точность измерение нагрузки: 0,4% от измеряемой величины в диапазоне от 1% до 100% номинальной мощности датчика нагрузки;
•0,5% от измеряемой величины в диапазоне от 0,4% до 100% номинальной мощности датчика нагрузки. Точность позиционирования 0,05% от измеряемой величины. Точность измерения скорости 0,1% от измеряемой величины/ Точность измерения деформации 0,5% от измеряемой величины
Управляющий контроллер: 32-битный контроллер с частотой одновременного сбора и обработки данных по всем каналам 500Гц;
Пневматические захваты образцов тисочного типа. Усилие +/- 5кН, температурный диапазон от 0 до 100 0С. Комплект губок для удержания плоских образцов толщиной от 0 до 20 мм и шириной до 25 мм. Качающийся п е- реходник для выравнивания образцов. Панель управления испытаниями на раме машины; Автоматическая электронная система защиты образца и оператора. Датчик деформации: Бесконтактный видео-экстенсометр:
базовая длина от 10 до 200 мм, диапазон измерений до 200 мм, погрешность измерения 0.5%, скорость испытаний до 500 мм/мин, испытание образцов в камере, комплект специальных маркеров. Процессор Intel® Pentium® D 925
Гигабитный сетевой контроллер Intel Pro 1000 PT PCIe
Программное обеспечение Office Basic Edition 2003 Win32 Russian
Набор управляющих программ. Источник питания: 230 В, 1 фаза, 50 Гц,
15 А.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
126 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
 ТермоупаковочнаямашинаNS 1000
ТермоупаковочнаямашинаNS 1000
Для стерильной упаковки образцов полимерных изделий предусмотрена термоупаковочная машина NS 1000 фирмы «Howo Gmby» (Германия)
(рис. 3.7).
Рис. 3.7. Термоупаковочная машина NS 1000. Под руководством студентки Анны Кузьминой полученные полимерные матриксы затаривают и готовят к стерилизации
Технические характеристики термоупаковочной машиныNS 1000
Машина для стерильной упаковки полимерных изделий медицинского назначения включает: печатающее устройство (принтер) – однострочное; с возможностью создания различных форматов дат стерилизации и истечения срока годности, автоматическое обновление; указание номера партии, личного номера упаковщика, обозначения в соответствии со стандартом EN 980, сертификат СЕ с сопроводительным текстом, сохранение текста в памяти, настраиваемая начальная граница области печати, печать с поворотом на 180° (начиная с нижнего края), изменяемые начертание шрифта и межзнаковый интервал, доступ спереди для замены ленты, возможность отключения; граница поля печати бесступенчатая регулировка, задается в мм. Скорость запаивания10м/мин. Бесступенчатая регулировка ширины полосы запаивания 5–30 мм. Запас расстояния от шва пайки до упаковываемых товаров > 30мм. Регулировка температуры – микропроцессорная. Температура запаивания 80–220. Погрешность поддержания температуры ± 2%. Мощность 500 Вт.Напряжение питания 230 В/50 Гц. Габаритные размеры ширина х глубина х высота, не более, 620 х 260 х 250 мм. В комплекте – СТЕРРАД прозрачные упаковочные пакеты в рулонах 150ммх70м не менее 3-х шт
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
127 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
 Компактноеустройстводляавтоматическойстерилизации медицинскихизделийSterrad NX
Компактноеустройстводляавтоматическойстерилизации медицинскихизделийSterrad NX
Компактное устройство для автоматической стерилизации медицинских изделий с использованием низкотемпературных плазменных технологий стерилизацией перекисью водорода при температуре от + 50 до + 55 0C Sterrad NX фирмы Johnson& Johnson, США (рис. 3.8):
Рис. 3.8. Стерилизующая система Sterrad NX фирмы Johnson& Johnson (США)
Технические характеристики стерилизующей системы Sterrad NX:
Температура в стерилизационной камере не выше 550 С, Система укомплектована датчиком, реагирующим повышенную влаж-
ность внутри стерилизационной камеры для предотвращения коррозии стерилизуемых изделий медицинского назначения.
Габариты: в мм, 840x840x560
Ширина двери/угол открытия, 560 мм/100°.
Размеры стерилизационной камеры в мм, 200x610x330,
общий объем 40 литров, полезный объём стерилизационной камеры
30л.
Размеры полок (2 полки), 610x330 мм.
Длительность цикла стерилизации: стандартный цикл 28 – 30 минут, продленный цикл 38 – 40 минут.
Условия рабочего помещения : температура от + 18 до -35° С , вла ж- ность от 10% до 85% до 30° С, далее линейное уменьшение от 85% при 30°С до 70% при 40°С без образования конденсата.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
128 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
Источник питания: однофазное питание, 180-264В переменный ток, 4763Гц, 10А, максимальная мощность 2 кВт.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 3.1.1.Изучить технику переработки полимера (на примере ПГА) в специализированные изделия из различных фазовых состояний
Порядок выполнения работы
1.Выделенный из бактериальной биомассы хлопьевидно-волокнистый полимер измельчить с использованием мельницы (или бытовой кофемолки); смешать с навеской хлорида натрия или гидроксиапатита (для получения однородной массы растереть смесь в агатовой ступке в жидком азоте до получения однородной смеси в виде порошка).
2.Приготовить навески: а) из порошкообразного полимера (по 200 мг), б) полимера в смеси (1:1 по массе) с хлоридом натрия, в) из композиции ПГА:ГАП (1:1 по массе).
3.С использованием пресс-формы, заполняя ее приготовленными образцами порошков полимера или смесей полимера с солью, композиции полимера с гидроксиапатитом, на автоматическим лабораторном прессе при давление порядка 120 кгс/см2 спрессовать трехмерные компакты в виде таблетированных форм (рис. 3.9). Полученные образцы изделий виде плотных и пористых трехмерных матриксов и волокон будут использованы на последующих занятиях для изучения структуры и свойств (рис. 3.9–3.12).
4.Формы, полученные из смеси полимера и хлорида натрия (или сахарозы) поместить в дистиллированную воду и прокипятить в течение 1 ч. Применение данной техники выщелачивания позволяет получить пористые матриксы (рис. 3.12).
5.Формы, полученные из композиции ПГА/ГАП, в течение 30 мин подвергнуть температурному закаливанию при 105 оС.
6.Переработку ПГА из расплава в изделия в виде монофиламентных волокон произвести с использованием лабораторного мини-экструдера
7.Навеску полимера (10 г) поместить в загрузочную камеру одношнекового мини-экструдера с диаметром насадки 1 мм. Температуру экструдата
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
129 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
выставить порядка 175-180 оC, в зоне насадки – 170 оC. Время нахождения волокон в зоне нагрева при вытягивании не должно превышать 2,5 мин во избежание температурного распада полимера.
Рис. 3.9. Фото исходного полимера и объемных образцов, изготовленных прямым прессованием из композитов полигидроксибутирата с гидроксилапатитом
(натуральные размеры) (материалы Е. И. Шишацкой)
Рис. 3.10. Фото и электронная микрофотография моножильных волокон, полученных из расплава ПГБ/ПГВ (материалы Е. И. Шишацкой)
Рис. 3.11. Фото трехмерных матриксов (пластин), полученных из расплава ПГА, различной толщины: 1 – 2,3 мм; 2 – 3,5 мм; 3 – 7,6 мм; 4 – 8,8 мм (материалы Е. И.
Шишацкой)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
130 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.1. КОНСТРУИРОВАНИЕ КЛЕТОЧНЫХ МАТРИКСОВ
Рис. 3.12. Фото пористых матриксов, полученных из композитов ПГБ/ГАП с различным соотношением компонентов: ПГБ/ГАП= 80:10 (а), 80:20 (б), 50:50% (в).
Маркер 1 см (материалы Е. И. Шишацкой)
 Контрольные вопросы
Контрольные вопросы
1. Каковы основные требования к переработке полимеров из распла-
вов?
2.Какие ограничения имеют место при переработке термопластичных полимеров из расплавов?
3.Почему метод холодного компрессионного формования полимерных материалов востребован в настоящее время?
4.Отличия и преимущества методов переработки полимеров из расплавов и порошков?
5.Как получить пористые клеточные матриксы?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
131 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА3.2. ПРИГОТОВЛЕНИЕРАСТВОРОВПОЛИМЕРОВ. ПОЛУЧЕНИЕ ДВУМЕРНЫХПОЛИМЕРНЫХМАТРИКСОВ
 Цель лабораторной работы
Цель лабораторной работы
•освоить технику получения полимерных пленочных и мембранных матриксов с использованием техники испарения растворителя
 Краткие теоретические сведения
Краткие теоретические сведения
В связи с хорошей растворимостью полигидроксиалканоатов в неполярных растворителях растворы этих полимеров различной плотности и вязкости, обладающие выраженными волоконнообразующими свойствами, пригодны для изготовления двумерных матриксов в виде гибких пленок и пористых мембран, имеющих широкие перспективы применения в клеточных технологиях.
Из ПГА возможно получение различных типов полимерных пленок и мембран, полученных методом полива растворов полимера различной концентрации, от 1–5 до 20%, на обезжиренную поверхность, например стекол. В зависимости от химического состава полимера, скорости кристаллизации изделия в процессе испарения растворителя, получаются пленки, имеющие различную топография и свойства (смачиваемость, пористость, проницаемость для паров воды и жидкостей и т. д.).
Методом полива раствора ПГА (гомогенного полигидрокисбутирата и сополимеров гидроксибутирата с гидроксивалератом) различной концентрации (от 1 до 5 %) в хлороформе и дихлорметане на поверхность обезжиренных чашек Петри можно получить гибкие прозрачные пленки толщиной от
(0,016±0,002) до (0,062±0,008) мм (рис. 3.13).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
132 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.2. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ПОЛИМЕРОВ. ПОЛУЧЕНИЕ ДВУМЕРНЫХ ПОЛИМЕРНЫХ МАТРИКСОВ
а б в
Рис. 3.13. Двумерные матриксы из ПГА: внешний вид (а); маркер 0,5 см; электронные микрофото матрикса из полигидроксибутирата (ПГБ) (б) и сополимера гидрокисбутирата и гидроксивалерата (ПГБ/ПГВ) (в); маркер 1 мкм (материалы Е. И. Шишацкой)
С использованием растворов полигидроксибутирата (1% вес/объем), выливаемых на поверхность стекол из пирекса при 45оC при условии медленного испарения растворителя с использованием подогрева (80-90 оC) образуются при полном испарении растворителя пленки хорошего качества, имеющие толщину 0,04–0,07 мм. Сорбционная способность пленок, исследованная в системе «этанол-вода» при различной концентрации компонентов, оказалось различной. На проницаемость пленок влияло количество и состояние аморфной фазы в полимере. Проницаемость водно-этанольной смеси для пленок, изготовленных из ПГБ, достигает 35–40% и 10–15% – для пленок из менее кристалличного сополимера гидроксибутирата с гидроксивалератом (ПГБ/ПГВ). Селективность по отношению к смеси «спирт/вода» у изделий из гомогенного ПГБ более чем в 5 раз может превосходить селективность сополимерных пленок.
Проницаемость паров воды и паров спирта, измеряемая гравиметрически при изменении температуры (30–50 оC), показала, что пленки из ПГБ имеют более высокую селективность проницаемости для паров спирта и воды (около 10 и 70 бар соответственно) по сравнению со значениями, полученными для пленок из ПГБ/ПГВ (36 и 59 бар, соответственно). Различия проницаемости мембран, полученных из разных типов ПГА, связаны, вероятно, с различиями скоростей и течения процесса кристаллизации, различиями размеров образующихся сферолитов, которые и определяют транспортные свойства неупорядоченной фазы полимера.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
133 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.2. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ПОЛИМЕРОВ. ПОЛУЧЕНИЕ ДВУМЕРНЫХ ПОЛИМЕРНЫХ МАТРИКСОВ
 Материалы и оборудование
Материалы и оборудование
1. Образцы полимеров (ПГБ и ПГБ/ПГВ)
2. Растворители (хлороформ, дихлорметан)
3.Лабораторные весы «Adventurer»™ OH–AR2140
4.Термостат BD-115, BINDER (Германия)
5.Фильтры Шотта
6.Формы для налива растворов полимера (чашки Петри, полиро-
ванные металлические пластины, стекла)
7.Бокс-ламинар фирмы «LABCONCO»(США)
8.Стеклянная посуда, колбы, мерные стаканы, пипетки, бюксы
9.Микрометр
10.Цифровой фотоаппарат
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Порядок выполнения работы:
1.В боксе-ламинаре приготовить серию навесок полимеров ПГБ и ПГБ/ПГВ.
2.Поместить навески в пронумерованные стеклянные конические колбочки с притертыми крышками, прилить растворитель.
3.Для ускорения растворения колбочки поместить в термостат на 15-20
мин.
4.Проанализировать растворимость разных типов ПГА в различных растворителях. Результаты внести в табл. 3.1.
5.Исследовать влияние температуры на процесс растворения полимеров. Для этого варьировать температуру в термостате в диапазоне 60–140оС.
6.Для исключения наличия в растворе частичек нерастворенного полимера профильтровать растворы через фильтры Шота.
7.В боксе-ламинаре произвести налив растворов полимера на обезжиренные поверхности приготовленных форм; часть форм предварительно подогреть до 35–30оС.
8.Оставить формы с налитыми полимерными растворами в потоке стерильного воздуха на 30-45 мин до полного испарения растворителя.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
134 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.2. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ПОЛИМЕРОВ. ПОЛУЧЕНИЕ ДВУМЕРНЫХ ПОЛИМЕРНЫХ МАТРИКСОВ
9.Снять образованные пленки с поверхности форм. Сфотографировать
спомощью цифрового фотоаппарата, распечатать и внести в лабораторную тетрадь.
10.С помощью микрометра измерить толщину пленок, полученных из различных типов полимеров, приготовленных из растворов различной плотности. Значения занести в тетрадь.
|
|
|
|
Таблица 3.1 |
|
Максимальная растворимость образцов ПГА (весовая доля, %) |
|||||
|
|
|
|
|
|
Образец ПГА |
|
Растворитель |
|
||
Хлороформ |
Дихлорэтан |
Тетрахлорэтан |
Диоксан |
||
|
|||||
|
|
|
|
|
|
ПГБ/ПГВ |
|
|
|
|
|
ПГБ |
|
|
|
|
|
 Контрольные вопросы
Контрольные вопросы
1.На каком химическом свойстве ПГА основано получение двумерных полимерных матриксов на базе метода поливом из раствора и испарения растворителя?
2.Каковы основные требования к методике получения полимерных матриксов из растворов?
3.Каковы преимущества техники испарения растворителя?
4.Каким образом можно получить пористые полимерные матриксы с использованием техники поливом растворов и испарения растворителя?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
135 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА3.3. ПОЛУЧЕНИЕМАТРИКСОВМЕТОДАМИНАНОТЕХНОЛОГИЙ
 Цель лабораторной работы
Цель лабораторной работы
•освоение методов получения полимерных матриксов в виде ультратонких волокон и микрочастиц
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 3.3.1. Получениеультратонких полимерныхволокон
Перспективными новыми методами получения матриксов для тканевой инженерии являются методы нанотехнологии, включая технику микроинкапсулирования и электростатического формования (ЭСФ). Метод электростатического формования (ЭСФ) – «electrospinning» позволяет получать нетканые материалы, в том числе ультратонкие волокна и мембраны. Принцип метода заключается в образовании филаментов в сильном электрическом поле, возникающем между двумя электродами противоположной зарядности; он получил развитие в поcледние годы в связи с потребностями новых биомедицинских технологий клеточной и тканевой инженерии.
Типичная установка для электростатического формования (ЭСФ) состоит из трех основных частей: капилляра в который с постоянной скоростью подается раствор полимера, металлической мишени и источника высокого напряжения (рис. 3.14). Раствор полимера вытекает из капилляра и под действием электростатического поля формирует тонкую положительно заряженную струю, которая движется по направлению мишени. Поскольку отдельные части струи обладая одинаковым зарядом отталкивают друг друга, струя начинает вращаться, формируя конус в пространств между концом иглы и мишенью, который в большинстве случаев можно наблюдать невооруженным глазом. В результате волокна ложатся на мишень в случайном порядке и формируют сетку изотропно ориентированных волокон (рис. 3.15).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
136 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.3. ПОЛУЧЕНИЕ МАТРИКСОВ МЕТОДАМИ НАНОТЕХНОЛОГИЙ
4
3
1 
 +
+
2 
Рис. 3.14. Схема установки для электростатического прядения полимеров: 1- капилляр, 2- заземленная металлическая мишень, 3- источник высокого напряжения, 4 – насос для подачи полимерного раствора.
 Материалы и оборудование
Материалы и оборудование
1.Установка ЭСФ
2.Образец полимера
3.Весы лабораторные
4.Растворители (хлороформ, дихлорметан)
5.Лабораторная посуда, мерные пипетки
6.Водяная баня-термостат WB-4MS фирмы «BioSan».
Порядок выполнения работы:
1.На весах приготовить навески полимера (50, 100, 200 мг)
2.Навески полимера перенести в конические стеклянные колбы с притертыми пробками
3.Залить образцы полимерами растворителем (по 50–100 мл)
4.Поместить колбы с образцами полимера в водяную баню на 30 мин при 45-50 оС.
5.Залить раствор полимера в капилляр установки ЭСФ
6.Включить установку и произвести приемку образующихся волокон на приемное устройство
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
137 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.3. ПОЛУЧЕНИЕ МАТРИКСОВ МЕТОДАМИ НАНОТЕХНОЛОГИЙ
аб
Рис. 3.15. Электронно-микроскопические снимки волокон, полученных методом ЭСФ при 25 кВ из 6 % (а) 10 % (б) растворов ПГБ/ПГВ (материалы Е. И. Шишацкой)
Задание 3.3.2. Получениеполимерных матриксов в виде микрочастиц
Активно разрабатываемые в настоящее время методы микроинкапсулирования позволяют получать микро- и наноразмерные частицы, которые в силу высочайшей развитости поверхности и возможности имплантации подкожно, внутримышечно и инфузионно имеют огромные перспективы не только для разработки систем контролируемой доставки лекарственных средств, но и в качестве матриксов в технологиях клеточной и тканевой инженерии. Для получения микросфер из ПГА применяют метод испарения растворителя из двухили трехкомпонентной эмульсий (раствор полимера в дихлорметане с добавками желатина и поливинилового спирта). При нагружение микросфер препаратами препарат предварительно растворяют в дихлорметане, далее в раствор вносят навеску полимера и все остальные реагенты.
 Материалы и оборудование
Материалы и оборудование
1.Верхнеприводная трехлопастная мешалка «Heipolph RZR1« (Германия)
2.УЗ-гомогенизатор «Sonicator-S3000» фирмы Misonix Incor. (США).
3.Образец полимера.
4.Лабораторные весы «Adventurer»™ OH–AR2140
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
138 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.3. ПОЛУЧЕНИЕ МАТРИКСОВ МЕТОДАМИ НАНОТЕХНОЛОГИЙ
5.Растворители (хлороформ, дихлорметан).
6.Набор поверхносто-активных веществ (поливиниловый спирт (ПВС), полиоксиэтилен – 20-сорбит моноолеат (Tween ® 80) и н а- трий додецил сульфат (SDS)).
7.Лабораторная посуда, мерные пипетки.
8.Вакуумный десикатор LABCONCO (США).
9.Установки лиофилизации ЛС-500 (Россия).
Порядок выполнения работы:
1.На весах приготовить навески полимера (20, 50, 100 мг).
2.Навески полимера перенести в конические стеклянные колбы с притертыми пробками.
3.Залить образцы полимерами растворителем (по 20–100 мл).
4.Внести навеску ПАВ (0,5% по массе)
5.Поместить колбы с образцами полимера в водяную баню на 30 мин при 39 оС.
6.Микронизацию полимерной эмульсии провести с использованием трехлопастной мешалкой «Heipolph RZR1» (Германия) в течение 25 мин при скорости перемешивания (300–1000 об/мин) или обработкой эмульсии ультразвуковым генератором «Sonicator-S3000« фирмы Misonix Incor. (США). Мощность и длительность воздействия – от 12 до 20 Вт, время от 60 до 300 с.
7.Полученную эмульсию оставить на сутки при постоянном механическом перемешивании до полного испарения растворителя. Микросферы собирали центрифугированием (10 000 об/мин, 5 мин).
8.Осадок микросфер промыть до 6 раз дистиллированной водой и высушить в 2-а этапа: с использованием вакуумного десикатора LABCONCO (США) и установки лиофилизации ЛС-500 (Россия).
9.Для получения композитный микросфер, в ходе приготовления полимерной эмульсии в нее дозируют раствор лекарственного препарата, минерального или органического наполнителя.
Морфологию полученных микрочастиц визуализуют с применением растровой электронной микроскопии на микроскопе FEI Company Quanta 200 с приставкой рентгеновского микроанализа EDAX с безазотным охлаждением
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
139 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.3. ПОЛУЧЕНИЕ МАТРИКСОВ МЕТОДАМИ НАНОТЕХНОЛОГИЙ
GENESIS XM 2 60 – Imaging SEM with APOLLO 10 (США). Напыление образцов золотом проводили в установке «Balzers CPD-030» (Германия) (рис. 3.14).
Рис. 3.16. Электронные микрофото полимерных микрочастиц, полученных эмульсий разного состава (материалы Шишацкой Е. И. и Горевой А. В.)
Контрольные вопросы
1. Какие методы нанотехнологий применяют для получения клеточных матриксов
2.Почему матриксы в виде нановолокон или микрочастиц – наиболее перспективная форма клеточных матриксов?
3.В чем отличия способов ЭСФ и микроинкапсулирования?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
140 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА3.4. ПРИНЦИПЫВЕДЕНИЯКЛЕТОЧНЫХКУЛЬТУР
 Цель лабораторной работы
Цель лабораторной работы
•приобретение знаний о требованиях, предъявляемым к рабочему месту, посуде, средам и материалам, предназначенным для работы с клеточными культурами, принципах обеспечения условий безопасной работы.
 Краткие теоретические сведения
Краткие теоретические сведения
Принципы работа в клеточной лаборатории и основные асептические лабораторные методы
В лаборатории, предназначенной для культивирования клеток, должны постоянно поддерживаться условия высокой асептики. В странах ЕС практика регламентируется директивами GLP. Директивы GLP касаются общих процедур, позволяющих успешно выполнить эксперимент и обеспечивают повторяемость эксперимента; они включает правильное планирование экспериментов, письменную регистрацию всех выполненных экспериментальных процедур (в лабораторной книге), обучение по крайней мере двух ученых, способных самостоятельно выполнить эксперимент и соответствующую маркировку этикетками всех веществ/сред/ культур (наименование, дата, описание, номер пассажа и тип клеток). Следует обязательно письменно регистрировать методики или стандартные операционные процедуры, а также содержать лабораторное оборудование в чистоте. Протоколы GLP сводят до минимума потенциальные риски биологической опасности для исследователя.
Важнейшее условие для работы с клеточными культурами – соблюдение правил стерильности. Микробная инфекция приводит к гибели клеток, снижается их рост и нарушается экспрессия клеточных белков, что ведет к искажению результатов эксперимента.
При культивировании клеток следует обязательно выполнять приведенные ниже общие асептические приемы:
–следует обязательно надевать одноразовые перчатки (например, из нитрила) при работе в лаборатории с культурами клеток;
–надевать чистые лабораторные халаты, которые ни в коем случае не выносить из лаборатории;
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
141 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
–перед началом работы рабочие участки и руки в перчатках следует протирать 70%-ным спиртом;
–работать только в специально обозначенных «чистых зонах», в частности в ламинарном шкафу для культур тканей;
–все предметы и руки в перчатках должны протираться 70%-ным спиртом при каждом входе в стерильную зону, например бокс, ламинарный шкаф или термостат;
–стерильные флаконы или колбы следует открывать только в ламинарном шкафу непосредственно перед использованием и ни в коем случае не оставлять открытыми;
–стерильные одноразовые пипетки должны доставаться из упаковок внутри ламинарного шкафа и только непосредственно перед использованием;
–когда со стерильных флаконов или колб снимаются крышки, по возможности крышку не следует класть на рабочий стол, открытый флакон нужно наклонить, чтобы микроорганизмы из среды попадали только на край флакона;
–жидкости не следует брать из разных флаконов одной и той же пипеткой; для каждого флакона должна использоваться новая стерильная пипетка;
–при выполнении процедур с культурой клеток нельзя разговаривать, кашлять или чихать;
–работа должна выполняться как можно быстрее во избежание инфекции клеток.
 Материалы и оборудование
Материалы и оборудование
Для мытья и обработки лабораторной посуды предусмотрен дезинфекционно-моечный автомат G 7883 CD фирмы LABCONCO ( США) (рис. 3.17).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
142 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
 Характеристики оборудования
Характеристики оборудования
 Дезинфекционно-моечныйавтоматG 7883 CD
Дезинфекционно-моечныйавтоматG 7883 CD
Технические характеристики |
|
|
Моечная машина для мойки |
|
|
универсального применения в ла- |
|
|
боратории (рис. 3.17) имеет сле- |
|
|
дующие характеристики: материал |
|
|
– нержавеющая сталь; электронное |
|
|
управление; восемь моечных про- |
|
|
грамм с возможностью модифика- |
|
|
ции; объем моечной камеры – 0,13 |
|
|
м3; производительность циркуля- |
Рис. 3.17. Дезинфекционно-моечный |
|
ционного насоса – 400 л/мин; |
||
автомат |
||
|
||
|
G 7883 CD |
встроенная система смягчения воды, встроенная система фильтрации; встроенный агрегат для сушки; встроенный насос для подачи дистиллированной воды; встроенный пароконденсатор; электообогрев; наличие сливного насоса; наличие 1 дозирующего насоса DOS 60/30 для жидких моющих средств; вставка для лабораторного стекла (широкогорлые стаканы) емкостью 250– 600 мл; вставка для пробирок (от 160 до 200 пробирок) высотой до 200 мм; вставка для 38 половинок чашек Петри диаметром 100 мм.
Размеры моечной камеры: в мм, 500 х 535 х 500 мм. Электроподключение 400 В, 50 ГЦ.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
143 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
 Вертикальныйпрограммируемыйавтоматическийавтоклав
Вертикальныйпрограммируемыйавтоматическийавтоклав
Вертикальный программируе- |
|
|
|
||
мый автоматический автоклав фирмы |
|
|
|
||
«Sanyo» MLS-3781L, Япония, предна- |
|
|
|
||
значен для стерилизации сред, эле- |
|
|
|
||
ментов ферментационного оборудо- |
|
|
|
||
вания (рис. 3.18). Клеточные техноло- |
|
|
|
||
гии ориентированы на культивирова- |
|
|
|
||
ние клеток на разнообразных средах |
|
|
|
||
и материалах, которые должны быть |
|
|
|
||
стерильными. Кроме нейтрализации |
|
|
|
||
микроорганизмов, крайне важно, |
|
|
|
||
чтобы метод стерилизации не изме- |
|
|
|
||
нял свойства материала. Многие ис- |
|
|
|
||
пользуемые на |
практике |
матриксы |
|
|
|
для клеток изготовлены из резорби- |
|
|
|
||
руемых материалов, поэтому к ним |
|
|
|
||
не применимы методы мокрой сте- |
|
|
|
||
рилизации, а должно применяться |
|
|
|
||
УФ-облучение, |
которое, |
одна- |
|
|
|
|
|
|
|||
ко,стерилизует |
только поверхность, |
Рис. 3.18. Автоматический автоклав |
|||
не проникая внутрь материала или |
|
«Sanyo» |
|||
матрикса. |
|
|
|
|
|
Нагревание или химическая стерилизация может изменить химический состав и/или механические свойства материала. Кроме удаления живых микроорганизмов, при исследовании материалов большое значение имеет удаление фрагментов мертвых микроорганизмов (в частности, бактерий) и продукты их обмена (эндотоксины). Поэтому в исследованиях биоматериалов необходимо тщательно мыть материалы и матриксы как дополнение к стерилизации.
Технические характеристики
Полезный объем 75 л. Размеры камеры 370х640 мм.
Материал камеры нержавеющая сталь SUS404.
Автоклав рассчитан на максимальное давление 0,235 МПа. Температура стерилизации: от 105 до 135 °C.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
144 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
Таймер стерилизации от 1 до 250 мин.
Таймер поддержания температуры. Задержка до 72 ч, автоматическое выключение.
Программный таймер от 1 до 99 ч. Источник питания 220 вольт, частота 50 Гц.
 Вертикальныйнизкотемпературныйморозильник
Вертикальныйнизкотемпературныйморозильник
Для хранения клеточного материала предусмотрен вертикальный низкотемпературный морозильник фирмы New Brunswick scientific (США) (рис. 3.19). Морозильник включает: двухстадийную систему каскадного охлаждения; внешнюю дверь на петлях с изоляцией; внутренние камеры морозильника с индивидуальной изоляционной внутренней дверью на петлях; вентилятор с пониженным шумопроизводством; замок; систему запирающегося доступа к общему выключателю и выключателю системы сигнализации; панель управления с фронтальным расположением; регистратор данных, с возможностью передачи данных на небумажные носители для облегчения валидации; полки из нержавеющей стали; стеллажи; моющийся фильтр; ролики для мобильного передвижения.
Рис. 3.19. Студентка Анна Шумилова закладывает образцы в низкотемпера-
турный морозильник New Brunswick scientific
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
145 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
Технические характеристики
Полезный объем камеры 570 л; число камер 5; стеллажей 25; вместимость: 570 шт. 2-х дюймовых криобоксов или 300 шт. 3-х дюймовых или 200 шт. 4-х дюймовых криобоксов;
Система охлаждения состоит из герметичной двустадийной каскадной системы; время понижения температуры – до 4,5 ч. Диапазон температур (при температуре внешней среды до +32ºC): от минус 50ºC до минус 86 ºC с шагом 1 ºC; внешний замок; микропроцессорное управление; пароль доступа: 4-е знака; сигнализация превышения или понижения температуры, отключения электроэнергии, необходимости замены батареи и смены фильтра.
Источник питания: 220 вольт, 1 фаза, частота 50 герц, 15 А.
Все работы с клеточными культурами выполняются в боксированном помещение (рис. 3.20).
 Оборудованиекультуральногобокса
Оборудованиекультуральногобокса
Оборудование культурального бокса
Культуральный бокс изготовлен из пластиковых стеклопакетов.
В комплект необходимого оборудования бокса для работы с клеточными культурами входят:
1)бокс-ламинар 2-го класса за-
щиты “Labconco” (США);
2)СО2-инкубатор фирмы New Brunswick Scientific» (США);
3)инвертированный микроскоп фирмы Ломо (Санкт-Питербург, Россия);
4)холодильник для хранения сред;
5)шкаф для посуды;
6)УФ-облучатель;
7)баллон с СО2.
Рис. 3.20. Культуральный бокс, оборудованный в отделение клеточных культур
(базовая кафедра биотехнологии)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
146 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
 СО2-инкубатор
СО2-инкубатор
СО2-инкубатор (рис. 3.21) предназначен для культивирования клеток.
В СО2-инкубаторе поддерживается необходимая температура (порядка 37 оС), влажность и гумидная среда (5% об СО2).
Технические характеристики СО2-
инкубатора «New BrunswickScientific» (США)
Объем 48 л; размеры камеры 401 х 401 х 308 мм.
Инкубатор оснащен ИК-датчиком
СО2.
Предусмотрены двойная дверь, панель управления подачи СО2, цифровое табло стабилизации параметров среды, панель управления параметрам, баллон с СО2.
Регулируемый диапазон температуры от комнатной ди50 оС.
Точность установки температуры: ±0,1 оС.
Равномерность температуры: ±0,2 оС. Диапазон поддержания СО2: от 0,2 до
20 % об.
Точность стабилизации СО2: ±0,1 % об.
Восстановление концентрации СО2: 0,7 % за 1 мин.
Рис. 3.21. СО2-инкубатор Innova CO48 фирмы «New Brunswick Scientific» (США)
Оборудован 3 полками, резервуаром системы увлажнения. Осуществляется естественная конвекция.
Оснащен системой сигнализации для нештатных ситуаций Источник питания: напряжение в сети 220 вольт, 1 фаза, частоту 50 Гц,
15 А.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
147 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
 Бокс-ламинарбиологическойбезопасности2 классазащиты
Бокс-ламинарбиологическойбезопасности2 классазащиты
В культуральном боксе рядом с СО2-инкубатором расположен боксламинар, биологической безопасности 2 класса защиты фирмы LABCONCO,
США (рис. 3.22).
Бокс-ламинар – это место, где производятся все манипуляции с клетками, то есть это и есть собственно рабочее место экспериментатора. Рядом с инкубатором находится бокс-ламинар, позволяющий одновременно работать двум студентам (или преподавателю и студенту).
Рис. 3. 22. Бокс-ламинар 2-го класса защиты
Ламинар обрудован УФ-облучателем, системой фильтров грубой и тонкой очистки воздуха, подсветкой. Поверхности изготовлены из нержавеющей стали, что позволяет обрабатывать ее с применением стерилизующих жидкостей и обжига.
На столешнице бокса размещают стакан с пинцетами, автоматическими пипетками, скальпелями; пенал с автоматическими и стеклянными пипетками, флакон со спиртом; упаковки стерильной посуды, приспособления для работы с клетками (наконечники, пробки, фильтры), а также горелка со спиртом, закрытая керамическим колпачком. Перед работой поверхность
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
148 |
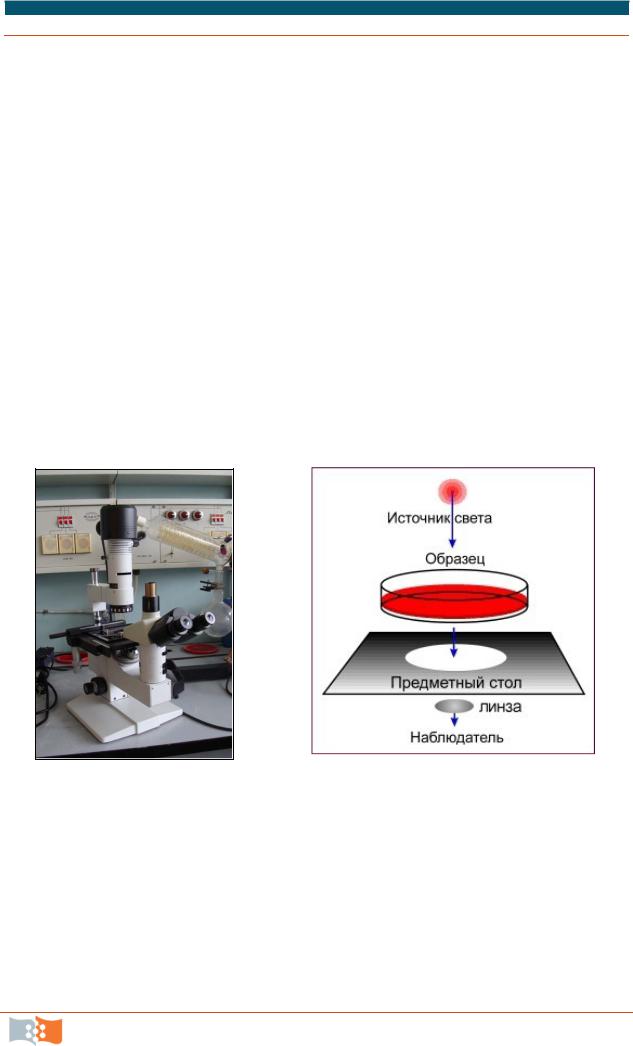
РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
стола тщательно промывают водой с моющим раствором и обрабатывают кусочком ваты, смоченной в спирте. Это необходимо потому, что осевшая на поверхность стола пыль является потенциальным источником заражения клеточной культуры. При работе в боксе все операции следует проводить в непосредственной близости от зажженной горелки, чтобы обеспечить максимальную защиту посуды, растворов, сред и культур от заражения. При работе в боксе-ламинаре с клетками необходимо соблюдать правила личной гигиены. Студент, приступающий к работе, должен быть в чистом халате, шапочке, иметь ватно-марлевую повязку. Перед работой в ламинаре необходимо обработать руки ватным диском, смоченной в дезрастворе или спирте. После этой обработки уже не следует выносить руки за пределы ламинара. Если же это произошло, необходима повторная обработка рук для исключения попадания микроорганизмов в стерильную зону.
Инвертированный микроскоп позволяет анализировать посевы клеток на поверхности сред в чашках Петри или планшете снизу, что очень удобно, так как клетки прикрепляются ко дну культуральной посуды (рис. 3.23).
а |
б |
Рис. 3.23. Фотография инвертированного микроскопа (а) и принцип микроскопирования клеточных объектов (б)
 РастровыйэлектронныймикроскопJEOL JSM-7001F
РастровыйэлектронныймикроскопJEOL JSM-7001F
Растровый электронный микроскоп JEOL JSM-7001F (рис. 3.24), функционирующий в составе Центра коллективного пользования приборами
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
149 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
ФГАОУ СФУ, позволяет изучать биологические объекты без сложной идлительной технологии пробоподготовки (в отличие от просвечивающей электронной микроскопии), включая клетки бактерий, целых насекомых, ткани свежесрезанных высших растений без предварительного высушивания объекта.
Рис. 3.24. Растровый электронный микроскоп JEOL JSM-7001F (Япония)
Технические характеристики
Термополевой источник электронов; ускоряющее напряжение от 0,5 до 30 кВ; разрешение (изображение во вторичных электронах) до 1,2 нм (при ускоряющем 30 кВ); увеличение от x 10 до x 1 000 000.Виды контраста (вторичные и отраженные электроны): топографический, композиционный; элементный анализ: от B до U; столик для образцов эвцентрического типа с компьютерным управлением.
Направления использования: морфология поверхности различных материалов неорганического происхождения, получение изображения во вторичных и отраженных электронах; полуколичественный и количественный элементный анализ поверхности (до субмикронного уровня), картирование фаз; микроструктурный анализ: текстурный анализ, построение карт ориентировки кристаллитов, дискриминация фаз и построение карт распределения кристаллических фаз, определение размера и формы зерен, определение типа границ, построение полюсных фигур.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
150 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.4. ПРИНЦИПЫ ВЕДЕНИЯ КЛЕТОЧНЫХ КУЛЬТУР
 Контрольные вопросы
Контрольные вопросы
1.Какое оборудование необходимо для работы с клеточными культу-
рами?
2.Почему для клеточных технологий необходимо наличие боксаламинара 2-го класса защиты?
3.Какие методы стерилизации используют при работке с клеточными культурами?
4.Для чего требуется наличие в клеточной лаборатории СО2- инкубатора и какие условия с нем следует стабилизировать?
5.Какие требования предъявляются к сотрудникам, работающим с клеточными культурами для обеспечения безопасных условий труда и условий строгой стерильности на рабочем месте?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
151 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА3.5. ПОСУДАИПИТАТЕЛЬНЫЕСРЕДЫДЛЯРАБОТЫСКЛЕТОЧНЫМИ КУЛЬТУРАМИ
 Цель лабораторной работы
Цель лабораторной работы
•ознакомить с набором посуды, используемой для выращивания клеток, с составом и принципами приготовления питательных сред
 Краткие теоретические сведения
Краткие теоретические сведения
Для роста in vitro клеткам необходимы ростовые субстраты и факторы роста и дифференцировки; среди них – углеводы, соли, аминокислоты, витамины, жирные кислоты и белки. Основная культуральная среда должна содержать неорганические соли, аминокислоты, глюкозу, витамины, жирные кислоты и некоторые белки. В среду вносят также краситель феноловый красный и буферную систему на основе бикарбоната. Большинство клеток в культуре требуют оптимального рН в пределах от 7,2 до 7,4. Буферная система на основе бикарбоната в сочетании с атмосферными 5% СО2 обеспечивает стабилизацию оптимальной величины рН. Феноловый красный в среде служит индикатором рН: он имеет розовый цвет при о п- тимальном рН, изменяет цвет на желтый, когда среда становится кислой, и на бордовый, когда среда становится щелочной. Основная или минимальная среда обычно дополняется 10-15%-ной эмбриональной сывороткой крупного рогатого скота (ЭТС), обогащенной белками и факторами роста. Сочетание антибиотиков и/или антигрибковых препаратов может также использоваться в культуре клеток для избежания заражения клеток бактериями и грибами. Клетки выращивают во влажном термостате при 37°С (оптимальная температура) в атмосфере, содержащей 5% СО2. При обращении с клетками в культуре во избежание микробного заражения необходимо соблюдать условия строгой стерильности.
 Материалы и оборудование
Материалы и оборудование
Для приготовления питательной среды для клеток используют набор реагентов, среди которых: питательные среды, сыворотка, индикаторы, антибиотики, трипсин и т. д. Примерами богатых многокомпонентных сред могут служить: среда 199, среда DМЕМ. Эти среды мы и будем использовать (табл. 3.2).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
152 |
