
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.6. ПЕРЕСЕВ КЛЕТОК. ОКРАСКА, ПОДСЧЕТ И ФОТОГРАФИРОВАНИЕ КЛЕТОК
Задание 3.6.3. Посев клеток на материалах
Порядок выполнения работы:
Для воспроизводимости результатов важно определить число клеток, посеянных на квадратный сантиметр материала. Только при постоянстве числа клеток в разных экспериментах можно точно оценить свойства биологического материала, в частности рост клеток, прикрепление или продукцию клеточных факторов.
Тест на окрашивание трипановым синим используется для определения плотности посева. Трипановый синий – это прижизненный краситель, не окрашивающий клетки, у которых мембрана не повреждена. Клетки, не поглощающие краситель, являются жизнеспособными. Соотношение жизнеспособных и мертвых клеток можно определить с помощью гемоцитометра (камера Горяева).
Задание 3.6.4. Окрашиваниеклеток трипановым синим
Порядок выполнения работы:
1.Приготовьте суспензию клеток в соответствии с протоколом субкультивирования .
2.Подготовьте гемоцитометр и покровное стекло, распылив на них 70%-ный спирт и вытерев чистой салфеткой.
3.Прикрепите покровное стекло к гемоцитометру, смочив покровное стекло водой или выдыхаемым воздухом, наденьте покровное стекло на камеру и перемещайте вперед и назад, создавая небольшое давление, до тех пор пока не появятся ньютоновы кольца (радужные кольца).
4.Внесите 0,2 мл соответствующей суспензии клеток (в полной питательной среде) в герметичный флакон.
5.Добавьте 0,2 мл 0,4%-ного трипанового синего и тщательно перемешайте (коэффициент разбавления 2).
6.Дайте красителю отстояться в течение 2-3 мин при 15-30 °С (комнатная температура). Продолжительное воздействие трипанового синего убивает клетки.
7.Пипеткой заполните обе камеры гемоцитометра. Не заполняйте камеры слишком большим количеством среды и проследите за тем, чтобы не было воздушных пузырей.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
159 |
РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.6. ПЕРЕСЕВ КЛЕТОК. ОКРАСКА, ПОДСЧЕТ И ФОТОГРАФИРОВАНИЕ КЛЕТОК
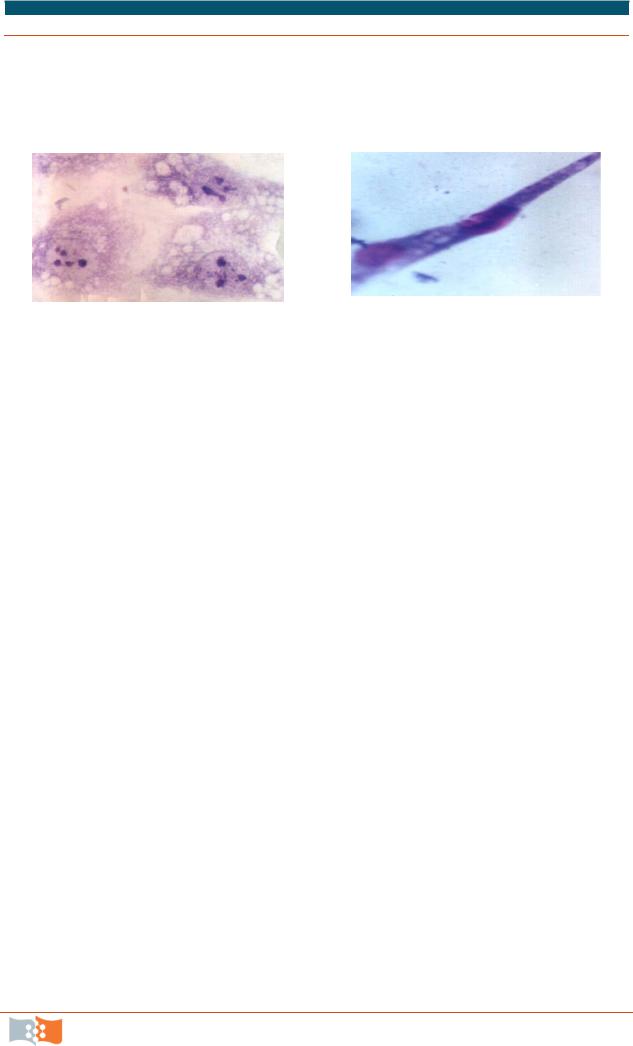
8. Под микроскопом подчитайте количество живых (неокрашенных) и не жизнеспособных (окрашенных в синий цвет) клеток (рис. 3.25) в восьмидесяти квадратах 4 x 4 или на площади 0,1 см2 (рис. 3.26). Подсчитайте клетки в квадратах и клетки на левой и верхней средней линии.
Рис. 3.25. Морфология живых неокрашенных и не жизнеспособных фибробластов мыши линии NIH 3T3 после окрашивания
9. Подсчитайте число жизнеспособных и нежизнеспособных клеток на миллилитр, пользуясь приведенными ниже формулами.
Задание 3.6.5. Подсчет клеток
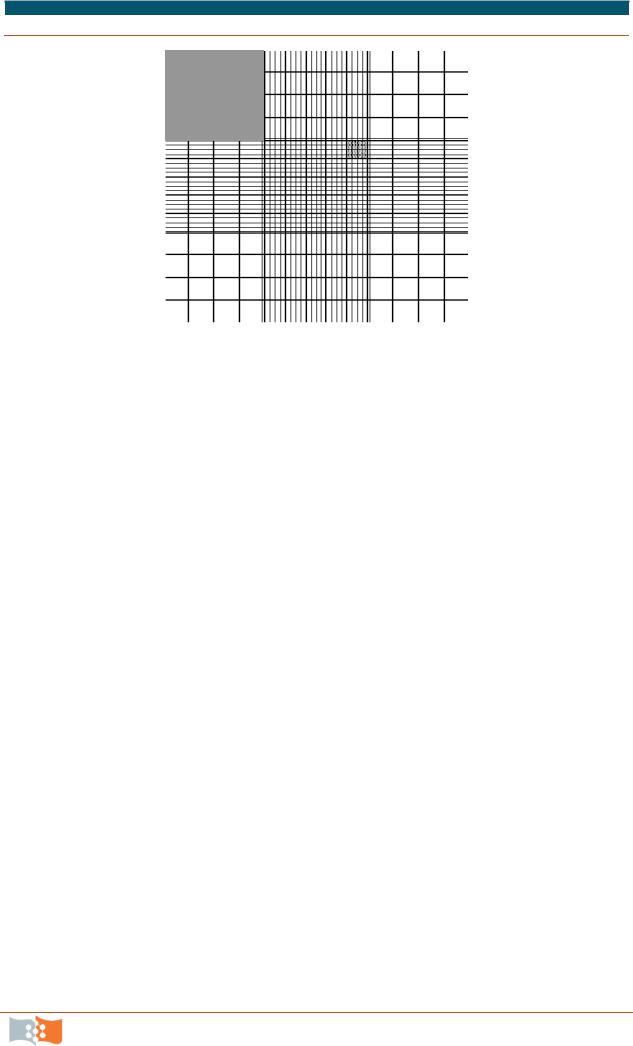
Количество клеток в суспензии просчитывают в камере Горяева (рис. 3.26). Как правило, одновременно определяют жизнеспособность клеток методом исключения красителя (трипановый синий, эритрозин В, нигрозин). Живые клетки не проницаемы для красителей, а мертвые клетки проницаемы и окрашиваются.
Порядок выполнения работы:
1.Для определения количества живых клеток аликвоту суспензии (~40 мкл) смешать с равным количеством 0,4% раствора красителя трипанового синего. Шлифованное покровное стекло притиреть к предметному стеклу гемоцитометра (белая стрелка) до появления колец Ньютона, так, чтобы покрыть заштрихованные области (голубая стрелка).
2.Несколько микролитров смеси внести под покровное стекло камеры Горяева. Количество «квадратов», в которых просчитываются клетки зависит от плотности клеточной культуры и от той точности, которая необходима (лучше просчитывать не менее 40–50 клеток).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
160 |
РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.6. ПЕРЕСЕВ КЛЕТОК. ОКРАСКА, ПОДСЧЕТ И ФОТОГРАФИРОВАНИЕ КЛЕТОК
Рис. 3.26. Гемоцитометр (камера Горяева). Технические данные: Зазор 0,1мм. Сторона малого квадрата 0,05 ±0,001мм. Сторона большого квадрата 0,2 ±0,0015мм. Сторона сетки 3 ±0.005мм. Площадь сетки 9 мм2. Объем камеры
0,9 мм3
3.Каждая заштрихованная область состоит из 9 больших квадратов размером 1х1, т. е. объем, ограниченный каждым большим квадратом, оказывается равным 1мм х 1мм х 0,1 мм = 0,1 мм 3. Отбирают часть окрашенной суспензии пастеровской пипеткой и заполняют счетную камеру гемоцитометра, используя капиллярное всасывание, не переполняя каналы камер.
4.Подсчитать количество клеток в четырех больших квадратах в углах каждой из двух заштрихованных областей. Считать клетки, касающиеся правой и верхней ограничивающих линий, но не клетки, касающиеся левой и нижней ограничивающих линий. Поскольку объем большого квадрата составляет 0,1 мм3, то, умножив усредненное значение числа клеток в одном квадрате на 104, получают количество клеток в 1 мл суспензии.
5.Сосчитать клетки под объективом x 10. Счет клеток проводить в четырех наборах из шестнадцати маленьких квадратов (в каждом углу центральной заштрихованной области). Считать только неокрашенные клетки. Разделив полученное число на 4, получим среднее число клеток на 1 мм2. Поскольку высота камеры составляет 0,1 мм, то пересчетный коэффициент для гемоцитометра равен 104. Предположим, что полученное значение со-
ставляет 20 клеток на 1 мм2. Тогда 20х104 равно числу клеток в 1 мл окр а- шен-ной трипановым синим суспензии, а 2х20х104 равно числу клеток в 1 мл
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
161 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.6. ПЕРЕСЕВ КЛЕТОК. ОКРАСКА, ПОДСЧЕТ И ФОТОГРАФИРОВАНИЕ КЛЕТОК
исходной суспензии, т. е. концентрация живых клеток в исходной суспензии составляет 4х105 клеток в 1 мл.
Для клеток неразведённой суспензии:
•С [кл/мл] = 2,5 х105 (количество клеток в одном большом квадрате)
•С [кл/мл] = 4 х106(количество клеток в одном малом квадрате) Для клеток разведённой в два раза (красителем) суспензии:
•С [кл/мл] = 5 х105(количество клеток в одном большом квадрате)
•С [кл/мл] = 8 х106(количество клеток в одном малом квадрате)
Через 3–4 суток после первого посева, вырастает плотный монослой клеток. Процесс образования монослоя можно пронаблюдать в инвертированный микроскоп. Клетки, достигшие состояния монослоя, нуждаются в пересеве.Этот процесс можно разделить на следующие этапы: трипсинизация и рассев клеток.
Задание 3.6.6. Процесс трипсинизации клеток
Порядок выполнения работы:
1.Открыть емкость с трипсином и внести в сосуд пипетку.
2.Слить среду из сосуда с клетками в пустой чистый стакан (емкость для слива).
3. Добавить трипсина в сосуд с клетками (раствор трипсина должен покрывать поверхность субстрата с клетками).
4.Удалить трипсин из сосуда с клетками в емкость для слива.
5.Повторно добавить такой же объем трипсина в сосуд Карреля.
6.Сосуд Карреля поместить в термостат на 10–15 мин. при температуре 37оС для трипсинизации. (Сосуды Карреля необходимо время от времени слегка встряхивать для обеспечения равномерности протекания процесса.
7.Анализ хода трипсинизации проводить по степени прозрачности раствора трипсин-версена. Открепляясь от поверхности посуды, клетки выходят
враствор, и он становится мутным.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
162 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.6. ПЕРЕСЕВ КЛЕТОК. ОКРАСКА, ПОДСЧЕТ И ФОТОГРАФИРОВАНИЕ КЛЕТОК
Задание 3.6.7.Рассев суспензии клеток
Порядок выполнения работы:
1.Перед началом второго этапа – рассева суспензии клеток, промаркировать сосуды Карреля: на сосуде, в котором был монослой, ставится знак «+», а на сосуде, где не было монослоя (или на новых сосудах) ставится знак «−». Еще раз обработать резиновые пробки всех сосудов с растворами горящей ватой, смоченной в спирте.
2.Открыть емкости с питательной средой и поместить в них пипетки.
3.Перенести определенно количество питательной среды в сосуды Карреля со знаком «+». Пример расчета необходимого количества среды: в сосуде с «+» Вы имеете монослой (это примерно 1,2 млн. клеток в мл), для его рассева на 2 части следует исходить из того, что сосуд Карреля имеет полезный объем около 10 мл. Новый сосуд, в который надо пересеять часть клеток, тоже имеет объем 10 мл. Поэтому в суспензию с трипсином (сосуд
«+») следует налить 20 мл ср еды, чтобы затем 10 мл клеточной суспензии перенести в сосуд Карреля со знаком «−», а остальные 10 мл оставить в «старом» сосуде.
4.После того, как все сосуды со знаком «+» залиты рассчитанным количеством среды, приступать к рассеву клеточной суспензии в новые сосуды. Рассеять клеточную суспензию из сосудов с «+» в сосуды с «−».
5.Стеклянная пипетка погружается в сосуд со знаком «+». Клеточная суспензия набирается в пипетку (приблизительно до половины ее высоты) и
ссилой выпускается обратно в сосуд. Эта операция проделывается несколько раз для того, чтобы дезагрегировать клеточные кластеры и обеспечить в дальнейшем равномерный рассев клеток и прикрепление их к субстрату.
6.Половину объема среды (в примере было 10мл) из сосуда Карреля с суспензией переносится в новый сосуд. Сосуды Карреля и бутыль со средой закрыть над пламенем горелки. Пересев клеток закончен.
Одним из преимуществ клеточной культуры перед другими объектами исследования является возможность продолжительного наблюдения за жизнедеятельностью клеток, за состоянием отдельных клеточных органелл, за процессами, идущими в клетках, фиксировать состояние культуры с учетом количественных и качественных параметров. Для этих целей применяют методы микроскопии клеток (как прижизненной, так и после фиксации) и фотографирование.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
163 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.6. ПЕРЕСЕВ КЛЕТОК. ОКРАСКА, ПОДСЧЕТ И ФОТОГРАФИРОВАНИЕ КЛЕТОК
 Контрольные вопросы
Контрольные вопросы
1.Почему процедура ведении клеточной культуры начинается со стадии размораживания?
2.Как определить наличие контаминации культуры?
3.Что позволяет определить процесс окрашивания клеток трипановым
синим?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
164 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА3.7. ПОЛУЧЕНИЕИВЕДЕНИЕКЛЕТОЧНЫХКУЛЬТУР
 Цель лабораторной работы
Цель лабораторной работы
•приобретение знаний об источниках и методах выделения клеток, требованиях, предъявляемых к материалам и матриксам для их ведения.
 Краткие теоретические сведения
Краткие теоретические сведения
В клеточных технологиях используют различные типы клеток различного происхождения, в том числе первичные клетки и стволовые клетки. Первичные клетки – это зрелые клетки определенной ткани. Такие клетки могут быть выделены из организма-донора в процессе хирургического вмешательства. Первичные клетки, как правило, являются дифференцированными неделящимися клетками, то есть не способными делиться, или их потенциал к размножению и росту низок. При культивировании таких клеток in vitro возможно проявление тенденции некоторых типов клеток к дедифференцировке при их культивации, в результате которой клетки теряют соответствующий фенотип. Так, хондроциты при ведении в культуре вне организма весьма часто продуцируют фиброзный, а не прозрачный х рящ. Эти негативные тенденции и проявления, присущие первичным клеткам, показали необходимость поиска альтернативных источников клеток для развития технологий клеточной инженерии. Такой альтернативой стали стволовые клетки.
Стволовые клетки – недифференцированные клетки, способные делиться, самообновляться и дифференцироваться в один или более типов специа-
лизированных клеток. Различают «взрослые» стволовые клетки и «эмбриональные» стволовые клетки. Главное направление современных исследований стволовых клеток – нахождение факторов стимуляции и условий выращивания для дифференцировки стволовых клеток в необходимые типы клеток. Для получения конкретного типа тканей прежде всего необходимо произвести подбор наиболее подходящей стволовой клетки для формирования необходимой ткани.
Матрикс (каркас будущих тканей) должен иметь структуру, которая действует как шаблон, для роста ткани в трех измерениях и стимулирует новый рост в форме, заданной каркасом. Шаблон должен быть сетью больших пор (макропор); поры должны быть соединены друг с другом, а отверстия между порами должны иметь диаметр более 100 мкм. Идеальные матриксы должны стимулировать рост кровеносных сосудов (ангиогенез) внутри сети
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
165 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.7. ПОЛУЧЕНИЕ И ВЕДЕНИЕ КЛЕТОЧНЫХ КУЛЬТУР
пор. Функционирующие клетки должны прикрепляться к субстрату (матриксу), чтобы далее формировать свой внеклеточный матрикс. Следующее необходимое свойство идеальных матриксов – это способность к биоразрушению. Продукты разрушения (распада) материала матрикса должны представлять собой нетоксичные продукты, которые выводятся из организма или метаболизируются в нем. Матриксы должны активировать клетки ткани для саморегенерации, так как они должны функционировать в качестве системы доставки и контролируемого выхода веществ, активирующих клетки. Механические свойства матрикса должны соответствовать механическим свойствам ткани организма-хозяина. Структура и прочность рассасывающихся каркасов должны также сохраняться до тех пор, пока не будет регенерировано достаточно ткани организма-хозяина.
В связи с тем, что клетки в тканях взаимодействуют между собой с помощью межклеточных контактов и между ними существуют многочисленные связи, прежде чем начать выделение клеток, следует разрушить эти связи. Для этого применяют механические и ферментативные методы.
Для получения монослойных культур фибробластов обычно используют ткани, содержащие большое количество специализированных механоцитов (кожа, легкие, мышцы и др.) или клеточные линии. Облученные или обработанные митомицином С монослойные культуры фибробластов часто используют в качестве фидерного слоя для выращивания кератоцитов, миелоцитов, миоцитов и других типов клеток. Фибробласты, выделенные из эмбриональной ткани, применяют для формирования фидера в двухслойных системах при культивировании стволовых клеток.
 Материалы и оборудование
Материалы и оборудование
1.Биологический материал для выделения клеток.
2.Культуральные среды и посуда.
3.Ножницы, термостат, СО2-инкубатор.
4.Бокс-ламинар.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Порядок выполнения работы:
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
166 |

РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ
РАБОТА 3.7. ПОЛУЧЕНИЕ И ВЕДЕНИЕ КЛЕТОЧНЫХ КУЛЬТУР
1.Обработать участок кожи, очищенный от волос, 70% этанолом. Вырезать острыми ножницами блок объемом 1 мм3.
2.Перенести в 35 мм чашку Петри, промыть от крови охлажденным ССР (Хэнкса, Эрла, Дульбекко и т.п.). Для улучшения прикрепления и роста фибробластов дно чашек целесообразно дополнительно обрабатывать факторами адгезии (коллаген,желатин, поли-й-лизин и т. п.).
3.Фрагмент кожи с помощью ножниц измельчить на 6–12 кусочков. Раствор удалить и заменить полной средой, содержащей90% среды DI-MEM с низким содержанием глюкозы, 10% ЭТС,250 мг/л L-глютамина, 10~6М дексаметазона, 50 мг/л гентамицина. Кусочек кожи должен быть обращен эпидермисом наружу. На каждый кусочек нанести по 1–2 капли среды. В одной чашке должно находиться не более 5-6 фрагментов кожи. Если фрагменты будут большими, то может происходитьих закручивание.
4.Инкубировать образцы при 37 °С, 100% влажности и 5% СО2.
5.Через 12–18 часов в культуру долить 3–4 мл полной питательной среды (в которую дополнительно можно внести ФРФ в дозе 1–2 мкг/мл) так, чтобы частицы кожи не оторвались от дна чашки.
6.Материал культивировать при 37 °С, 100% влажности и 5% СО2 в течение 14–30 сут до образования монослоя клеток. Культуру исследовать методом световой микроскопии.
 Контрольные вопросы
Контрольные вопросы
1.Какие клетки целесообразнее использовать и каким образом их можно получить?
2.Как создать оптимальные условия для роста и дифференцировки кле-
ток?
3.Каким образом провести правильную оценку и интерпретацию результатов культивирования?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
167 |
