
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
 Цель работ раздела
Цель работ раздела
•знакомство с теорией и методами культивирования микроорганизмов различных таксонов
 Задачи раздела
Задачи раздела
•освоение методов выращивания мицелиальных грибов, газоисопользующих бактерий, микроводорослей
 Краткие теоретические сведения
Краткие теоретические сведения
Исследование культивирования микроорганизмов начинается с 1830 г., когда Ш. Каньяр де Латур, К. Кютцинг и Т. Шванн открыли причину брожения вина – наличие клеток дрожжевых грибов.
В дальнейшем в области культивирования микроорганизмов не было прогресса вплоть до 1850-х гг., когда Л. Пастер начал свои фундаментальные исследования: изучение физиологии дрожжей и бактерий, введение асептических методов, минимальных сред и исследование пищевых потребностей микроорганизмов и роли кислорода в процессах их жизнедеятельности. Работами Л. Пастера и его ученика М. Ролэна была установлена потребность в главных и дополнительных компонентах среды и в источниках энергии. Первая полная среда определенного состава была получена М. Ролэном в 1869 г. для культивирования грибов рода Aspergillus. Работа вызывает интерес еще и тем, что М. Ролэн определил пищевые потребности грибов не только качественно, но и количественно. Потребность микроорганизмов в сложных органических веществах − факторах роста − впервые была обнаружена Вильдье в 1901 г., когда он открыл витамин В, или «факторы биос», необходимые для роста дрожжей.
В 1930-е гг. с введением метода колб на качалках началось развитие аппаратуры для культивирования микроорганизмов. Был разработан лабораторный метод для аэрации глубинных культур. Особенное развитие метод получил для глубинных культур аэробных грибов, которые раньше выращивались только на поверхности твердых или жидких сред.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
199 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
В поверхностных культурах окружение организма гетерогенно, а в глубинных – гомогенно, что проще для изучения и контроля. Впоследствии глубинные культуры аэробных грибов сыграли значительную роль в развитии промышленного производства антибиотиков. Возрастающее технологическое значение культуры микроорганизмов существенно стимулировало интерес к этой области и привело в 40−50 -е гг. к созданию ферментеров с автоматической регуляцией условий среды. С этого времени благодаря активному развитию теории непрерывного культивирования хемостатного типа открылись широкие горизонты не только теоретического развития, но и практического применения культур клеток.
Выбор процесса культивирования организма зависит не только от его потребностей в тех или компонентах субстрата, но и от того, для чего будет использована культура, т. е. от конечной цели эксперимента. Методы культивирования микроорганизмов различаются по многим показателям:
1)состоянию питательной среды (поверхностные и глубинные);
2)наличию или отсутствию перемешивания (динамические или стати-
ческие);
3)содержанию кислорода (аэробные или анаэробные);
4)способу действия (закрытые, чаще периодические, и открытые, чаще непрерывные);
5)количеству ферментеров (одно-, дву- и многостадийные);
6)способу управления (хемостатные, турбидостатные, оксистатные, рНстатные и другие).
Культивирование биологических объектов может осуществляться в периодическом и проточном режимах, полунепрерывно с подпиткой субстратом. При периодическом способе культивирования ферментер заполняется исходной питательной средой и инокулятом микроорганизмов (Х0 + S0 на слайде). В течение определенного периода времени в аппарате происходит взаимодействие микроорганизмов и субстрат, сопровождающееся образованием в культуре продукта (Х + S → P).
Биохимические превращения в этом аппарате продолжаются от десятков часов до нескольких суток. Регуляция условий внутри ферментера – важнейшая Задание периодического культивирования микроорганизмов. В ходе периодической ферментации выращиваемая культура проходит ряд последовательных стадий: лаг-фазу, экспоненциальную, замедления роста, ста-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
200 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
ционарную и отмирания. При этом происходят существенные изменения физиологического состояния биообъекта, а также ряда параметров среды. Целевые продукты образуются в экспоненциальной (первичные метаболиты – ферменты, аминокислоты, витамины) и стационарной (вторичные метаболиты – антибиотики) фазах, поэтому в зависимости от целей биотехнологического процесса в современных промышленных процессах применяют принцип дифференцированных режимов культивирования. В результате этого создаются условия для максимальной продукции того или иного целевого продукта. Периодически ферментер опорожняют, производят выделение и очистку продукта, и начинается новый цикл.
Непрерывный процесс культивирования микроорганизмов обладает значительными преимуществами перед периодическим. Непрерывная ферментация осуществляется в условиях установившегося режима, когда микробная популяция и ее продукты наиболее однородны. Применение непрерывных процессов ферментации создает условия для эффективного регулирования и управления процессами биосинтеза. Системы непрерывной ферментации могут быть организованы по принципу полного вытеснения или полного смешения. Первый пример – так называемая тубулярная культура. Процесс ферментации осуществляется в длинной трубе, в которую с одного конца непрерывно поступают питательные компоненты и инокулят, а из другого с той же скоростью вытекает культуральная жидкость. Данная система проточной ферментации гетерогенна.
При непрерывной ферментации в ферментах полного смешения (гомо- генно-проточный способ) во всей массе ферментационного аппарата создаются одинаковые условия. Применение таких систем ферментации позволяет эффективно управлять отдельными стадиями, а также всем биотехнологическим процессом и стабилизировать продуцент в практически любом требуемом экспериментатору или биотехнологу состоянии. Управление подобными установками происходит двумя способами (рис. 5.1).
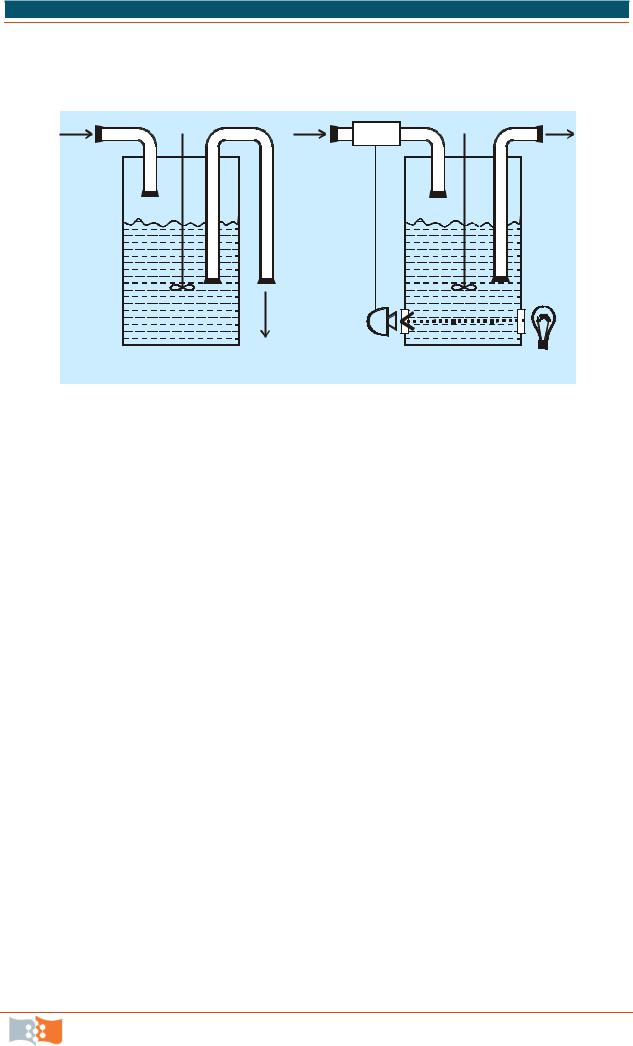
Турбидостатный способ базируется на измерении мутности выходящего потока. Измерение мутности микробной суспензии, вызванное ростом клеток, служит мерой скорости роста, с которой микроорганизмы выходят из биореактора. Это позволяет регулировать скорость поступления в ферментер свежей питательной среды. Второй метод контроля, хемостатный, проще. Управление процессом в хемостате осуществляется измерением не выходящего, а входящего потока. При этом концентрацию одного из компонентов питательной среды (углерод, кислород, азот), поступающего в ферментер,
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
201 |
РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
устанавливают на таком уровне, при котором другие питательные компоненты находятся в избытке, то есть лимитирующая концентрация задающегося биогенного элемента ограничивает скорость размножения клеток в культуре.
1 |
2 |
1 |
2 |
3 |
|
|
4 |
|
|
|
|
5 |
|
6 |
|
|
3 |
|
|
|
A |
|
Б |
|
Рис. 5.1. Схемы биореакторов для проточного культивирования микроорганизмов: А – хемостат; Б – турбидостат с автоматической регуляцией оптической плотности. 1 – поступление среды; 2 – мешалка; 3 – сток культуры; 4 – насос; 5 – фотоэлемент; 6 – источник света
Культуры микроорганизмов можно подразделять на открытые и закрытые системы. Открытая система – это система, в которую все компоненты могут поступать или покидать ее. Закрытой называют такую систему, в которой хотя бы один из существующих компонентов не может ни поступать в систему, ни покидать ее. Следовательно, все непрерывные культуры, в которых происходит, с одной стороны, приток питательной среды, с другой – отток биомассы и других продуктов, являются открытыми системами. Простая периодическая культура, содержащая ограниченное первоначальное количество питательного субстрата, служит примером закрытой системы. В закрытой системе скорость роста биомассы должна стремиться к нулю либо изза недостатка субстрата, либо из-за непереносимости токсичного продукта при его дальнейшем накоплении. Следовательно, такие системы находятся в неустойчивом состоянии. В отличие от этого в открытых системах всегда есть возможность установления стабильного состояния.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
202 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
Подраздел5.1. КУЛЬТИВИРОВАНИЕХЕМОЛИТОАВТОТРОФНЫХ ГАЗОИСПОЛЬЗУЮЩИХБАКТЕРИЙ
 Цель подраздела
Цель подраздела
• продемонстрировать потенциальные возможности параметрически управляемого культивирования микроорганизмов для получения целевых продуктов.
 Задачи подраздела
Задачи подраздела
•ознакомление с техникой культивирования газоиспользующих микроорганизмов;
•использование теоретико-экспериментального подхода для нахождения продукционных характеристик и кинетических констант продуцирующей микробной культуры;
•демонстрация влияния соотношения C/N в среде на биосинтетическую программу накопления в клетках основных (белка) и запасных (жировых включений – полиоксиалканоатов) макромолекул;
•ознакомление с техникой детекции внутриклеточного пула макромолекул (микроскопия, химический анализ, хромато-масс-спектрометрия).
Объекты исследований: водородокисляющие бактерии Ralstonia eutropha.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
203 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА5.1. КУЛЬТИВИРОВАНИЕВОДОРОДОКИСЛЯЮЩИХБАКТЕРИЙВ ПЕРИОДИЧЕСКОЙКУЛЬТУРЕПОМЕТОДУШЛЕГЕЛЯ. ИЗУЧЕНИЕВЛИЯНИЯ КОНЦЕНТРАЦИИАЗОТАВСРЕДЕНАСКОРОСТЬРОСТАБАКТЕРИЙ
 Цель лабораторной работы
Цель лабораторной работы
•получение представления о методах культивирования водородокисляющих хемоавтотрофных бактерий. Провести эксперимент, который позволит оценить влияние соотношения C/N в среде на кинетические и продукционные характеристики культуры и внутриклеточный синтез основных и запасных макромолекул.
 Краткие теоретические сведения
Краткие теоретические сведения
Водородные бактерии – это перспективная для биотехнологических производств группа аэробных бактерий, продуцент ряда целевых продуктов (белка одноклеточных, аминокислот, ферментов, нуклеотидов, биоразрушаемых липидных полимеров – полигидроксиалканоатов).
Водородные бактерии широко распространены в природе. Это микроорганизмы так называемой микрофлоры рассеяния. Они характеризуются способностью к росту на минеральном субстрате за счет энергодающей реакции окисления водорода и использования углекислоты в качестве конструктивного субстрата. Энергию для роста водородные бактерии получают посредством окислительного фосфорилирования, сопряженного с переносом электронов от водорода к кислороду. Специфика хемолитотрофии на водороде заключается в функционировании в клетках водородоактивирующей системы. Активацию водорода и передачу электронов в ЦПЭ производит гидрогеназный ферментный комплекс по реакции: Н2 → 2Н+ + 2e. Продукты катаболизма – АТФ и восстановительные эквиваленты в виде НАДН потребляются главным образом при ассимиляции углекислоты в восстановительном пентозофосфатном цикле и на путях синтеза аминокислот. Среди ранних продуктов фиксации углекислоты – фосфоглицериновая кислота и первично синтезируемые аминокислоты (глутаминовая, аспарагиновая, аланин), служащие субстратом для синтеза всех остальных аминокислот. Липидные соединения образуются в результате превращения жирных кислот. В качестве запасных соединений бактерии накапливают полимеры оксипроизводных жирных кислот (полиоксиалканоаты, ПОА) и полифосфаты. Рост и направленность биохимической программы синтеза клеточных макромолекул у водородных бактерий определяются условиями внешней среды, прежде всего,
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
204 |
РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
условиями газового питания, а также концентрацией биогенных элементов, рН и температуры среды.
Основные субстраты энергетического и конструктивного обменов (водород и углекислоту), водородные бактерии черпают из газовой фазы через растворение в околоклеточной среде. Это определяют огромную роль условий газообеспечения в процессе выращивания бактерий. В связи с низкой растворимостью водорода и кислорода эффективное культивирование водородных бактерий может быть реализовано только в условиях интенсивной искусственной вентиляции культуры. Это обуславливает специфику методов культивирования водородных бактерий и управления процессом.
Выращивание водородных бактерий реализовано в лабораторных и пилотных аппаратах с использованием проточного и периодического методов культивирования.
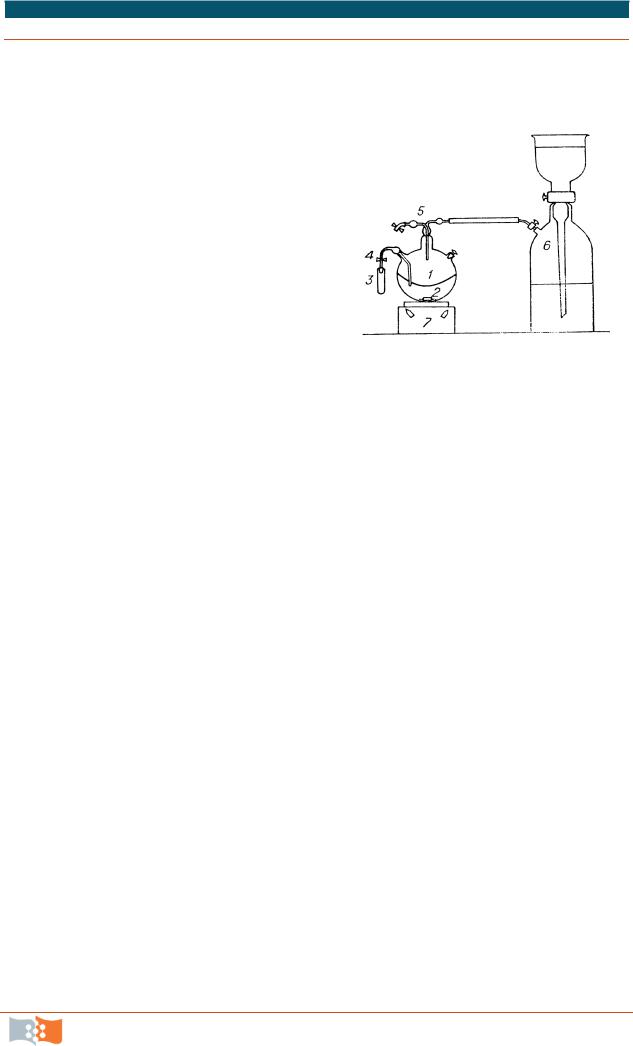
Рис. 5.2. Культивирование водородных бактерий на магнитной мешалке по методу Шлегеля: 1 – колба; 2 – магнит; 3 – пробоотборник; 4 – зажимы; 5 – насадка с фильтрами для подачи газовой смеси и продувания газовой фазы в колбе; 6 – газометр с газовой смесью; 7 – магнитная ме-
шалка ММ-2
Наиболее простой способ культивирования водородных бактерий можно реализовать в периодическом режиме с использованием магнитных мешалок и микробиологических шейкеров (рис. 5.2–5.3). Такие установки достаточно просты в работе и позволяют проводить исследования кинетики и физиологии роста бактерий и получить количество бактериальной биомассы (2-5 г/л) для проведения химических анализов.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
205 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
Рис. 5.3. Лабораторный шейкер Innova 44
Интенсификация исследований физиологии роста водородных бактерий в середине 70-х годов была связана с переходом к непрерывному методу культивирования. Применение непрерывных процессов существенно облегчает изучение кинетики микробного роста и создаёт возможности для эффективного управления процессом и его интенсификации.
Рост и продуктивность водородных бактерий существенно зависят от техники культивирования. Основная трудность заключается в необходимости подведения к клеткам большого количества газовой смеси, в которой доля малорастворимых водорода и кислорода достигает 90 % по объёму. Это обусловлено слабой растворимостью кислорода и особенно водорода в культуральной среде. Так, для обеспечения удельной скорости роста бактерий μ = 0,25 ч-1 при концентрации клеток в культуре 10 г/л по сухому веществу необходимо обеспечить скорости переноса из газовой фазы в жидкую, соответственно, для водорода 12 л/л·ч, кислорода 4,4 л/л·ч. Поэтому для выращивания водородных бактерий не приемлемы классические методы ферментации, использующие периодические культуры и большие установки с эрлифтным или барботажным способом аэрации. Решение этого вопроса заключалось в необходимости перехода от периодического культивирования к непрерывному и разработка аппаратов с повышенной интенсивностью массообмена.
 Материалы и оборудование
Материалы и оборудование
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
206 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
1.Музейная культура штамма R. eutrophus B-5786.
2.Автоклав для стерилизации сред и посуды.
3.Стерильный раствор базового фосфатного буфера для среды.
4.Маточные стерильные растворы микроэлементов, железа лимоннокислого, сульфата магния и хлористого аммония.
5.Шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, резиновые пробки с микробиологическими фильтрами.
6.Бокс-ламинар.
7.Термостатируемая качалка, лабораторный ферментер, газгольдер, вакуумный насос, газовые субстраты (водород, кислород, углекислота).
8.Термостат.
9.Cухо-жарочный шкаф.
 Характеристики оборудования
Характеристики оборудования
 Вертикальныйпрограммируемыйавтоматическийавтоклав
Вертикальныйпрограммируемыйавтоматическийавтоклав
Вертикальный программируемый автоматический автоклав Sanyo MLS3781L предназначен для стерилизации посуды и питательных сред (рис. 5.4).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
207 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
Рис. 5.4. Вертикальный программируемый автоматический автоклав Sanyo (Япония)
Технические характеристики:
Полезный объем 75 л; Размеры камеры, в мм: 370×640. Материал камеры: нержавеющая сталь SUS404. Внешние размеры, в мм: 600×979×560.
Автоклав рассчитан на максимальное давление, 0,235 МПа. Температура стерилизации от 105 ºС до 135 ºC.
Таймер стерилизации от 1 до 250 мин. Таймер поддержания температуры.
Задержка до 72 ч, автоматическое выключение. Программный таймер от 1 до 99 ч.
 Сухожарочныйшкаф«SANYO»
Сухожарочныйшкаф«SANYO»
Для высушивания посуды и биологических образцов до постоянного веса предусмотрен сухожарочный шкаф «SANYO», модель MOV 112F (рис. 5.5).
Технические характеристики
•диапазон стабилизации температуры от 40 до 250 ºC (200 ºC);
•наличие системы вынужденной циркуляции воздуха, обеспечиваю-
щей
•однородную температуру во всех точках камеры в диапазоне ±2,5 ºC
•(при 200 ºC); микропроцессорный контроль;
•возможность программирования до 3 температурных циклов;
•цифровой дисплей;
•материал внутренних поверхностей – нержавеющая сталь; мульти-
•функциональный таймер, рассчитанный на 99 ч 59 мин; наличие функции
•автоматического старта и остановки;
•объем 90 л; 2 полки;
•внутренние размеры 45×47,5×45; внешние – 58×59,5×82 см.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
208 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
Рис. 5.5. Сухожарочный шкаф SANYO MOV 112F (Япония)
 Бокс-ламинар«LABCONCO»
Бокс-ламинар«LABCONCO»
Получение посевного материала для засева (инокулирования) питательной среды, и все микробиологические манипуляции с музейной культурой, хранящейся на скошенной агаризованной среде при 5 оС, выполняют в стерильных условиях в боксе-ламинаре (рис. 5.6).
Технические характеристики бокса-ламинара LABCONCO
Бокс-ламинар обеспечивает надежную защиту продукта, оператора и окружающей среды; соответствует требованиям европейского EN 12469 и американского NSF49 стандартов; оборудован современными фильтрами ULPA с эффективностью очистки 99,9997%; имеет микропроцессорный контроль и система сигнализации; автоматическая компенсация воздушного потока; наклон фронтальной панели 10º, антимикробное покрытие столешн и- цы: на основе ионов серебра.
Бокс-ламинар оснащен микроволоконными минискладчатыми фильтрами ULPA (Ultra Low Penetrating Air), что позволяет достигнуть непревзойденных степеней очистки воздуха для частиц размером 0,12 мкм и 99,9997%
.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
209 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
Рис. 5.6. Бокс-ламинар LABCONCO (США)
Воздухозабор: Исходное значение 0,53 м/с. Нисходящий поток (70 %), м3/ч- 1134. Выходящий поток (30 %), м3/ч-677. Чистота рабочей зоны: Класс 2 согласно ISO 14644.1. Тип фильтра для нисходящего и выходящего воздуха: UPLA-фильтр в металлической защитной раме с уплотнителем, соответствие стандартам EN 1822 и IEST-RP-CC001.3.
Эффективность фильтрации: минимум 0,12мкм. Соответствует требованиям:
•NSF49; EN12469 и UL;
•по чистоте воздуха: ISO 14644.1 Class 2,П
•по эксплуатационным качествам фильтров: IEST-RP-CC034.1, IEST- RP-007.1.
Источник питания: напряжение в сети 220 В, частота 50 Гц.
 Микробиологическийтермостат«Binder»
Микробиологическийтермостат«Binder»
Микробиологический термостат Binder предназначен для культивирования микроорганизмов на плотных средах (рис. 5.7).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
210 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
Рис. 5.7. Микробиологический термостат Binder GmbH ( Германия)
Технические характеристики:
•цифровая настройка температуры с точностью в 0,1º C, регулируемый диапазон температур от 5ºC выше температуры окружающей среды до
100 ºC;
•регулируемая вентиляция; микропроцессорный контроль;
•устройство защиты от перегрева с независимой регулировкой, класс
3.1(DIN 12880) с визуальной сигнализацией; материал внутренних поверхностей – нержавеющая сталь; мультифункциональный таймер от 0 до 99 часов; объем 90 л; 2 полки; внутренние размеры 45×47,5×45 см.
 Автоматизированныйферментационныйкомплекс
Автоматизированныйферментационныйкомплекс
Контролируемое выращивание бактерий проводят с использованием автоматизированного ферментационного комплекса (рис. 5.8).
Технические характеристики
Модульная ферментационная система BioFlo 110 предназначена для культивирования микробных и клеточных культур. Она состоит из культурального сосуда, основного и силового блоков управления, насосного модуля, системы контроля пенообразования, системы контроля pH и концентрации растворенного кислорода.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
211 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
Культуральный сосуд автоклавируемый, имеет общий объем 14,0 л, рабочий объем 4,0–10,5 л. Оснащен нагревательной термоманжетой, крепежом и автоклавируемым стендом. Перемешивание среды осуществляется двойной мешалкой Раштона с прямым механическим приводом, скорость
50–1200 об/мин.
Рис. 5.8. Автоматизированный ферментационный комплекс Bio-Flo–110. Студентка Дарья Сырвачева отбирает пробы культуры для анализа
Контроль температуры осуществляется внешней нагревательной тер- мо-манжетой и высокоэффективной спиралью охлаждения с помощью про- порционально-интегрально-дифференциального (ПИД) регулятора с обратной связью. Максимальная температура составляет 70 0С.
Основной блок управления ферментера работает в режимах ферментации и культивирование клеток, с ручным и автоматическим управлением. Блок может поддерживать до 4 независимых рабочих сосудов, отслеживает 32 контура (с дополнительными модулями управления контурами). Дополнительные модули управления контурами распознаются автоматически. Оборудован VGA-дисплеем размером 86 х 114 мм, поддерживающим цифровой и графический форматы. Имеет флоппи-дисковод для установки обновлений программного обеспечения.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
212 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
Насосный модуль включает 4 перистальтических насоса для подачи субстратов, пеногасителя, щелочи/кислоты, удаления жидкости.
Модуль контроля pH и концентрации растворенного кислорода имеет ПИД-управление. Способен измерять pH в пределах 2–12, с контролем добавления кислоты/щелочи (требуются насосы) и подачи 4-х газов (требуется смеситель газов). Концентрация кислорода измеряется в пределах насыщения 0–100 %. Модуль регулирует перемешивание или насыщение кислородом, с автоматической подачей воздуха по датчику DO. При культивировании работает по схеме контроля 4х газов.
 Лабораторныевесы«Adventurer»
Лабораторныевесы«Adventurer»
Для взвешивания компонентов питательных сред, а также для определения биомассы предусмотрены лабораторные весы «Adventurer»™ OH– AR2140 (рис. 5.9).
Технические характеристики:
•автоматическая внутренняя калибровка двумя встроенными грузами или внешняя калибровка; имеется возможность калибровки пипеток;
•предел взвешивания 81/210 г; точность 0,01/0,1 мг;
•время стабилизации 12/5 с;
•возможность счета штук;
•возможность взвешивания брутто/нетто;
•наличие автоматического обнуления и тарирования;
•наличие автоматической калибровки при изменении температуры внешней среды;
Рис. 5.9. Лабораторные весы
«Adventurer»™ OH–AR2140 (США)
•возможность взвешивания в процентах;
•возможность измерения плотности образца с помощью встроенной программы; наличие калибровочных грузов;
•наличие набора для определения плотности;
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
213 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
• размер чашки весов 90 мм; размеры 20×30×45,7 см.
СтационарныйpH-метр
Стационарный pH-метр Sartorius предназначен для измерения pH, окислительно-восстановительного потенциала и температуры (рис. 5.10).
Рис. 5.10. Стационарный рН-метр Sartorius, Meter (Германия)
Технические характеристики
рН-метр укомплектован сетевым адаптером, позволяющим работать от сети переменного тока; имеется автоматическая компенсация температуры от минус 5 до 105 °С. Калибровка до 5 буферов с определением 10.
Сохранение до 200 результатов; выбор диапазона разрешения; pH от минус 2 до 18 с точностью до 0,01; mV: ± 1999,9 с точностью до 0,01; температура от минус 5 до 105 оС точностью до 0,3 оС. Электрод пригоден для использования в жидкостях.
Диапазон pH от 0 до 14; сенсор температуры; диапазон температуры от 0 до 80 °С; размеры – диаметр 12×120 мм. Прилагаются pH буферные растворы. Имеется универсальный штатив, поддерживающий до 4-х сенсоров или электродов; стакан и жидкости для хранения электрода.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
214 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
 НастольнаяцентрифугаEppendorf 5810 R
НастольнаяцентрифугаEppendorf 5810 R
Настольная центрифуга Eppendorf 5810 R позволяет отделить биомассу мицелия от культуральной жидкости (рис. 5.11).
Рис. 5.11. Настольная центрифуга Eppendorf 5810 R (США)
Технические характеристики
•объемы центрифугирования 1,5-400 мл (максимальный – 1600 мл);
•максимальная скорость 15500 об/мин;
•угловой ротор ×856 мл с максимальной скоростью вращения 12000 об/мин, автоклавируемый;
•температура от минус90 до 400 °С;
•минимальное время разгона и торможения менее 1 мин;
•функция отсчета времени после достижения заданной скорости;
•автоматическая фиксация крышки;
•охлаждение в режиме ожидания и функция «быстрого охлаждения»;
•автоматическое распознавание ротора;
•автоматическое отключение при дисбалансе;
•настройка параметров центрифугирования в процессе работы.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
215 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 5.1.1. Провести эксперимент, который позволит оценить влияние соотношенияC/N в среде на кинетические и продукционныехарактеристикикультуры ивнутриклеточный синтез основных и запасных макромолекул
Порядок выполнения работы
1.Студентам разделиться на 4 группы по числу заданных значений концентрации хлористого аммония в среде (0,8; 0,4; 0,2 и 0,1 г/л).
2.Каждой группе приготовить вариант питательной среды для бактерий с заданным значением азота:
•в микробиологическом боксе к 0,5 л среды в стерильных условиях над спиртовкой добавить 2,5 мл стандартного раствора железа, 1,5 мл раствора микроэлементов, 2 мл раствора сульфата магния и требуемый объем раствора хлорида аммония (в 1 мл которого содержится 100 мг соли);
•около 200 мл среды отбросить;
•оставшиеся 300 мл среды засеять инокулятом, смыв культуру с одного музейного “косяка”(использовать шпатели);
•инокулят разлить в три ферментационные колбы по 100 мл (три биологические повторности), используя стерильную мерную посуду;
•колбы плотно закрыть резиновыми пробками;
•колбы подписать (например, 1а, 1б, 1в);
•на ФЭК измерить оптическую плотность (без разведения) каждого инокулята;
•колбы установить на качалку и соединить с системой подачи газовой
смеси;
•в газгольдер подать газы, исходя из следующего объемного соотношения углекислота : кислород : водород = 1:2:7;
•с помощью насоса откачать воздух из колб и подать газовую смесь, подключив колбы к газгольдеру.
3.В течение 3-4-х дней проводить измерения оптической плотности культуры и по калибровочной кривой определить концентрацию биомассы в культуре (Х г/л).
4.Данные занести в табл. 5.1.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
216 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.1. КУЛЬТИВИРОВАНИЕ ВОДОРОДОКИСЛЯЮЩИХ БАКТЕРИЙ В ПЕРИОДИЧЕСКОЙ КУЛЬТУРЕ ПО МЕТОДУ ШЛЕГЕЛЯ
Таблица 5.1
Показатели роста культуры R. eutropha при различной обеспеченности азотом
|
|
|
Исходные |
|
Текущие |
|||
|
Концентрация |
|
показатели |
|||||
Группа № |
показатели инокулята |
|||||||
NH4Cl, (г/л) |
|
культуры |
||||||
|
|
|
|
|
||||
|
|
ОП |
|
Х, г/л |
ОП |
|
Х, г/л |
|
|
|
|
|
|
|
|
|
|
№ 1 |
|
|
|
|
|
|
|
|
Время от |
|
|
|
|
|
|
|
|
начала |
|
|
|
|
|
|
|
|
опыта, ч |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
 Контрольные вопросы
Контрольные вопросы
1.В чем специфика метаболизма водородокисляющих хемоавтотрофных микроорганизмов?
2.В чем основные трудности культивирования газоиспользующих микроорганизмов?
3.Что позволяет фиксировать в ходе культивирования водородных бактерий метод Шлегеля?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
217 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА5.2. ОПРЕДЕЛЕНИЕОСНОВНЫХКИНЕТИЧЕСКИХКОНСТАНТИ ПРОДУКЦИОННЫХХАРАКТЕРИСТИКМИКРОБНОЙКУЛЬТУРЫ
 Цель лабораторной работы
Цель лабораторной работы
•нахождение основных характеристик микробной культуры на основе экспериментальных результатов.
 Краткие теоретические сведения
Краткие теоретические сведения
Скорость роста является одним из основных показателей, характеризующих адекватность условий ферментации для микроорганизмов. Скорость роста (увеличение биомассы) организмов с бинарным делением в хорошо перемешиваемой среде в периодической культуре будет пропорционально концентрации микробной биомассы:
dX/d t= µX, |
(5.1) |
где dX/dt – скорость роста, Х – биомасса, µ – коэффициент пропорциональности («удельная скорость роста»); параметр аналогичен сложным процентам (например, если удельная скорость роста равна 0,1 ч–1, значит увеличение биомассы равно 10 % в 1 ч). Если величина µ постоянна, как это бывает в установившемся режиме культивирования, то интегрирование представленного уравнения дает
lnX = lnX0 +µ t |
(5.2) |
где Х0 – биомасса в начальный период времени t.
График зависимости lnX от времени будет иметь вид прямой линии с коэффицентом наклона µ.
Валовая (или общая) скорость роста v характеризуется абсолютным приростом биомассы за единицу времени:
v=dX/dt. (5.3)
Обе величины, удельная и общая скорость роста, характеризуют данную культуру в данных условиях и не являются количественной характеристикой штамма.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
218 |
РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.2. ОПРЕДЕЛЕНИЕ ОСНОВНЫХ КИНЕТИЧЕСКИХ КОНСТАНТ И ПРОДУКЦИОННЫХ ХАРАКТЕРИСТИК МИКРОБНОЙ КУЛЬТУРЫ
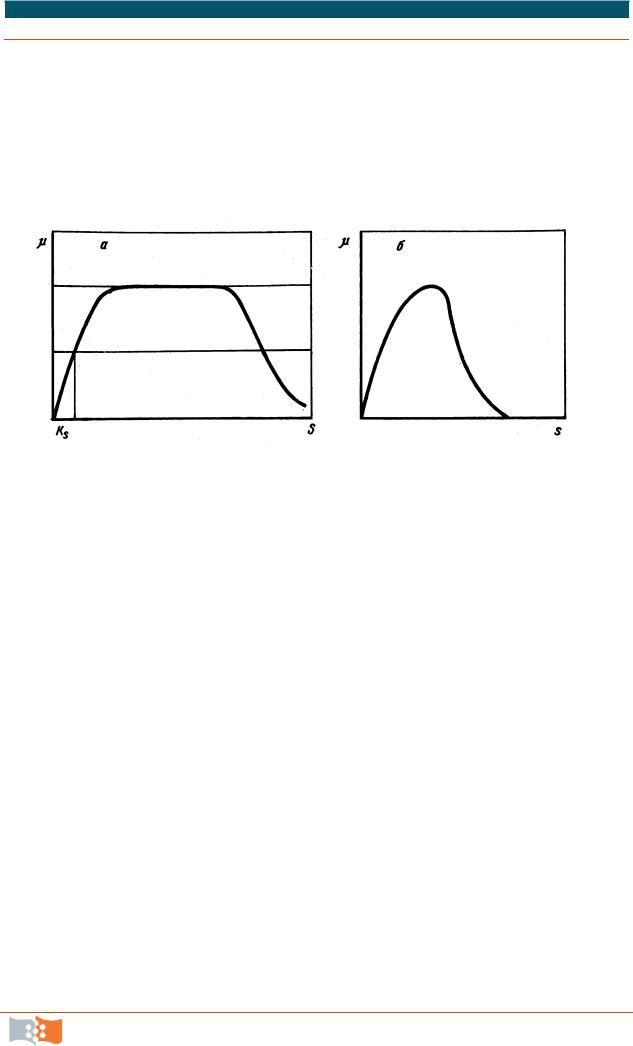
Рост культуры (µ) характеризуется кривой зависимости плотности популяции (биомассы) Х от концентрации субстрата S, обычно имеющей широкое плато (зону независимости величины биомассы от концентрации биогена) (рис. 5.12, а). Когда скорость роста микробной культуры ограничена не дефицитом субстрата, а воздействием ингибитора, кривая зависимости величины биомассы от концентрации ингибитора имеет иной вид (рис. 5.12, б).
а |
б |
Рис. 5.12. Зависимость скорости роста микробной культуры от концентрации
субстрата: а – зависимость µ от S (концентрации минерального субстрата);
б – зависимость µ от I (концентрации ингибитора)
Продуктивность процесса микробного роста характеризуется количеством продукта, получаемого на единицу объема биореактора в единицу времени. Продуктивность процесса зависит от многих факторов: активности продуцента, значений коэффициента выхода продукта из потребленного субстрата, количества активной биомассы в ферментере:
П = qs Yp/s X [г/л ч], |
(5.4) |
где qs – скорость потребления субстрата (метаболический коэффициент), Yp/s
– выход продукта (экономический коэффициент), X – концентрация биомассы, P – продукт, S – субстрат.
Выход продукта (Y) (экономический коэффициент) определяется как количество продукта, получаемого из данного количества субстрата:
Y = X/Sо – S, |
(5.5) |
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
219 |
РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.2. ОПРЕДЕЛЕНИЕ ОСНОВНЫХ КИНЕТИЧЕСКИХ КОНСТАНТ И ПРОДУКЦИОННЫХ ХАРАКТЕРИСТИК МИКРОБНОЙ КУЛЬТУРЫ
где S и So – конечная и исходная концентрации субстрата.
Данный коэффициент выражает эффективность использования субстрата для получения целевого продукта и является очень важной характеристикой, так как непосредственно связан с продуктивностью и позволяет непосредственно влиять на себестоимость конечного продукта. Экономический коэффициент имеет четкий физический смысл, характеризующей степень перехода энергии, заключенной в субстрате, в продукт. Данная величина необходима для расчетов и прогнозирования процесса в целом и используется в качестве параметра для контроля и управления ходом различных процессов и сопоставления их эффективности.
Конечная концентрация продукта должна планироваться с учетом продолжительности процесса и величины выхода продукта. Достижение высокой конечной концентрации продукта оправдано, когда выделение и концентрирование его трудоемки и дорогостоящи.
Непродуктивные затраты субстрата (h) – это затраты энергии субстрата, которые не связаны с образованием продукта. В общем виде они выражаются через экономический коэффициент:
h = Yэкспериментальный/Yтеоретический < 1. |
(5.6) |
Непродуктивные затраты существенно влияют на эффективность и экономику биотехнологического процесса, поэтому выявление причин и мест этих дополнительных трат энергического субстрата очень важно.
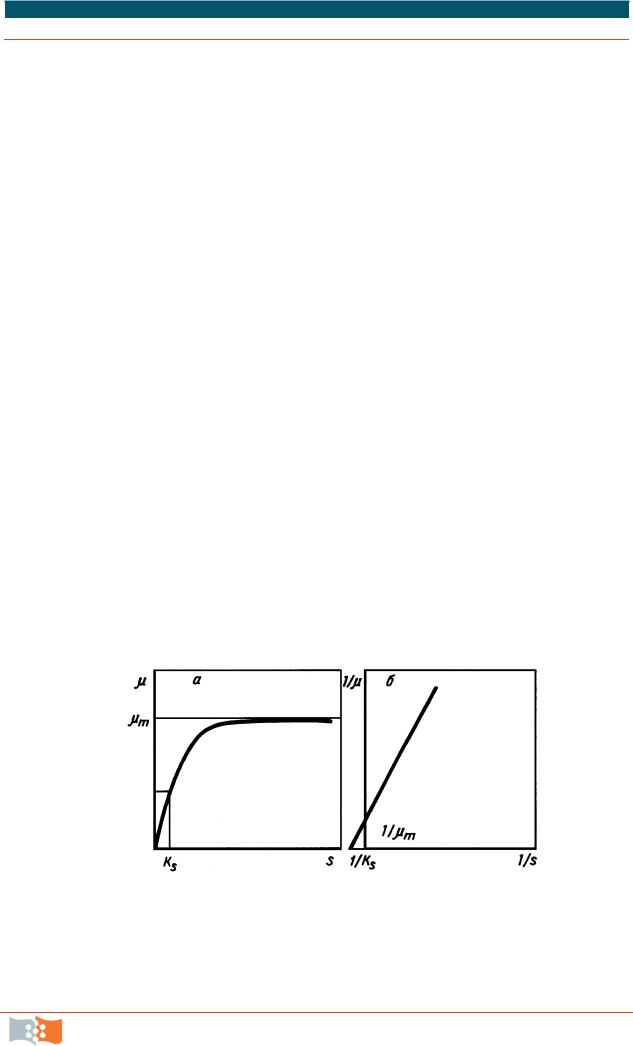
Рис. 5.13. Схема определения µmax и Ks методом обратных величин (по Лайнуиверу и Берку): а – зависимость µ от S, б – прямая отсекает 1/µmax и 1/Ks
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
220 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.2. ОПРЕДЕЛЕНИЕ ОСНОВНЫХ КИНЕТИЧЕСКИХ КОНСТАНТ И ПРОДУКЦИОННЫХ ХАРАКТЕРИСТИК МИКРОБНОЙ КУЛЬТУРЫ
Основой для изучения кинетики роста микробных культур служит метод острых опытов. Этим методом определяют основные показатели роста: субстратную константу Ks, константу ингибирования Ki, максимальную скорость роста µmax и влияние на них внешних факторов. Для этого клетки из экспоненциальной фазы роста помещают на короткий промежуток времени в среды с различной концентрацией исследуемого субстрата, а через короткий промежуток времени t2-t1 измеряют плотность культуры и вычисляют величину удельной скорости роста по уравнению (5.2). В контроле скорость роста не лимитирована субстратом, в экспериментальных пробах – лимитирована заданной концентрацией исследуемого субстрата. Полученные результаты обрабатывают по методу обратных величин Лайнуивера и Берка, µmax и Ks строят график зависимости 1/ и 1/S, после этого графически находят величины (рис. 5.13).
а |
б |
Рис. 5.14. Схема определения µmax и Ki методом обратных величин (по Лайнуиверу и Берку): а – зависимость µ от I, б – прямая отсекает 1/µmax и 1/Ki
Аналогичным способом находят константу ингибирования (Ki), к пробам растущей культуры добавляют различные дозы ингибитора и заменяют скорость роста при различных концентрациях последнего. Далее строится график, по которому графически определяют искомые величины: µmax и Ki
(рис. 5.14).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
221 |
РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.2. ОПРЕДЕЛЕНИЕ ОСНОВНЫХ КИНЕТИЧЕСКИХ КОНСТАНТ И ПРОДУКЦИОННЫХ ХАРАКТЕРИСТИК МИКРОБНОЙ КУЛЬТУРЫ
 Материалы и оборудование
Материалы и оборудование
1. Персональный компьютер
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 5.2.1. Определение основных кинетических констант и продукционных характеристик микробнойкультуры
Порядок выполнения работы
1. Используя известные уравнения, определить значения удельной скорости роста при заданных (четырех) концентрациях азота в среде (из результатов табл. 5.1), а также вычислить продуктивность культуры и экономический коэффициент по азоту. Значения занести в табл. 5.2.
Таблица 5.2
Влияние концентрации NH4Cl в среде на характеристики культуры R. eutropha
NH4Cl, |
Средняя (вало- |
Удельная ско- |
Продуктивн |
Экономический |
вая) скорость рос- |
рость роста |
ость культу- |
коэффициент |
|
г/л |
та R.eutropha |
R.eutropha |
ры, (г/л ч) |
Y, г/г |
|
2.Построить график зависимости удельной скорости роста бактерий R.eutropha от концентрации NH4Cl в среде.
3.Используя графоаналитический метод Лайнуивера–Берка построить график зависимости обратных величин удельной скорости роста от обратной величины концентрации азота в среде.
4.Вычислить и записать найденные значения Ks культуры R. eutropha.
 Контрольные вопросы
Контрольные вопросы
1.Каковы основные продукционные и кинетические характеристики микробных культур?
2.Почему нахождение μmax невозможно экспериментальным путем?
3.Чем отличается характер воздействия на клетку факторов лимитирования и ингибирования роста?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
222 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА5.3. ИССЛЕДОВАНИЕВЛИЯНИЯКОНЦЕНТРАЦИИNH4Cl ВСРЕДЕНА СИНТЕЗОСНОВНЫХ(АЗОТСОДЕРЖАЩИХ) МАКРОМОЛЕКУЛБАКТЕРИЯМИR. eutropha
 Цель лабораторной работы
Цель лабораторной работы
•демонстрация влияния соотношения C/N в среде на биосинтетическую программу накопления в клетках микроорганизмов макромолекул.
 Краткие теоретические сведения
Краткие теоретические сведения
Процессы микробного синтеза делятся на два типа: 1) процессы, связанные с ростом биомассы и происходящие параллельно со скоростью размножения клеток, 2) процессы, происходящие или ускоряющиеся при замедлении скорости роста клеток. Оптимизация обоих типов процессов осуществляется различными путями в зависимости от того, насколько совпадает (или не совпадает) оптимизация скорости роста со скоростью синтеза макромолекул той или иной природы.
Процесс роста – это процесс синтеза первичных метаболитов (аминокислот, органических кислот, витаминов, нуклеотидов, промежуточных продуктов катаболизма) и их сборка в основные клеточные макромолекулы (белки, нуклеиновые кислоты, полимеры, образующие клеточную стенку). Рост и синтез этих продуктов максимален, когда клетка максимально обеспечена субстратом. В периодической культуре это происходит в экспоненци- альной–начале линейной фаз роста культуры. Таким образом, оптимизация процесса накопления максимальной биомассы клеток в культуре и синтеза первичных продуктов обмена сводится к оптимизации условий питания и созданию условий сбалансированного роста для культуры.
Накопление продуктов обмена, происходящих во второй фазе развития культуры (конец линейной – начало стационарной фаз роста культуры) – запасных соединений (полифосфатов, полисахаров, липидов) или вторичных продуктов обмена (антибиотиков, терпенов, стероидов) имеют для микробной технологии большое значение. Накопление запасных соединений в клетках происходит при несбалансированном росте вследствие исчерпания из среды какого-либо биогена и/или лимитирования процесса синтеза основных макромолекул.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
223 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.3. ИССЛЕДОВАНИЕ ВЛИЯНИЯ КОНЦЕНТРАЦИИNH4Cl В СРЕДЕ НА СИНТЕЗ ОСНОВНЫХ МАКРОМОЛЕКУЛ
Синтез вторичных продуктов обмена (идиолитов) реализуется в клетке в случае замедления и остановки роста в конце развития популяции (конец стационарной фазы – фаза отмирания), когда происходит дерепрессия ферментов, катализирующих реакции образования данных соединений, и репрессированных на стадии сбалансированного роста. Оптимизация процесс синтеза запасных соединений и вторичных метаболитов более сложна, так как требует специальных знаний о закономерностях образования тех или иных макромолекул и специфических подходов в каждом конкретном случае.
При лимитации роста микроорганизмов отдельными элементами минерального питания происходит замедление скорости роста клеток, сопровождающееся значительными изменениями химического состава, главным образом, соотношения основных и запасных макромолекул. Выявление принципиальных закономерностей этих изменений открывает широкие возможности для направленного изменения составом микробной биомассы и целевого получения конкретных продуктов микробиологического синтеза. Более того, помимо изменения направленности биохимической программы синтеза основных и запасных соединений, лимитация роста клеток тем или иным минеральным элементом позволяет дополнительно регулировать химическую структуру отдельных соединений, входящих в состав клеток.
Отправным моментом является изменение соотношения C/N в питательной среде. Клетки, лимитированные по азоту и не способные синтезировать основные соединения (белки и нуклеиновые кислоты), потребляя углерод, направляют его на образование различных безазотистых соединений углеводной и липидной природы. Качественный состав запасных соединений, синтезируемых при лимитации роста микроорганизмов по азоту на фоне избытка углерода (увеличение отношения C/N), определяется спецификой физиолого-биохимических свойств конкретных микробных видов, а также штаммов.
 Материалы и оборудование
Материалы и оборудование
1.Образцы высушенной биомассы A. eutrophus B-5786, выращенной при различной концентрации NH4Cl в среде.
2.Лабораторные весы «Adventurer»™ OH–AR2140
3.Пробирки для содержания азота в биомассе мирометодом Къельдаля.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
224 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.3. ИССЛЕДОВАНИЕ ВЛИЯНИЯ КОНЦЕНТРАЦИИNH4Cl В СРЕДЕ НА СИНТЕЗ ОСНОВНЫХ МАКРОМОЛЕКУЛ
4.Растворы H2SO4, Н2О2, реактива Несслера, эталон.
5.Шпатели, мерная посуда, пипетки.
6.Песочная баня.
7.Фотоэлектрокалориметр.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 5.3.1. Исследовать зависимость влияниеконцентрации nh4cl в средена синтез основных (азотсодержащих) макромолекул бактериями R. eutropha
Порядок выполнения работы
1. Студентам разделиться на 4 группы (по числу проб биомассы). Параллельно пробам ставят 1 пробирку (холостая проба), в которую вносят 2 мл
H2SO4.
2.Из каждой пробы взять навеску абсолютно сухой биомассы (АСБ) по 40 мг и поместить ее в пробирку объемом 20 мл.
3.Осторожно под вытяжкой внести в каждую пробирку 2 мл концентрированной H2SO4.
4.Открытые пробирки с пробами биомассы разместить на предварительно нагретой до 230 0С песочной бане на 40 мин.
5.Пробирки извлечь из песка, охладить при комнатной температуре.
6.К полученным охлажденным пробам прилить по 1 мл Н2О2 и снова разместить на песочной бане еще на 1 ч до полного просветления жидкости.
7.Каждую пробу, включая холостую, в отдельности развести дистиллированной водой в 100-200 раз (используя мерные колбы объемом 100 мл).
8.Из каждой пробы отбирается в двух химических повторностях по 2 мл, добавляется 8 мл дистиллированной воды и вносится кусочек красной лакмусовой бумаги; содержимое титруется 30 %-м раствором NaOH до щелочной реакции (бумажка должна стать синей). Далее в каждую пробирку вносят 0,5 мл реактива Несслера.
9.Измерить на ФЭК оптическую плотность проб (синий светофильтр) относительно холостой пробы.
10.По результатам измерения определить содержание общего азота в пробах по формуле
Сх= Сэ Dх/Dэ Vx 1000 г/л или 100 % ,
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
225 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.3. ИССЛЕДОВАНИЕ ВЛИЯНИЯ КОНЦЕНТРАЦИИNH4Cl В СРЕДЕ НА СИНТЕЗ ОСНОВНЫХ МАКРОМОЛЕКУЛ
где Сэ – концентрация азота в эталоне; Dэ и Dx – оптическая плотность этанола
ипробы; Vx – разведение пробы.
11.Полученное значение содержания общего азота в биомассе (в %) умножить на коэффициент 6,25. Произведение есть содержание сырого протеина в биомассе бактерий (в % к абсолютно сухой биомассе).
12.Полученные результаты занести в табл. 5.3.
Таблица 5.3
Зависимость внутриклеточного содержания сырого протеина у бактерий R. eutropha от обеспеченности азотоми соотношения С/N в среде
NH4Cl, |
Соотношение |
Содержание в биомассе |
|
|
|
г/л |
R. eutropha (в %) |
|
|
||
в среде С/N |
|
|
|||
|
Nобщ |
протеина |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13. Построить график зависимости внутриклеточного содержания азота от концентрации NH4Cl в среде.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
226 |
РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА5.4. ОПРЕДЕЛЕНИЕВЛИЯНИЯСООТНОШЕНИЯС/N ВСРЕДЕНА БИОСИНТЕТИЧЕСКУЮПРОГРАММУСИНТЕЗАЗАПАСНЫХМАКРОМОЛЕКУЛНА ПРИМЕРЕПОЛИМЕРОВГИДРОКСИПРОИЗВОДНЫХАЛКАНОАТОВКИСЛОТ(ПГА)
 Цель лабораторной работы
Цель лабораторной работы
•ознакомление с процессом накопления в клетках R. eutropha при несбалансированном росте, вызванном увеличением отношения C/N в среде гидроксипроизводных жирных кислот (полигидроксиалканоатов) – целевого продукта биотехнологии.
 Краткие теоретические сведения
Краткие теоретические сведения
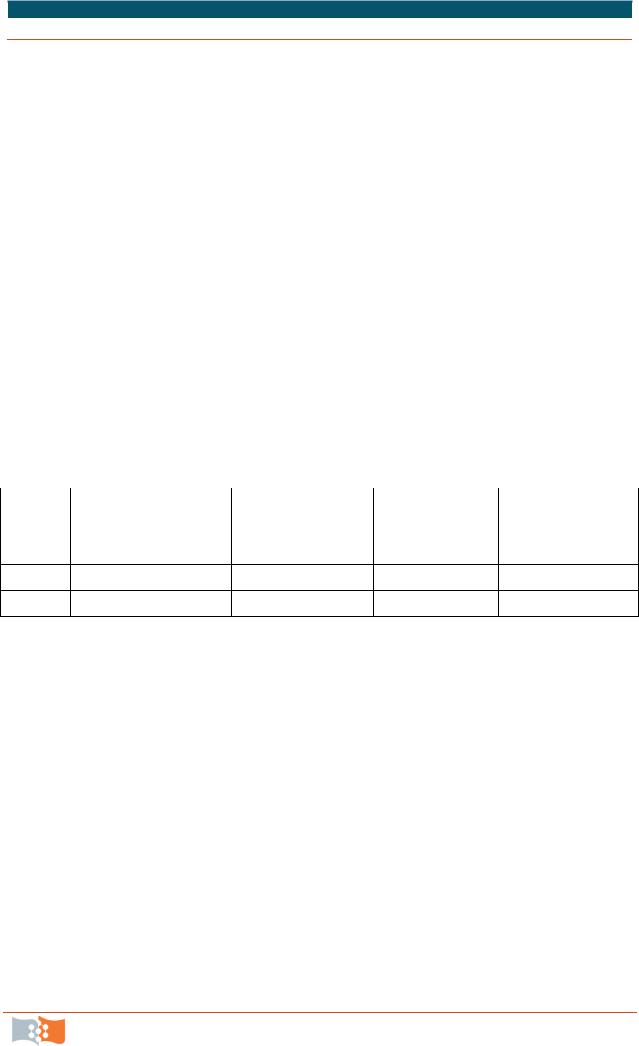
Полигидроксиалканоаты (ПГА) – полимеры гидроксипроизводных жирных кислот, синтезируются прокариотическими микроорганизмами в специфических условиях несбалансированного роста при избытке углеродного и энергетического субстрата в среде и при
дефиците минеральных элементов (азота, серы, фосфатов и др.), а также кислорода. Наиболее изучен полигидроксибутират – полимер β- гидроксимасляной кислоты (С4Н6О2).
Биохимические пути синтеза полигидроксибутирата. Углерод, ассимилированный клетками тем или иным путем, превращается в пируват, который декарбоксилируется с образованием ацетил-КоА. Последний включается в реакции цикла трикарбоновых кислот, и при нарушениях в системах амфиболизма, вызванных дефицитом структурных элементов для синтеза белка, не становится предшественником аминокислот, а подвергается поликонденсации, далее восстанавливается с участием НАДН в реакциях β-окисления в оксимасляную кислоту, которая подвергается полимеризации с образованием полигидроксибутирата (рис. 5.15).
Процесс накопления полигидроксибутирата осуществляют микробные клетки при несбалансированном росте, например голодающие по азоту или кислороду, то есть медленно растущие. При этом возникает проблема, как получить большие урожаи биомассы с одновременным большим содержанием полимеров. Высокопродуктивные проточные системы ферментации не приемлемы для больших выходов ПГА. Процесс проводят в периодическом
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
227 |
РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.4. ОПРЕДЕЛЕНИЕ ВЛИЯНИЯ СООТНОШЕНИЯ С/N В СРЕДЕ НА БИОСИНТЕТИЧЕСКУЮ ПРОГРАММУ
режиме, обычно в две стадии. На первой клетки, получая все необходимые питательные вещества, растут с достаточно высокими скоростями и образуют практически всю биомассу; на втором этапе процесс продолжается при избытке углерода и энергии в среде, но при дефиците одного их биогенных элементов. В результате происходит включение ассимилированных клетками углерода, главным образом, в полимер, выходы которого могут достигать свыше 70-80 % к весу сухого вещества клетки.
3ФГК  2ФГК
2ФГК  фосфоэнолпируват
фосфоэнолпируват
Ацетил-КоА Ацетацетил-КоА
ацетацетат |
|
|||
|
|
|
оксибутирил-КоА |
|
β-оксимасляная |
||||
|
||||
кислота |
|
|||
полимер
β-оксимасляной кислоты
Рис. 5.15. Схема биосинетза полигидроксибутирата бактериями
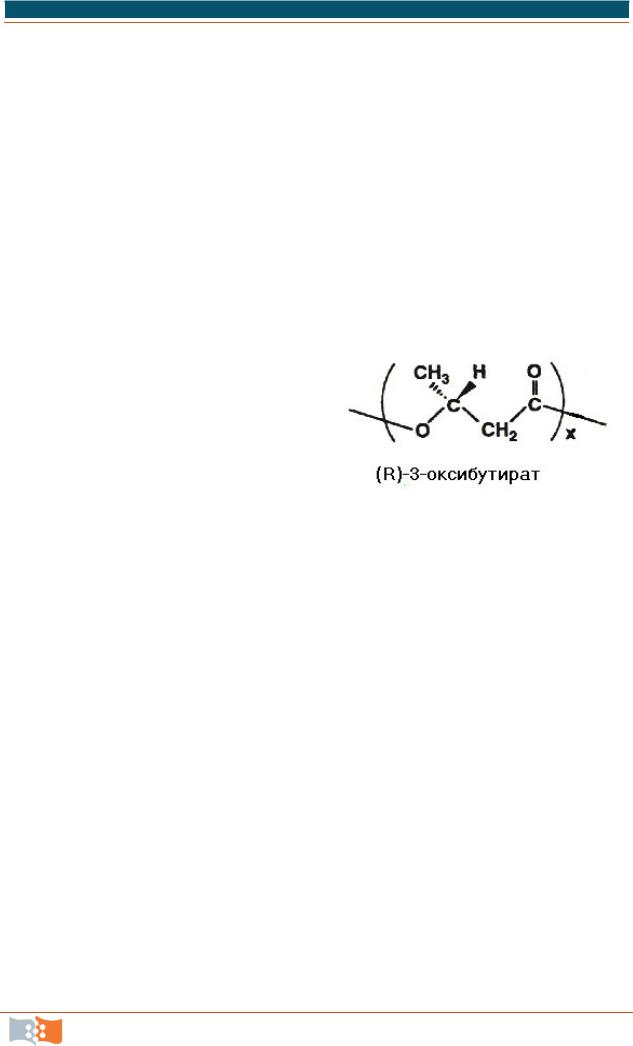
Полимер накапливается в клетках в виде гранул, количество и размеры которых зависят от содержания полимера, и при его максимальной концентрации практически полностью занимают объем клетки. На рис. 5.16 представлены СЭМ: снимки клеток R. eutropha с различным содержанием полимера.
Практический интерес и значимость данных исследований определяются свойствами ПГА, которые по своим базовым показателям близки к полипропилену, но обладают также рядом уникальных свойств, включая совместимость с животными тканями, оптическую активность, пьезоэлектрические и антиоксидантные свойства и, самое главное, биодеградабельность.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
228 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.4. ОПРЕДЕЛЕНИЕ ВЛИЯНИЯ СООТНОШЕНИЯ С/N В СРЕДЕ НА БИОСИНТЕТИЧЕСКУЮ ПРОГРАММУ
Свойства ПГА делают их перспективными для применения в различных сферах: медицине и хирургии (прочный рассасываемый хирургический материал, элементы для остеосинтеза, сосудистой пластики, пленочные покрытия ран и ожоговых поверхностей, одноразовые изделия, в т. ч. нетканые материалы), фармакологии (пролонгация действия лекарственных веществ), пищевой промышленности (предупреждение окислительной порчи напитков и продуктов, упаковочные материалы), сельском хозяйстве (обволакивание семян, покрытие удобрений и пестицидов), радиоэлектронике, коммунальном хозяйстве (различные разрушаемые упаковочные материалы и тара) и пр.
Рис. 5.16. Клетки Ralstonia eutropha B 5786 из различных фаз роста периодической культуры в ходе аккумуляции полигидроксибутирата (ПГБ): 1 – клетки 4-часовой культуры не содержат полимера; 2 – 10-часовая культура, в клетках 26 % ПГБ; 3 – 40-часовая культура, в клетках 54 % ПГБ; 4 – 70-часовая культура, в клетках 85 % ПГБ (материалы Т. Г. Воловой)
 Материалы и оборудование
Материалы и оборудование
1.Образцы высушенной биомассы R.eutrophus B-5786, выращенной при различной концентрации NH4Cl в среде.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
229 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.4. ОПРЕДЕЛЕНИЕ ВЛИЯНИЯ СООТНОШЕНИЯ С/N В СРЕДЕ НА БИОСИНТЕТИЧЕСКУЮ ПРОГРАММУ
2.Лабораторные весы «Adventurer»™ OH–AR2140.
3.Колбочки с притертым пробками для проведения метанолиза биомассы.
4.Растворы H2SO4, бензойной кислоты (стандарт), метанол.
5.Шпатели, мерная посуда, пипетки.
6.Водяная баня-термостат WB-4MS фирмы «BioSan».
7.Хромато-масс-спектрометр Agilent 5975Inert (подробно – в разделе 6).
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 5.3.1. Изучение зависимости накоплениявклетках R. eutropha внутриклеточногосодержания ПОА отконцентрации NH4Cl в среде
Порядок выполнения работы
1.Разделиться на 4 группы (по числу проб биомассы).
2.Из каждой пробы взять навеску биомассы по 4 мг и поместить ее в колбочку объемом 5 мл.
3.Осторожно, под вытяжной вентиляцией внести в каждую колбочку 0,1 мл метанола, cтандартног раствора бензойной кислоты (0,1 мг).
4.Колбочки прикрепить к обратным холодильникам и разместить на водяной бане при 100 0С на 45 мин. После охлаждения добавить к каждой пробе по 1 мл дистиллированной воды для расслоения раствора (в верхней части собирается серная кислота и метанол; в нижней – метиловые эфиры жирных кислот, входящие в состав полимера).
5.Снять хроматограммы метиловых эфиров в приготовленных пробах на масс-спектрометре и по полученным пикам на хроматограммах относительно пика стандарта (бензойная кислота) вычислить содержание полимера
впробах (в % к АСБ) (процедура подробно будет описана в разделе 6).
6.Полученные результаты занести в табл. 5.4.
7.Построить график зависимости внутриклеточного содержания ПОА от концентрации NH4Cl в среде.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
230 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.4. ОПРЕДЕЛЕНИЕ ВЛИЯНИЯ СООТНОШЕНИЯ С/N В СРЕДЕ НА БИОСИНТЕТИЧЕСКУЮ ПРОГРАММУ
Таблица 5.4
Зависимость внутриклеточного содержания полигидроксибутирата у бактерий R. eutropha от обеспеченности азотом и соотношения С/N в среде
|
Соотношение в |
Содержание по- |
Соотношение |
|
NH4Cl, г/л |
азот/полимер |
|||
среде С/N |
лимера, % |
|||
|
в клетках |
|||
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 Контрольные вопросы
Контрольные вопросы
1.Каковы пути для оптимизации выхода первичных метаболитов в микробной культуре?
2.Как коррелирует соотношение C/N в питательной среде с биохимической направленностью синтеза клеточных макромолекул?
3.Каковы условия для суперпродукции полигидроксиалканоатов и в чем их ценность?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
231 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА5.5. ОПЫТНОЕПРОИЗВОДСТВОРАЗРУШАЕМЫХБИОПОЛИМЕРОВ
 Цель лабораторной работы
Цель лабораторной работы
•ознакомление с принципом конструирования и функционирования опытного биотехнологического производства
 Задачи лабораторной работы:
Задачи лабораторной работы:
•в ходе экскурсии на ОПУ ознакомить с комплектацией, аппаратурной и технологической схемами, принципом функционирования, способами получения конечного продукта (ПГА – биопластиков).
 Краткие теоретические сведения
Краткие теоретические сведения
Реализация любой новой микробной технологии в условиях опытного производства (ОПУ) является необходимым этапом для масштабирования процесса и реализации промышленного производства. Испытание технологии в условиях ОПУ позволяет уточнить физико-химические параметры процесса ферментации, составить материально-энергетический баланс, разработать технологический регламент и получить партии продукта, необходимые для проведения комплекса исследований.
Создание oпытного производства ПГА стало логическим результирующим этапом выполненных комплексных многопрофильных научных исследований, проводимых в Научно-образовательном центре «Енисей» ФГАОУ ВПО СФУ. Полученные результаты позволили перейти к следующему этапу – масштабированию технологии, пpоектиpованию и созданию опытного производства полигидроксиалканоатов.
Опытное производство ПГА укомплектовано серийным и нестандартным оборудованием, сконструированным и изготовленным в экспериментальных механических мастерских Института биофизики СО РАН; оно размещено и оборудовано в соответствии со стандартом GMP. Помещение ОПУ оборудовано входным тамбуром с двойной дверью, системой противопожарной сигнализации, индивидуальной вентиляцией, УФ-системой стерилизации воздуха.
Вкачестве продуцента используют бактерии Ralstonia eutropha B 5786 и
В8596. Для получения полимеров штаммы выpащивают в пеpиодическом
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
232 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.5. ОПЫТНОЕ ПРОИЗВОДСТВО РАЗРУШАЕМЫХ БИОПОЛИМЕРОВ
pежиме. Бактерии культивируют в условиях защищенной ферментации на стандартной солевой среде на основе фосфатного буфера. В ходе культивирования бактерий стабилизированы температура, скорость перемешивания культуры и режим аэрации. Воздух в ферментеры подают через стерильные металлокерамические фильтры. Стабилизация текущих концентраций углеродного субстрата (фруктоза или глюкоза) и азота в культуре на заданном уровне осуществляется перистальтическими насосами-дазаторами марки DP2-2 (Laboratechnik, Германия); рН среды составляет около 7,0 и корректировки не требует. Температура среды в ферментере стабилизирована на уровне (30±0,2) оС путем автоматического ввода охлаждающей воды в теплообменную рубашку через магнитный клапан, связанный с термопарой и вторичным прибором; изменение температуры среды в рабочем объеме аппарата составляло ±0,3 0С; расход воды не превышал 0,2 м3/ч. В ходе отработки процесса синтеза ПОА в условиях ОПУ измерение кислорода в культуре проводят с использованием измерительной ячейки и кислородного датчика полярографического типа; концентрацию углеродного субстрата (фруктозы или глюкозы) – портативным цифровым поляриметром марки ИГП-01 (Россия). Контролируется накопление биомассы в культуре посредством измерением оптической плотности культуры и по весу абсолютно сухого вещества; содержание и состав полимера – после предварительного метанолиза образцов биомассы и выделенного полимера на хроматомасс-спектрометре
GCD plus (Hewlett Packard, США).
АппаpатуpаопытногопроизводстваитехнологияполученияПГА
Для стерилизации технологического оборудования установлен парогенератор марки ПЭЛ-100 (Россия; производительность до 25 кг/ч, рабочее давление 0,15 МПа); для получения инокулята – термостатируемая качалка и ферментер-инокулятор, представляющий собой аппарат с рубашкой и четырехлопастной мешалкой с регулируемым числом оборотов (до 1000 об/мин); для обеспечения процесса кислородом использованы аэропомпа марки EL200 (Япония), производительность по воздуху 9 м3/ч, мощность 0,3 кВт, давление 5000 Па и винтовой компрессор марки «Zenith 5.5 HP/270» (Италия), объем ресивера 270 л, давление 0,8 МПа, мощность 4 кВт, производительность 34,8 м3/ч; для концентрирования культуральной жидкости – вакуумвыпарная установка УВВ-50 (ОАО «Биохиммаш», Россия), производительность 20-25 кг/ч, остаточное давление в установке 0,015-0,03 МПа; для стерилизации питательных сред– автоклав ГК-100-3 (Россия), рабочее давление
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
233 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.5. ОПЫТНОЕ ПРОИЗВОДСТВО РАЗРУШАЕМЫХ БИОПОЛИМЕРОВ
в камере 0,22 МПа, мощность нагревателей 16 кВт; для получения дистиллированной воды – аквадистиллятор ДЭ-25 «СПб» (Россия),
Рис. 5.17. Общий вид ОПУ и основных технологических блоков (материалы Т. Г. Воловой)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
234 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.5. ОПЫТНОЕ ПРОИЗВОДСТВО РАЗРУШАЕМЫХ БИОПОЛИМЕРОВ
производительность 25 дм3/ч; для подготовки биомассы при экстракции полимера – экстрактор 0,075/6,0 (Россия; объем 0,075 м3, скорость вращения мешалки 30 об/мин, мощность электродвигателя 0,55 кВт); для очистки полимеров и регенерации реагентов – блок собственной конструкции.
Общий вид отдельных блоков ОПУ представлен на рис. 5.17.
Полученный на первой стадии процесса инокулят переносят в фермен- тер-инокулятор. Инокулятор предназначен для накопления бактериальной массы (инокулята) при перемешивании и подачи стерильного воздуха в количестве 0,1–2 м3/ч. Установка обвязана трубопроводами для подвода холодной воды в рубашки конденсатора и корпуса аппарата; гибкими шлангами для отвода отработанной воды; паропроводом для стерилизации внутренних частей корпуса аппарата и воздухопроводом. Из ферментераинокулятора посевной материал по стерильной посевной линии с помощью перепада давления подают в производственный ферментер. Ферментер предназначен для культивирования микроорганизмов в режиме накопления полимера при перемешивании в рабочем объеме до 60 л и подачи стерильного воздуха при атмосферном давлении. Производственный ферментер обвязан трубопроводами для подвода холодной воды в рубашки конденсатора и корпус аппарата, гибкими шлангами для отвода отработанной воды, паропроводом для стерилизации внутренних частей корпуса аппарата; воздухопроводом.
На постферментационной стадии осуществляется концентрирование бактериальной культуры до получения сырой пасты биомассы, из которой выделяют полимер. Концентрирование культуральной среды осуществляется с использованием вакуумно-выпарного аппарата ВВУ-50 и напольной центрифуги К-70. Вакуум-выпарная установка предназначена для сгущения бактериальной суспензии путем испарения воды (10–50 кг/ч) при ее кипении под вакуумом (рабочее абсолютное давление 0,013–0,02 МПа). Процесс экстракции полимера проводят в блоке выделения, который состоит из аппарата (экстрактора) с турбинной мешалкой, четырех конически-цилиндрических отстойников и аппарата (осадителя) с рамной мешалкой. Установка обвязана системой трубопроводов для подвода и отвода охлаждающей воды.
Концентрирование бактериальной культуры проводят в вакуумвыпарной установке УВВ-50 при температуре 41–45 оС и абсолютном давлении 0,008-0,01 МПа в течение 1,5 –2 ч. Это позволяет получить плотную суспензию с концентрацией биомассы 80–150 г/л по абсолютно сухому вещест-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
235 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.5. ОПЫТНОЕ ПРОИЗВОДСТВО РАЗРУШАЕМЫХ БИОПОЛИМЕРОВ
ву. При последующем центрифугировании суспензии при 5 000 об/мин получают бактериальную пасту с остаточной влажностью 50–55 %.
Для выделения ПГА из бактериальной биомассы возможно, как известно, применение широкого спектра реагентов (хлороформ, хлористый метилен, гипохлорит натрия, дихлорэтан, тетрахлорэтан, диоксан и др.), а для осаждения полимерных экстрактов пригодны изопропанол, этанол, гексан, тетрагидрофуран, диметилформамид. Проведенные исследования показали, что в зависимости от процедуры экстракции полнота выделения полимера и его чистота значительно варьируют. Существенным моментом на этой стадии является возможность повторного использования реагентов, расход которых велик. Подбор реагентов для экстракции и выделения полимера, имеющих значительный (более 35-40 оС) разрыв температуры кипения и не образующих азеотропных смесей, позволил в условиях ОПУ организовать их разделение и возврат в процесс. Экстракцию полимера из бактериальной пасты проводили в аппарате с мешалкой в течение 10-12 ч. Полученную массу перемещали в отстойники-разделители, где в течение 10-12 ч происходило разделение смеси на шрот (который скапливается в верхней части аппарата) и экстракт полимера. Экстракт сливается в сборную емкость и подается для концентрирования в испаритель, встроенный в кубовой части ректификационной колонны, где осуществляется испарение растворителей при кипении под вакуумом. Далее происходит конденсация паров в теплообменнике колонны и накопление их в сборной емкости. Собранные на этой стадии растворители используют для новых циклов экстракции. Сконцентрированный полимерный экстракт переносят в аппарат с мешалкой (осадитель). Выделившийся полимер отжимают в центрифуге и переносят в сушильный шкаф, где при контакте с воздухом при комнатной температуре происходит высушивание до готового продукта с остаточной влажностью (0,70±0,25) %.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
236 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
Подраздел5.2. МЕТОДЫКУЛЬТИВИРОВАНИЯМИЦЕЛИАЛЬНЫХГРИБОВ
 Цель подраздела
Цель подраздела
•освоение методов выращивания грибов в периодической культуре.
 Задачи подраздела
Задачи подраздела
•знакомство с оборудованием и средами для культивирования грибов;
•определение биотехнологических показателей культуры гриба при различных условиях выращивания.
 Краткие теоретические сведения
Краткие теоретические сведения
Мицелиальные грибы при росте в жидкой питательной среде в поверхностных условиях образуют на поверхности питательной среды мицелиальную пленку, дифференцированную на субстратный и воздушный мицелий. Питательные вещества среды поглощаются клетками гиф субстратного мицелия и внутригифально транспортируются к растущим терминальным клеткам воздушного мицелия. Клетки субстратных гиф обладают определенной автономностью и поставляют вещества в те воздушные гифы, которые от них берут начало. Поверхностные биотехнологические системы используют для получения биомассы грибов, продуктов метаболизма и конидий.
При глубинном методе культивирования мицелий погружен в жидкую аэрируемую питательную среду на весь период ферментации. Глубина погружения различна (от 0 до 10 м) и зависит от массообмена, вызываемого аэрацией, конструкции мешалки и других факторов.
Мицелиальные грибы при росте в жидкой питательной среде в глубинных условиях не образуют пленку, и их мицелий не дифференцируется на субстратный и воздушный, а растет в виде аморфных микроколоний, иногда образует сферические микроколонии правильной и неправильной формы диаметром от 0,5 до 5 мм.
Погруженное культивирование имеет ряд преимуществ по сравнению с поверхностным: для мицелия, растущего в толще питательной среды, создаются одинаковые условия (химические, физические); перемешивание питательной среды и непрерывная аэрация способствуют росту мицелия и накоп-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
237 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
Подраздел 5.2. МЕТОДЫ КУЛЬТИВИРОВАНИЯ МИЦЕЛИАЛЬНЫХ ГРИБОВ
лению продуктов обмена, так как во встряхиваемых культурах растворение и скорость диффузии кислорода выше, чем в стационарных; сокращается срок ферментации и увеличивается количество получаемого продукта за счет увеличения объема жидкости и применения ферментеров различного типа, позволяющих регулировать ферментационный процесс.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
238 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА5.6. ИЗУЧЕНИЕОСОБЕННОСТЕЙРОСТАГРИБАAsprgillus niger ПРИ РАЗЛИЧНЫХМЕТОДАХКУЛЬТИВИРОВАНИЯ
 Цель лабораторной работы
Цель лабораторной работы
•освоение методов ведения грибных культур поверхностным и глубинным способом.
 Задачи лабораторной работы:
Задачи лабораторной работы:
•подготовка субстрата и его инокуляция;
•определения урожая биомассы;
•определение количественных показателей спорообразования.
 Краткие теоретические сведения
Краткие теоретические сведения
Поверхностное и глубинное культивирование мицелиальных грибов проводят в колбах Эрленмейера объемом 500–750 мл в 100 мл питательной среды. Посев изучаемых грибов в колбы со стерильной питательной средой проводят споровой суспензией из расчета 1 × 106 спор на 1 мл питательной среды. В качестве посевного материала используют споровую культуру изучаемого гриба, выращенную на сусло-агаре. Из пробирки с маточной культурой асептически делают смыв в колбу со стерильной водой, встряхивают колбу на качалке в течение 20-30 мин, затем определяют концентрацию конидий в полученной суспензии в камере Горяева или методом Брида и используют необходимое количество суспензии с конидиями для засева.
Поверхностное культивирование гриба A. niger проводят в термостате, в течение 7 суток при температуре 30 °С; глубинное культивирование – в термостатируемой качалке с вращательным движением при 120 об/мин.
Культивируют изучаемые грибы на глюкозо-минеральной среде следующего состава (г/л):
глюкоза |
– 30,0, |
MgSO4 × 7H2O |
– 0,5, |
KH2PO4 |
– 1,0, |
NH4Cl |
– 2,0, |
FeSO4 × 7H2O |
– 0,01, |
KCl |
– 0,5, |
дрожжевой экстракт – 2,0. |
|
|
|
||
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
239 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.6. ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ РОСТА ГРИБАAsprgillus niger ПРИ РАЗЛИЧНЫХ МЕТОДАХ КУЛЬТИВИРОВАНИЯ
Значение рН перед стерилизацией доводят до 6. Для подкисления среды используют соляную, серную, лимонную, молочную, фосфорную кислоты. Посуду для питательной среды и колбы с водой для приготовления споровой суспензии стерилизуют в автоклаве при 121 °С в течение 30 мин. Питательную среду стерилизуют в автоклаве при 115 °С в течение 25–30 мин.
Урожай биомассы мицелиальных грибов является одним из основных показателей роста. Определение биомассы проводят весовым методом. Для этого мицелий гриба отделяют от культуральной жидкости фильтрованием или центрифугированием, затем несколько раз промывают физиологическим раствором и вновь фильтруют или центрифугируют при 2500–3000 об/мин. Мицелий высушивают в сушильном шкафу при температуре 105 °С до постоянного веса (0,001 г).
Для каждой биотехнологической системы рассчитывают средний абсолютный прирост биомассы за единицу времени или валовая скорость по формуле
V = |
m −m |
0 , |
(5.7) |
t −t0 |
где V – валовая скорость, г/л в сут; m – m0 – прирастание биомассы, г; t – t0
– конечный промежуток времени, сут.
Проводят сравнительный анализ наращивания биомассы в различных биотехнологических системах.
Параллельно с учетом урожая биомассы гриба определяют потребление глюкозы. Для этого находят остаточное содержание глюкозы в культуральной жидкости. Определение глюкозы проводят ортотолуидиновым методом. Метод основан на том, что ортотолуидин при нагревании с глюкозой при 100 °С в растворе уксусной кислоты дает зеленое окрашивание, интенсивность которого определяется колориметрически.
В пробирку наливают 0,9 мл 3 % -й трихлоруксусной кислоты и добавляют в нее 0,1 мл культуральной жидкости. К 0,5 мл смеси добавляют 4,5 мл ортотолуидинового реактива. Пробирку помещают в кипящую водяную баню на 8 мин. Вода должна непрерывно кипеть. Следует точно соблюдать время выдерживания пробирки на водяной бане. Пробирку вынимают и сразу охлаждают под водопроводной водой до комнатной температуры. Измеряют
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
240 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.6. ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ РОСТА ГРИБАAsprgillus niger ПРИ РАЗЛИЧНЫХ МЕТОДАХ КУЛЬТИВИРОВАНИЯ
на ФЭКе при длине волны 590-650 нм (оранжевый или красный светофильтр) в кювете с толщиной слоя 1 см, против холостой пробы.
Холостая проба – 0,5 мл трихлоруксусной кислоты и 4,5 мл ортотолуидинового реактива.
Калибровочные пробы ставят как опытные (табл. 5.5)
|
|
|
Таблица 5.5 |
|
Приготовление рабочих калибровочных растворов |
||||
|
|
|
|
|
Рабочий |
Основной калиб- |
|
|
|
ровочный рас- |
Дистиллирован- |
Концентрация |
|
|
калибровочный |
|
|||
твор |
ная вода, мл |
глюкозы, % |
|
|
раствор |
|
|||
(500 мг%) мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
5,0 |
0 |
500 |
|
2 |
3,0 |
2,0 |
300 |
|
3 |
1,0 |
4,0 |
100 |
|
|
|
|
|
|
Рассчитывают по формуле |
|
|
|
Соп = Сст × |
Еоп |
мг % глюкозы, |
(5.8) |
|
|
||
|
Ест |
|
|
где Соп – концентрация глюкозы в пробе, мг %; Сст – концентрация глюкозы в калибровочном растворе, мг %; Еоп – оптическая плотность опытной пробы; Ест – оптическая плотность калибровочной пробы.
Интенсивность образования спор (конидий) определяют при поверхностном культивировании. Измеряют диаметр пленки биомассы в колбе. Шаблоном в 1 см2 вырезают участок в центре пленки и помещают его в колбу с 10 мл стерильной воды, растирают стеклянной палочкой и встряхивают в течение 30 мин, чтобы отмыть конидии от пленки. Для подсчета количества конидий, не смачивающихся водой, рекомендуется подготовиться следующим образом. В пробирку со стерильным смывом конидий добавляют этиловый эфир из расчета 0,03-0,04 мл на 5 мл жидкости. Полученную смесь тщательно взбалтывают и оставляют на 30-40 мин. Пробирки закрывают не очень плотно, чтобы эфир мог испариться. За это время жировой слой оболочки конидий растворяется, конидии оседают, но при взбалтывании равномерно распределяются в толще жидкости.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
241 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.6. ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ РОСТА ГРИБАAsprgillus niger ПРИ РАЗЛИЧНЫХ МЕТОДАХ КУЛЬТИВИРОВАНИЯ
В полученной суспензии подсчитывают количество конидий в 1 мл с помощью камеры Горяева, затем делают пересчет на 1 см2 и на всю площадь пленки по формуле
K = A × S, |
(5.9) |
где K – количество конидий на всей площади пленки; A – среднее количество спор в 1 см2; S – площади пленки в см2.
Зная количество питательной среды и количество спор со всей поверхности пленки, рассчитывают количество конидий (титр спор) на 100 мл питательной среды.
Экономически значимыми являются следующие количественные показатели спорообразования:
–урожай конидий (X);
–репродуктивная способность (Рс);
–экономический коэффициент (Y);
–удельная продуктивность спорообразования (Pу); Урожай конидий определяют по формуле
X = X1 – X0, |
(5.10) |
где Х0 – количество конидий в начале культивирования на 1 мл среды; Х1 – количество конидий в конце культивирования на 1 мл среды.
Репродуктивная способность гриба (R) – количество конидий, образующихся в единице объема среды за единицу времени, – определяется по формуле
Pc = |
X |
, |
(5.11) |
V ×t |
|
где Рс – репродуктивная способность (спор/мл/сут); X – урожай конидий на ферментере; V – полезный объем ферментера (колбы); t – время культивирования.
Полезным объемом ферментера называют тот объем, который занят питательной средой.
Под экономическим коэффициентом понимают отношение количества конидий к массе использованного источника углерода. Для расчета эконо-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
242 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.6. ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ РОСТА ГРИБАAsprgillus niger ПРИ РАЗЛИЧНЫХ МЕТОДАХ КУЛЬТИВИРОВАНИЯ
мического коэффициента (Y) необходимо по окончании культивирования определить остаток глюкозы в питательной среде (ортотолуидиновым методом) и произвести расчет по формуле
Y = |
|
X |
, |
(5.12) |
S0 |
− S1 |
|
где Y – экономический коэффициент, конидий/г глюкозы; S0 – начальное содержание глюкозы в 1 мл питательной среды; S1 – конечное содержание глюкозы в 1 мл питательной среды; X – урожай конидий на 1 мл питательной среды.
Одновременно рассчитывают удельную продуктивность конидиегенеза (Ру) по формуле
Py = |
X |
(5.13) |
|
, |
|||
B |
|||
|
|
где Ру – удельная продуктивность конидиегенеза, спор/мг/мл; Х – урожай конидий с 1 мл питательной среды; B – урожай биомассы (сухой вес грибной пленки с 1 мл питательной среды), мг.
 Материалы и оборудование
Материалы и оборудование
1.Колбы Эрленмейера на 500 и 750 мл.
2.Мерные стаканы, колбы конические на 250 мл, пипетки градуированные, стеклянные пробирки.
3.Камера Горяева.
4.Реактивы для приготовления питательной среды.
5.Реактивы для определения глюкозы.
6.Культура гриба A. niger на скошенном агаре.
7.Микроскоп бинокулярный AxioStar plus.
8.Бокс-ламинар Labconco (США).
9.Стационарный рН-метр Sartorius, Meter, (Германия).
10.Микробиологический термостат Binder (Германия). 11.Микроскоп бинокулярный AxioStar plus (Carl Zeiss, Германия). 12.Сухожарочный шкаф SANYO MOV 112F (Япония). 13.Автоклав Sanyo MLS-3781L (Япония).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
243 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.6. ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ РОСТА ГРИБАAsprgillus niger ПРИ РАЗЛИЧНЫХ МЕТОДАХ КУЛЬТИВИРОВАНИЯ
14.Шейкер инкубатор JEIO TECH SL-600 (Корея). 15.Лабораторные весы «Adventurer»™ OH–AR2140 (США). 16.Центрифуга настольная Eppendorf 5810 R (США). 17.Фотоэлектроколориметр.
 Характеристики оборудования
Характеристики оборудования
 Шейкер-инкубатор
Шейкер-инкубатор
Шейкер-инкубатор JEIO TECH SL-600 состоит из собственно шейкера и проволочной платформы для посуды различного объема (рис. 5.18).
Технические характеристики:
•перемешивание орбитальным движением в диапазоне от 5 до
60 °С;
•равномерность температуры ±1,0 °С при точности ее установки
±0,1 ºС;
•объем 83л;
•микропроцессорный контроль;
Рис. 5.18. Шейкер инкубатор JEIO TECH SL-600 (Корея)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
244 |

РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
РАБОТА 5.6. ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ РОСТА ГРИБАAsprgillus niger ПРИ РАЗЛИЧНЫХ МЕТОДАХ КУЛЬТИВИРОВАНИЯ
•рабочий диапазон от 10 до 300 об/мин, точность ±1 при 150 об/мин;
•таймер на 999 ч имеет функцию отсрочки времени включения/выключения;
•система контроля CLS; система сигнализации;
•возможность программирования режима работы по типу работы по часовой стрелке, против часовой стрелки и паузы;
•размеры платформы, в мм: 410×410.
 Бинокулярныймикроскоп
Бинокулярныймикроскоп
Бинокулярный микроскоп AxioStar предназначен для работы в проходящем свете по методу светлого поля (рис. 5.19).
Технические характеристики:
•оптика, скорректированная на бесконечность, с цветовой коррекцией (ICS-оптика);
•окуляры: 10х/20;
•объективы: 2,5х-100х, A-Plan, Achroplan;
•встроенная система освещения со стабилизированным блоком пита-
ния;
•галогеновая лампа (6 В, 20 Вт), принцип Келера;
Рис. 5.19. Микроскоп AxioStar plus (Carl Zeiss, Германия)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
245 |
