
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.3. АБСОРБЦИОННЫЙ АНАЛИЗ ДНК
4. Составление отчета.
1.Спектры поглощения нативной, денатурированной и ренатурированной ДНК.
2.Результаты расчета гиперхромного эффекта.
3.Анализ спектров в виде табл. 7.4.
Таблица 7.4
№ |
|
Кювета |
Максимум спектра поглощения |
|||
Образец |
|
|
|
|||
эксперимента |
сравнения |
λ, нм |
D |
Коэффициент |
||
|
||||||
|
поглощения |
|||||
|
|
|
|
|
||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
… |
|
|
|
|
|
|
4. При написании выводов следует обратить внимание на следующие вопросы:
•Чем отличаются спектры нативной, денатурированной и ренатурированной ДНК? Чем это объясняется?
•Произошла ли полная ренатурация ДНК в результате медленного охлаждения?
•Чему равен коэффициент поглощения данного вида ДНК?
 Контрольные вопросы
Контрольные вопросы
1.Что такое первичная, вторична, третичная и четвертичная структуры ДНК? Какими связями эти структуры удерживаются?
2.Что такое оптическая плотность, пропускание, спектр поглощения? Как спектрофотометр получает эти характеристики?
3.Какие эффекты влияют на спектры поглощения ДНК?
4.Зависимость между какими характеристиками образца отражена в законе Бугера-Ламберта-Бера? При каких условиях этот закон нарушается?
5.Какие задачи решают с помощью абсорбционной спектроскопии нуклеиновых кислот?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
362 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА7.4. ЛЮМИНЕСЦЕНТНЫЙАНАЛИЗБЕЛКОВ
 Цель лабораторной работы
Цель лабораторной работы
•изучение закономерности формирования спектра люминесценции белка в зависимости от его структуры.
 Краткие теоретические сведения
Краткие теоретические сведения
Основные характеристики флуоресцентной спектроскопии
Принципы флуоресцентной спектроскопии: люминесценция – испускание фотонов из электронно-возбужденных состояний – делится на два типа в зависимости от природы основного и возбужденного состояний. Флуоресценция – это испускание, происходящее при возвращении спаренного электрона на более низкую орбиталь. Такие переходы квантовомеханически «разрешены», а типичные величины скоростей испускания для них ~108 с-1. Высокие значения скоростей испускания приводят к временам затухания флуоресценции ~10-8 с (10 нс). Фосфоресценция – это испускание, происходящее при переходе между состояниями различной мультиплетности, как правило, из возбужденного триплетного состояния в синглетное основное. Такие переходы не разрешены, и константы скорости испускания малы. Типичный диапазон времени затухания фосфоресценции — от миллисекунд до секунд, что главным образом зависит от вклада других процессов дезактивации.
В веществах, проявляющих значительную флуоресценцию (флуорофорах), электроны в основном делокализованы и формально расположены на сопряженных двойных связях.
Флуоресцентные свойства объекта обычно характеризуют спектрами испускания и возбуждения.
Спектр испускания флуоресценции — это зависимость интенсивности флуоресценции от длины волны (в нанометрах) или волнового числа (в см-1). Спектры испускания зависят как от химической структуры флуорофора, так и от растворителя, в котором он растворен.
Спектр возбуждения – это зависимость интенсивности люминесценции при определенной длине волны от длины волны возбуждения.
Для большинства флуорофоров квантовые выходы и спектры испускания не зависят от длины волны возбуждающего света. Следовательно, спектр
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
363 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
возбуждения флуорофора обычно совпадает с его спектром поглощения. Даже при идеальных условиях для такого совпадения необходимо присутствие единственного флуорофора, а также отсутствие осложняющих факторов таких, как нелинейность, связанная с большой оптической плотностью образца.
Диаграмма Яблонского
Поглощение и испускание света хорошо иллюстрирует диаграмма уровней энергии, предложенная Яблонским. Основное, первое и второе электронные состояния обозначают S0, S1, и S2 соответственно. Каждый из этих уровней энергии может состоять из множества колебательных энергетических уровней, обозначаемых 0, 1, 2 и т. д. Переходы между различными электронными уровнями обозначают вертикальными линиями. Такое представление используется, чтобы наглядно показать мгновенную природу поглощения света. Этот процесс происходит примерно за 10-15 с – время, слишком короткое для заметного смещения ядер (принцип Франка – Кондона). Из-за большой разности энергий между уровнями S0 и S1 ни у каких флуорофоров состояние S1 не может быть заселено термическим путем. За поглощением света обычно следует несколько других процессов. Возбуждение флуорофора, как правило, происходит до некоторого высшего колебательного уровня состояний (S1 либо S2). За некоторыми редкими исключениями, для молекул в конденсированной фазе характерна быстрая релаксация на самый нижний колебательный уровень состояния S1. Этот процесс называется внутренней конверсией и происходит большей частью за 10-12 с. Поскольку типичные времена затухания флуоресценции близки к 10-8 с, внутренняя конверсия обычно полностью заканчивается до процесса испускания. Следовательно, испускание флуоресценции чаще всего осуществляется из термически равновесного возбужденного состояния. Термическое равновесие достигается за время 10-12 с.
Молекулы в состоянии S1 могут также подвергаться конверсии в первое триплетное состояние Т1. Испускание из Т1 (фосфоресценция) обычно сдвинуто в сторону больших длин волн по сравнению с флуоресценцией. Переход из S1 в Т1 называется интеркомбинационной конверсией.
Флуоресценция молекул имеет следующие характеристики: 1. Стоксов сдвиг.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
364 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
Как правило, всегда наблюдается сдвиг испускания относительно поглощения в сторону больших длин волн, т. е. потеря энергии (исключение — атомы в газовой фазе). Потери энергии между возбуждением и испусканием неизменно наблюдаются для флуоресцирующих молекул в растворах. Одной из основных причин возникновения стоксова сдвига является быстрая релаксация на нижний колебательный уровень состояния S1. К тому же обычно происходит переход на возбужденные колебательные уровни состояния S0, что приводит к дополнительной потере колебательной энергии. Вдобавок к этому стоксов сдвиг может быть еще более увеличен благодаря влияниям растворителя на флуорофоры и реакциям в возбужденных состояниях.
2. Независимость спектра испускания от длины волны возбуждения.
Спектр испускания флуоресценции обычно не зависит от длины волны возбуждения. При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный уровень состояния S1. Эта релаксации происходит за 10-12 с и является результатом сильного перекрывания множества состояний с примерно равными энергиями. Благодаря такой быстрой релаксации длина волны возбуждения обычно не влияет на спектр испускания.
3. Правило зеркальной симметрии.
Обычно спектр испускания флуоресценции представляет собой зеркальное отражение спектра поглощения, точнее, того поглощения, которое соответствует переходу из S0 в S1. Для многих молекул различное распределение электронов в состояниях S0 и S1 существенно не влияет на эти уровни энергии.
4. Времена затухания и квантовый выход флуоресценции.
Квантовый выход флуоресценции — это отношение числа испущен-
ных фотонов к числу поглощенных. Энергетический выход флуоресценции всегда меньше единицы из-за стоксовых потерь.
Квантовый выход может быть выражен через отношение интенсивности флуоресценции (F) к разности интенсивностей падающего (I0) и выходящего (I) световых потоков:
Q = |
|
F |
. |
(7.4) |
|
I0 |
− I |
||||
|
|
|
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
365 |
РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
Используя эту формулу и закон Бугера-Ламберта-Бера при малых оптических плотностях D, можно получить приближенное (но достаточно точное при D<0,05) выражение:
Q = |
F |
|
2,3 I0 ε c d . |
(7.5) |
Время жизни возбужденного состояния определяется как среднее время, в течение которого молекула находилась в возбужденном состоянии до того, как вернуться в основное состояние. Обычно время затухания флуоресценции –10 нс.
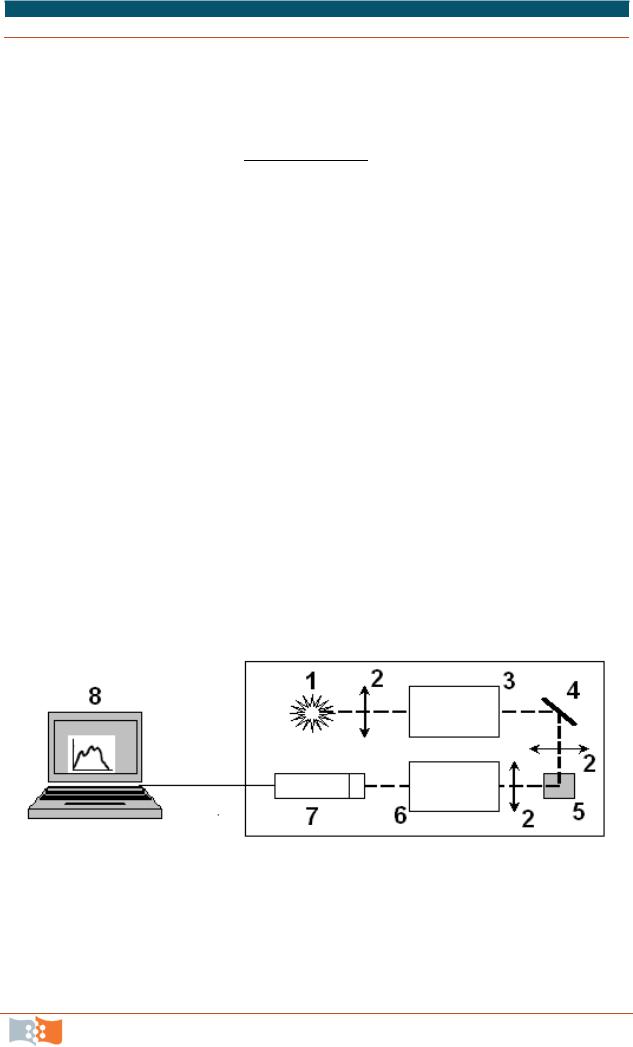
Для регистрации спектрального состава люминесценции используют приборы, называемые спектрофлуориметрами или люминесцентными спектрометрами. На рис. 7.4 приведена принципиальная схема такого прибора. В качестве источника возбуждающего света в приборе чаще всего используется ксеноновая лампа. Прибор снабжен монохроматорами для выделения отдельной длины волны как возбуждающего, так и испускаемого света. Оба монохроматора снабжены моторами, что обеспечивает автоматическое сканирование по длинам волн. Флуоресценция попадает на фотоумножители и затем количественно измеряется с помощью соответствующих электронных устройств. Выходной сигнал обычно представляется графически на мониторе компьютера или встроенном дисплее.
Рис. 7.4. Блок-схема спектрофлуориметра: 1 – источник возбуждения (лампа); 2 – линзы; 3 – монохроматор возбуждения; 4 – поворотное зеркало; 5 – кювета с образцом; 6 – монохроматор испускания; 7 – ФЭУ; 8 – система вывода данных
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
366 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
Флуоресценция белков
Среди биологических макромолекул белки выделяются наличием сильной собственной флуоресценции.
Флуоресценция большинства белков вызывается в первую очередь триптофановыми остатками, индольные кольца которых уникально чувствительные и сложные флуорофоры. Индол, триптофан и их производные очень чувствительны к полярности растворителя и подвержены как общим, так и специфическим взаимодействиям с растворителем. Благодаря такому свойству спектр люминесценции триптофановых остатков может отражать полярность их ближайшего окружения. На спектры испускания белков влияют связывание субстратов, реакции ассоциации и денатурации. Триптофан оказывается уникально чувствительным к тушению различными веществами. В дополнение к тушению кислородом и йодид-ионами триптофан тушится такими веществами, как акриламид, сукцинимид, пероксид водорода, дихлорацетамид, пиридингидрохлорид, цистеин, хлорированные углеводороды, NO3-, IO3- , Cs+, Си2+, Рb2+, Cd2+ и Mn2+. Эта чувствительность к различного рода тушителям обусловлена склонностью возбужденного индольного ядра донировать электроны во время нахождения в возбужденном состоянии. Чувствительность к тушителям позволяет определять доступность триптофановых остатков в белках методом тушения.
Детальный анализ флуоресценции белков затрудняется как обилием факторов, которые влияют на флуоресценцию индольной составляющей, так и наличием в большинстве белков нескольких разных триптофановых остатков. Так как каждый остаток находится в разном окружении, то и спектральные свойства каждого остатка в общем случае различаются. Испускания всех остатков перекрываются в используемом диапазоне длин волн, и довольно сложно разделить спектральные вклады каждого из них в многотриптофановом белке.
Белки содержат три аминокислотных остатка, которые могут давать вклад в ультрафиолетовую флуоресценцию: тирозин (Tyr), триптофан (Trp) и фенилаланин (Phe). Флуоресценцию белков обычно возбуждают в максимуме поглощения – при 280 нм или больших длинах волн. Поэтому фенилаланин не возбуждается в большинстве экспериментальных случаев (таб. 7.1, рис. 7.5). Более того, квантовый выход фенилаланина в белках мал, так что испускание этого остатка наблюдается редко. Испускание тирозина в воде происходит при 303 нм и с равнительно нечувствительно к полярности рас-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
367 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
творителя. Максимум испускания триптофана в воде находится при 348 нм и сильно зависит от полярности. Тирозиновые остатки могут претерпевать в возбужденном состоянии ионизацию, приводящую к потере протона ароматической гидроксильной группой. В основном состоянии для этого гидроксила рК≈10, а в возбужденном состоянии рК уменьшается до ~4. Гидроксильная группа может диссоциировать в течение времени жизни возбужденного состояния, что приводит к тушению флуоресценции тирозина. Ранее полагали, что тирозинат не флуоресцирует, но выяснилось, что он слабо флуоресцирует при 345 нм.
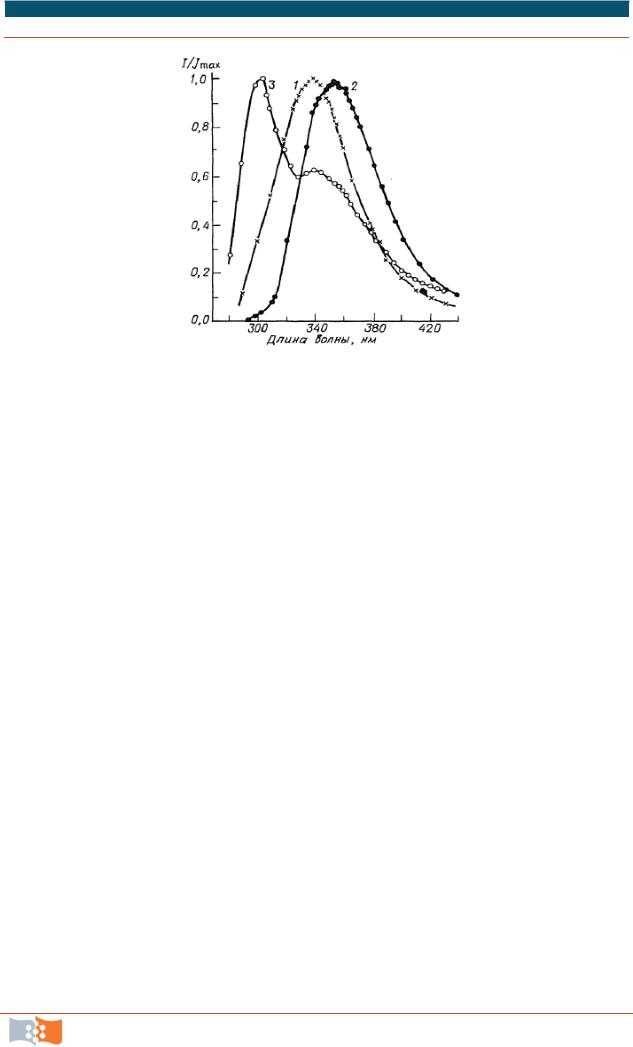
На рис. 7.5 приведен спектр сывороточного альбумина человека (HSA), а также спектр испускания триптофана и смеси тирозина с триптофаном в молярном соотношении 18:1. Испускание белка находится в области более коротких длин волн по сравнению с испусканием триптофана в воде. Коротковолновый сдвиг является результатом экранирования триптофановых остатков от воды белковой матрицей. Несмотря на относительно большое число тирозиновых остатков, спектр испускания HSA — это спектр, главным образом, триптофана. Что кажется неожиданным, поскольку испускание тирозинов преобладает в указанной смеси тирозина с триптофаном в соответствии с пропорцией этих остатков в HSA. В противоположность сильному поглощению при 280 нм и высокому квантовому выходу в водных растворах испускание тирозина в большинстве белков слабое и часто недетектируемое.
Отсутствие тирозинового испускания у большинства белков зависит от трехмерной структуры. Денатурация белков приводит к увеличению испускания тирозинов, но их вклад обычно меньше, чем найденный для эквимолярных смесей. Предположительными причинами отсутствия тирозиновой флуоресценции в белках были названы: а) перенос энергии на триптофановые остатки и б) тушения близлежащими группами полипептидной цепи.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
368 |
РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
Рис. 7.5. Флуоресцентный спектр испускания человеческого сывороточного альбумина и ароматических аминокислот: 1 – HSA; 2 – триптофан; 3 – смесь тирозина и триптофана, эквивалентная той, которая найдена для HSA
Тушение флуоресценции группами полипептидной цепи
Потеря тирозиновой флуоресценции белками определяется рядом факторов. Флуоресценция тирозина может быть потушена близко расположенными карбоксильными группами или незаряженными аминогруппами. Такое тушение связано с переносом протона на эти акцепторы протонов в течение времени жизни возбужденного состояния, что было доказано при изучении флуоресценции сополимеров тирозин-глутамат и тирозин-лизин. Кроме того, флуоресценция тирозина тушится также заряженными аминогруппами и нейтральными карбоксильными группами. Механизм тушения может включать перенос протона от фенола либо в основном, либо в возбужденном состоянии. Образование пептидной связи карбоксильной группой или аминогруппой тирозина еще больше понижает его квантовый выход. В белках гидроксильная группа может образовывать водородную связь с пептидной связью, а связанные водородной связью фенолы не флуоресцируют. Следовательно, флуоресценция тирозина может отсутствовать или быть минимальной в белках по разным причинам.
Хотя флуоресценция тирозина обычно слаба и нечувствительна к растворителям, часто бывает необходимо полностью исключать такой дополнительный источник гетерогенности во флуоресценции белков. Обычно это
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
369 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
достигается путем возбуждения при 295 нм, где поглощение тирозина (но не тирозината) минимально.
Перенос энергии от тирозина к триптофану
Путем сопоставления сравнимых данных для белков можно установить эффективность тирозин-триптофанового переноса энергии. Например, установлено, что для дрожжевой алкогольдегидрогеназы (АДГ) в нативном состоянии относительный квантовый выход хорошо описывается теоретической кривой для эффективности переноса 69 %. АДГ содержит 6 триптофановых и 14 тирозиновых остатков. Для АДГ, денатурированной гуанидингидрохлоридом, эффективность переноса понижается до нуля. Следовательно, на эффективность тирозин-триптофанового переноса энергии влияет трехмерная структура белка. Для ряда из восьми нативных белков было найдено, что эффективность переноса энергии варьирует от 0,17 до 0,69, и все эти значения уменьшаются при денатурации.
Факторы, влияющие на спектры испускания белков А. Трехмерная структура
Максимумы испускания триптофана и его производных очень чувствительны к полярности растворителя и к специфическим взаимодействиям между растворителем и индольным кольцом. Поэтому максимумы испускания белков зависят от тех факторов, которые влияют на экспонирование триптофановых остатков в водную фазу. Например, спектр испускания сывороточного альбумина человека претерпевает коротковолновый сдвиг по сравнению с испусканием триптофана в воде (рис. 7.5). Этот коротковолновый сдвиг интерпретируют как результат экранирования триптофановых остатков от водной фазы белков. Как можно было ожидать, максимумы испускания белков варьируются главным образом из-за различной усредненной локализации этих остатков в нативных белках. Для некоторых белков, таких, как рибонуклеаза, спектры сдвинуты в коротковолновую область, что указывает на экранирование этих остатков от растворителя. В других случаях (как глюкагон и АСТН) наблюдается длинноволновый сдвиг испускания. Это может объясняться значительным контактом триптофанового остатка с водной фазой в этих небольших по размеру белках.
Подобные различия в максимумах испускания получены и для многотриптофановых белков; например, альдолаза имеет максимум испускания
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
370 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
при 328 нм, а сывороточный альбумин быка – при 343 нм. Денатурация белков гуанидингидрохлоридом и мочевиной приводит к длинноволновому сдвигу в спектре испускания и приблизительно одному и тому же максимуму испускания для всех белков. Следовательно, различия максимумов испускания для нативных белков обусловлены их трехмерной структурой.
Б. Связывание белков с субстратами и другими макромолекулами
Во многих случаях связывание белков с субстратами или другими макромолекулами приводит к сдвигу в их спектре испускания. Например, максимум испускания лизоцима сдвигается от 340 до 331 нм при связывании субстрата три-N-ацетил-D- глюкозамина. Этот сдвиг интерпретируют экранированием триптофановых остатков в активном центре от воды. Помимо связывания субстратов к значительным изменениям в спектральных свойствах триптофана могут приводить также другие факторы, в том числе самоассоциация белков и связывание белков с мембранами.
Использование измерений собственной флуоресценции белков
В основе использования собственной флуоресценции белков лежат эмпирические «правила», полученные при изучении модельных соединений с хорошо известной структурой и конформацией. Обычно применяемые правила таковы:
1.Вся флуоресценция белка обусловлена наличием остатков триптофана, тирозина и фенилаланина, если известно, что белок не содержит особых флуоресцирующих компонентов.
2.При уменьшении полярности растворителя λмакс в спектре флуоресценции триптофана смещается в область более коротких длин волн и интен-
сивность при λмакс возрастает.
а) Если λмакс смещена в область более коротких длин волн, когда белок находится в полярном растворителе, триптофан должен
находиться внутри молекулы в неполярном окружении.
б) Если λмакс смещена в область более коротких длин волн, когда белок находится в неполярной среде, то триптофан либо распо-
ложен на поверхности белка, либо он попадает на поверхность в результате конформационного перехода, индуцированного растворителем.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
371 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
3. Если вещество, известное как тушитель (т.е. оно тушит флуоресценцию свободной аминокислоты), например йодид, нитрат или ионы цезия тушат флуоресценцию триптофана или тирозина, то эти аминокислоты должны быть на поверхности белка. Если тушения не происходит, этому имеется несколько причин:
а) Аминокислота находится внутри молекулы.
б) Аминокислота находится в полости, размеры которой слишком малы, чтобы туда вошел тушитель.
в) Аминокислота находится в сильно заряженном участке, и заряд может отталкивать тушитель (йодид или Cs+). Нейтральный акриламид безразличен к наличию заряда.
4.Если вещество, которое не влияет на квантовый выход свободной аминокислоты, действует на флуоресценцию белка, то оно делает это путем конформационной перестройки белка.
5.Если триптофан или тирозин находятся в полярном окружении, характерные для них величины квантового выхода Q понижаются при возрастании температуры Т, тогда как в неполярном окружении изменения величин Q незначительны. Следовательно, отклонения от монотонного уменьшения Q с увеличением Т указывает на то, что нагревание индуцирует конформационную перестройку, потому что полярность областей, где остатки триптофана были доступны, должна измениться. Параллельное возрастание величин Q и Т в условиях, когда белок находится в полярном растворителе таком, как вода, указывает на то, что больше молекул триптофана стало доступно растворителю, и, следовательно, белок разворачивается.
6.Q как триптофана, так и тирозина понижается, если α-карбоксильная группа этих аминокислот протонирована.
7.Флуоресценция триптофана тушится соседними протонодонорными группами. Следовательно, если рК, измеренный путем контроля флуоресценции триптофана, такой же, как рК известной, способной к ионизации группы (например, имидазола гистидина), то эта группа должна находиться очень близко от триптофана. Это правило применяется только в том случае, если можно независимо показать, что изменение рН не вызывает конформационных перестроек.
8.Если при связывании какой-либо молекулы с белком тушится флуоресценция триптофана, то либо в результате связывания имеет место боль-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
372 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
шая конформационная перестройка, либо часть триптофановых остатков находится в месте связывания или очень близко от него. Кроме того, понижение полярности растворителя приводит к смещению λмакс в область более коротких длин волн, и, следовательно, наличие такого смещения при связывании указывает на то, что вода исключается из комплекса.
9. Если спектр поглощения малой молекулы перекрывает спектр испускания триптофана и расстояние между хромофорами невелико, имеет место тушение. Следовательно, если связывание такой молекулы с белком приводит к тушению флуоресценции триптофана, триптофан должен быть в месте связывания или недалеко от него.
 Материалы и оборудование
Материалы и оборудование
1.Буферные растворы и раствор NaOH (0.1 М), белки, триптофан, тирозин, денатурирующие агенты (концентрированные растворы кислот и щелочей или другие).
2.Люминисцентный спектрометр.
3.Лабораторные весы «Adventurer»™ OH–AR2140.
4.Автоматические микропипетки.
 Характеристики оборудования
Характеристики оборудования
 Люминесцентныйспектрометр
Люминесцентныйспектрометр
Технические характеристики люминесцентного спектрометра Aminco Bowman Series 2 (Thermo Spectronic, США) (рис.7.6)
Спектральный диапазон 220–850 нм. Скорость сканирования 3–6000 нм/мин. Источник света: ксеноновая лампа (150 Вт). Шаг перестройки монохроматора от 0,2 нм. Точность установки длины волны: ±0,5 нм
Воспроизводимость установки длины волны ±0,25 нм. Спектральная ширина щелей монохроматоров 0,5–16 нм.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
373 |
