
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.7. ВЫПОЛНЕНИЕ ГЕМАТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ НА АНАЛИЗАТОРЕМЕК-6400J/К
 ГематологическийанализаторМЕК-6400J/К
ГематологическийанализаторМЕК-6400J/К
Применяемые разведения 200:1 для лейкоцитов и 40000:1 для эритроцитов. Имеются встроенные контуры компенсации ошибок при одновременном прохождении клеток и при вариациях температуры растворов. Анализатор имеет цветной тонкопленочный жидкокристаллический дисплей с разрешением 240 х 320 пикселей и с функцией сенсорного экрана. Кроме результатов анализа на дисплей выводятся сообщения о технических проблемах. Необходимый объем образца — не более 30 мкл. Время исследования одной пробы — не более 90 секунд. Объем памяти — 400 образцов или 50 гистограмм. Имеются встроенные программы контроля качества исследований. При включении прибора автоматически начинается прокачка, система проводит самопроверку технического состояния, выдавая сигнал калибровки.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
Исследование клеточного состава и гемоглобина крови назначается при подозрении как на большое число заболеваний органов кроветворения, так и общих патологий организма воспалительного, инфекционного, онкологического характера.
Порядок выполнения работы
1.Надеть одноразовые латексные перчатки. Проверить уровень растворов во всех емкостях. При необходимости долить.
2.Включить прибор.
3.Дождаться окончания цикла самопроверки.
4.При необходимости провести промывку или процедуру чистки анализатора.
5.Не менее восьми раз перевернуть закрытую пробирку с образцом
крови.
6.Открыть крышку и до дна погрузить в пробирку иглу пробозаборника. Нажать клавишу старта.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
490 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.7. ВЫПОЛНЕНИЕ ГЕМАТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ НА АНАЛИЗАТОРЕМЕК-6400J/К
7.После того, как игла поднимется в анализатор закрыть пробирку с остатками пробы.
8.Считать результаты анализа на экране. В случае появления сообщений о нештатном результате повторить исследование
9.Выключить прибор.
10.Опорожнить емкость для отходов.
11.Записать полученные значения клеточного состава исследуемой крови в рабочую тетрадь.
 Контрольные вопросы
Контрольные вопросы
1.Какое диагностическое значение имеет исследование клеточного состава крови человека?
2.Какой метод используется в анализаторе МЕК-6400J/К для определения количества клеток?
3.Какие сообщения (флаги) свидетельствуют о технических неполад-
ках?
4.В каких случаях необходима экстренная остановка анализатора и как это можно сделать?
5.О чем может свидетельствовать увеличение абсолютного содержания лейкоцитов в крови?
6.О чем может свидетельствовать уменьшение абсолютного содержания эритроцитов крови?
7.О чем может свидетельствовать значительное (в несколько раз) увеличение абсолютного содержания лейкоцитов на фоне снижения абсолютного содержания эритроцитов?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
491 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА10.8. ОБУЧЕНИЕРАБОТЕНАКОАГУЛОГИЧЕСКОМАНАЛИЗАТОРЕ SYSMEX CA-560, ПРЕДНАЗНАЧЕННОМДЛЯАНАЛИЗАПОКАЗАТЕЛЕЙ ГЕМОСТАЗА
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с методами определения показателей гемостаза на коагулогическом анализаторе SYSMEX CA-560; получение навыков оператора.
 Задачи лабораторной работы
Задачи лабораторной работы
•знакомство с методом проведения анализов и детекции, управлением, обслуживанием анализатора, выполнение исследований, интерпретация полученных данных.
 Краткие теоретические сведения
Краткие теоретические сведения
Система гемостаза – сложная, многоуровневая система, выполняющая три основных функции – прокоагуляционную, антикоагуляционную и фибринолизирующую. Благодаря слаженной работе всех элементов системы формируется универсальная защитная система, позволяющая, во-первых, быстро остановить любое кровотечение, во-вторых, способствовать устранению повреждения окружающей ткани и наконец предупредить внутрисосудистое свёртывание крови. Коагуляция крови затрагивает механизмы активации как клеточных элементов (тромбоцитов, лейкоцитов), так и компонентов плазмы (белки – факторы плазменного гемостаза, небелковые факторы).
Исследование компонентов системы гемостаза, как правило, может быть представлено прямыми методами (оценка концентрации или активности тех или иных факторов, участвующих в процессе свёртывания крови) и непрямыми (основанными на получении времени свертывания при добавлении тех или иных активаторов либо компонентов системы, запускающих коагуляцию). Оба метода детекции могут быть реализованы с помощью одного из механизмов регистрации результата – механического или оптического. При оптической регистрации образование сгустка фиксируется в ответ на изменение оптических свойств тестируемой смеси. При механическом типе регистрирующее устройство фиксирует изменениевязкостискорости перемешивания тестируемой смеси (вследствие изменения тестируемой смеси) шариком или каким-либо другим устройством для перемешивания. Механи-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
492 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.8. ОБУЧЕНИЕ РАБОТЕ НА КОАГУЛОГИЧЕСКОМ АНАЛИЗАТОРЕ SYSMEX CA-560
ческий тип регистрации чаще всего используется в работе ручных и полуавтоматических коагулометров, а оптический – автоматических приборов.
 Материалы и оборудование
Материалы и оборудование
1.Автоматический анализатор коагуляции крови Sysmex CA-560.
2.Одноразовые пласстмассовые пробирки для образцов производства фирмы Falcon.
3.Дистиллированная вода.
4.Промывающий раствор.
5.Наборы для определения параметров гемостаза.
6.Набор из трех автоматических дозаторов на 2-20 мкл, на 1001000 мкл и на 1000 – 5000 мкл.
7.Мерные стаканы и колбы, одноразовые наконечники для пипеток.
8.Контрольная плазма с нормальными значениями показателей.
9.Контрольная плазма с патологическими значениями показателей.
10.Реакционные микропробирки.
11.Холодильник для хранения образцов и реагентов.
12.Одноразовые латексные перчатки.
 Характеристики оборудования
Характеристики оборудования
 Автоматизированныйкоагулогическийанализатор
Автоматизированныйкоагулогическийанализатор
Автоматизированный коагулогический анализатор Sysmex CA-560 (рис. 10.17) предназначен для одновременного измерения основных параметров гемостаза. Измеряемые параметры: АЧТВ. ПТВ. Протромбин по Квику. МНО. Фибриноген. Тромбиновое время. Протеин с и s. Волчаночный антикоагулянт. Факторы плазменного гемостаза (II, V, VII, VIII, IX, X, XI, XII). Антитромбин 3. Плазминоген. Гепарин. D – димер и др.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
493 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.8. ОБУЧЕНИЕ РАБОТЕ НА КОАГУЛОГИЧЕСКОМ АНАЛИЗАТОРЕ SYSMEX CA-560
Рис. 10.17. Автоматический коагулометр Sysmex CA-560
Прибор способен проводить до 30 методик. Прибор является открытой системой. Получение результатов производится оптическим методом. Возможна оценка результатов как прямым, так и непрямым методом. Результаты выдаются на встроенный цветной жидкокристаллический дисплей или на термопринтер. Есть возможность подключения к PC. Анализатор способен производить автоматическое разведение образца. Возможно проведение автоматической калибровки методов и построение калибровочной кривой. Далее прибор способен проводить автоматически расчёт значений. Встроенная функция контроля качества способна контролировать правильность проводимых измерений.
Технические характеристики
Анализатор имеет тонкопленочный жидкокристаллический дисплей с функцией сенсорного экрана. Кроме результатов анализа на дисплей выводятся сообщения о технических проблемах. Минимальный объем образца – 500 мкл, объем зависит от размера пробирок. Время исследования одной пробы – не более 90 секунд. Объем памяти – 500 образцов. Имеются встроенные программы контроля качества исследований. После каждой манипуляции игла пробозаборника промывается, чтобы избежть контаминации. Проведение реакции осуществляется в одноразовых пластиковых реакционных микрокюветах, что снижает вероятность преждевременной коагуляции пробы. Имеется функция анализа срочного образца.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
494 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.8. ОБУЧЕНИЕ РАБОТЕ НА КОАГУЛОГИЧЕСКОМ АНАЛИЗАТОРЕ SYSMEX CA-560
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 10.8.1.Знакомство с устройством и принципом работы автоматическогокоагулогического анализатора
Задание 10.8.2. Определениеконцентрации фибриногена в плазмепациентанаанализаторе Sysmex СА-560
Количественное определение фибриногена по методу Клаусса является базисным тестом исследования гемостаза. Образование фибрина и его стабилизация представляют собой финальный этап формирования тромба, при котором растворимый фибриноген превращается в нерастворимый фибрин под действием тромбина и фактора XIII. Фибриноген – острофазный белок. Исследование концентрации фибриногена обычно назначают при восполительных процессах различной этиологии, при бактериальных инфекциях, заболеваниях почек, аутоиммунных болезнях, онкологических заболеваниях, тромбозах, для оценки риска при сердечно-сосудистых патологиях и атеросклерозе, при подозрении на ДВС-синдром и кровотечениях различной этиологии. Определение концентрации фибриногена – наиболее чувствительный тест для выявления бессимптомных стадий заболевания переферических артериальных сосудов
Порядок выполнения работы
1.Надеть одноразовые латексные перчатки. Проверить уровень растворов во всех емкостях. При необходимости долить.
2.Включить прибор.
3.Дождаться появления на экране основного меню сообщения Ready
(готов).
4.Цитратную плазму, полученную от пациентов разлить в пластиковые пробирки объемом 5 мл и поместить в штатив прибора.
5.Штатив с реагентами поместить в прибор, промывающий раствор и имидозольный буфер поставить в соответствующие позиции в приборе. Реагенты при необходимости развести, буфер и промывающий раствор пополнить.
6.Установить микропробирки при их отсутствии в штативе сверху вниз справа налево по порядку.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
495 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.8. ОБУЧЕНИЕ РАБОТЕ НА КОАГУЛОГИЧЕСКОМ АНАЛИЗАТОРЕ SYSMEX CA-560
7.На экране основного меню навести на образец, который необходимо проанализировать и нажать на кнопку анализируемого параметра – Fbg (фибриноген). Передвигаясь между образцами с помощью стрелок вверх и вниз осуществить выбор анализируемого аналита для каждого образца.
8.Запустить анализатор – для этого нажмите кнопку Start в правом верхнем углу.
9.Рибор проведёт замену промывающего раствора и буфера в гидравлических линиях системы в течение 3 мин и начнёт анализ.
10.Прибор сигнализирует об окончании анализа двойным сигналом.
11.После проведения анализа промыть пробозаборник. Для этого нажать на кнопку специального меню – rinse probe. После завершения промывки отключить прибор. Убать реактивы в холодильник, пробы утилизировать по правилам.
12.Опорожнить емкость для отходов.
13.Записать полученные результаты в рабочую тетрадь.
 Контрольные вопросы
Контрольные вопросы
1.Какое диагностическое значение имеет определение фибриногена?
2.Как провести анализ STAT образца?
3.Какую ошибку выдаст прибор, если начать анализ сразу же после заполнение контейнера дистилированной водой? Что необходимо при этом предпринять? Как предотвратить повторную ошибку?
4.При анализе концентрации фибриногена прибор выдал сообщение «no coagulation». Почему могут быть получены такие результаты? Как избежать подобного в дальнейшем?
5.Каким методом производится детекция результатов при работе на
Sysmex?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
496 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА10.9. ЗНАКОМСТВОСПРИНЦИПОМРАБОТЫПРОТОЧНОГО ЛАЗЕРНОГОЦИТОМЕТРАFACS Canto II BD
 Цель лабораторной работы
Цель лабораторной работы
•освоить количественное определение субпопуляции лимфоцитов методом проточной цитометрии с использованием реагентов SimulSet (BD) и программного обеспечения проточного цитомет-
ра BD FACS Diva.
 Задачи лабораторной работы
Задачи лабораторной работы
•знакомство с устройством и принципами работы проточного цитометра;
•обучение методам работы и способам оценки основных результатов иммунофенотипирования лимфоцитов.
 Краткие теоретические сведения
Краткие теоретические сведения
Воснове метода проточной цитометрии лежит взаимодействие моноклональных антител, меченных флюоресцентной меткой, с поверхностными антигенами лимфоцитов и последующий анализ образцов на проточном лазерном цитометре. Однако применение одного типа моноклональных антител, меченных флюорохромом (так называемая одинарная метка), не всегда дает объективную информацию о той или иной популяции лимфоцитов, поскольку каждая клетка несет на своей поверхности одновременно несколько типов антигенов. Более точное и информативное исследование субпопуляций достигается при использовании антител с двойной меткой, т.е. к образцу крови добавляют одновременно два типа моноклональных антител, несущих на себе различные флуоресцентные красители. Таким образом, можно дифференцировать лимфоциты, связавшие на своей поверхности только первый тип антител, только второй и оба типа.
Внастоящее время проточная цитометрия широко применяется в медицинских и биологических исследованиях. Проточные системы используются для оценки содержания основных популяций лимфоцитов с применением моноклональных антител (с помощью «двойной метки»), оценки содержания внутриклеточных и внеклеточных цитокинов, определения функциональной активности различных популяций ИКК и других процессов.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
497 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
Принцип проточной цитометрии заключается в быстром пропускании суспензии клеток через зону чувствительности прибора. Концентрацию клеток подбирают с таким расчетом, чтобы скорость регистрации была достаточной (обычно 1000 клеток в минуту), но при этом не происходило бы одновременного нахождения двух или более объектов в зоне чувствительности. Сигналы от детекторов регистрируют в импульсной форме при помощи счетчиков, анализаторов импульсов или компьютеров.
При анализе соответствующего числа объектов информацию накапливают и представляют в виде частотной гистограммы распределения или точечных графиков. Гистограммы составляют путем установления шкалы интенсивности по оси абсцисс, а по оси ординат обозначают число клеток с данным значением измеряемого параметра.
Принцип регистрации оптических сигналов в цитометрическом анализе заключается в пропускании объектов через специальную проточную камеру, в которой клетки поочередно пересекают сфокусированный луч света. Поглощение и рассеивание света клеткой, а также флюоресценция связанных с ней красителей регистрируют при помощи светочувствительных датчиков – фотодиодов и фотоэлектронных умножителей.
Методы измерения клеток
Регистрация светорассеяния и поглощения. Светорассеяние обуслов-
лено клеточным размером, формой, плотностью, окрашиванием и гранулярностью внутриклеточных структур. Рассеянный свет от клеток и частиц состоит из дифракционных, рефракционных и отражающих компонентов.
При малых углах относительно оси падающего света преобладает дифракция. Рассеяние вблизи первого минимума переднего светового дифракционного изображения используют для измерения размеров объектов. С возрастанием угла рассеивания увеличивается значение рефракционных эффектов. Поскольку рефракционные лучи пересекают внутренность клетки, регистрируемые при этом сигналы в большей степени отражают внутриклеточную микроструктуру.
Флуориметрия – измерение флюоресценции красителей. Флюоресценция имеет три основных преимущества в проточных исследованиях: 1) флуоресцентное излучение прямо пропорционально специфическим клеточным компонентам; 2) концентрация красителей для исследования клетки очень низкая; 3) нефлуоресцирующие соединения могут становиться флюо-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
498 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
ресцирующими при взаимодействии с внутриклеточными структурами или ферментами.
В отличии от большинства способов, связанных с изучением клетки, проточная цитофлуориметрия позволяет делать это с минимальным влиян и- ем на жизнеспособность и жизнедеятельность объекта, сохраняя стерильность и специальные требования к среде, а также проводить анализ динамики клеточных процессов, обеспечивающих высокое временное разрешение.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 10.9.1.Знакомство с принципом работы проточного лазерного цитометра FACS Canto II, BD (рис. 10.18)
 Характеристики оборудования
Характеристики оборудования
 ПроточныйцитометрFACS Canto II
ПроточныйцитометрFACS Canto II
Рис. 10.18. Проточный цитометр FACS Canto II
Регистрация до шести параметров флуоресценции и двух параметров светорассеяния, регистрация и обработка производных параметров (ширина, площадь и величина импульсов, соотношения сигналов на разных каналах регистрации, параметр времени).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
499 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
Двухлазерная оптическая система (488 и 633 нм), поддерживающая различные комбинации флуорохромов при работе с длинами волн. Возможность комплектации дополнительным лазером на 405 нм.
Возможность одновременного использования флуоресцентных меток с близкими спектрами эмиссии.
Автоматическая проверка прибора и настройка параметров измерений с использованием различных контрольных и калибровочных реагентов по выбору пользователя.
Цифровая система сбора и анализа данных, запись цитометрических данных в формате FCS3.0.
Специализированное клиническое программное обеспечение для иммунологических исследований.
Автоматические протоколы подготовки, обслуживания и выключения прибора.
Управляющая рабочая станция на базе компьютера PC с монитором и принтером.
Возможность подключения модуля для автоматической подачи образцов и модулей для автоматизированной подготовки проб.
Дизайн оптической системы обеспечивает полноценный многопараметровый анализ, позволяющий свободно комбинировать до 6 флуоресцентных меток с минимальными ограничениями в выборе сочетаний флуорохромов. Разделение сигнала от флуорохромов выполняется уникальными детекторными матрицами BD Octagon и BD Trigon с круговым расположением детекторов. Для каждой длины волны используется отдельная детекторная система, что позволяет с минимальными искажениями регистрировать флуоресцентный сигнал в многопараметровых исследованиях.
Лазерыисистемыдетекторов.
Твердотельный лазер Coherent Sapphire 488 нм, 20 мВт, система детекторов Octagon с 5 ФЭУ.
Гелий-неоновый лазер JDS Uniphase, 633 нм, 17 мВт, система детекто-
ров Trigon с 2 ФЭУ.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
500 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
Параметры светорассеяния: Фотодиод для регистрации прямого светорассеяния FSC, разрешение 1 мкм. Фотоумножитель в системе детекторов Octagon для регистрации бокового светорассеяния SSC, разрешение 0,5 мкм.
Параметры флуоресценции: 2 лазера (488 нм и 633 нм) 6 детекторов флуоресценции (4+2). Стандартная конфигурация поддерживает регистрацию 6-цветной комбинации флуорохромов: FITC, PE, PerCP или PerCP- Cy5.5,PE-Cy7, APC, APC-Cy7.
Чувствительность менее 100 эквивалентов FITC, менее 50 эквивалентов PE. Кварцевая проточная кювета 180х430 мкм; оптический гель между проточной кюветой и оптикой сбора сигнала, исключающий потери сигнала.
Базовое программное обеспечение BD FACSDiva™ для различных цитометрических исследований и специализированное клиническое программное обеспечение для иммунофенотипирования BD FACSCanto. Цифровая регистрация и обработка сигнала.
Автоматизация исследований: благодаря развитым функциям программного обеспечения, конструкции проточной системы, наличию специализированных программ и модулей, мощные технические возможности прибора сочетаются с удобством и простотой в эксплуатации и обслуживании. Это особенно важно в современных многопараметровых цитометрических исследованиях, предъявляющих особые требования к качеству настроек и к состоянию прибора, напрямую влияющих на надежность результатов.
Автоматическая калибровка прибора и настройка компенсации с использованием удобных калибровочных материалов по выбору пользователя
(частицы BD FACS 7-color setup beads, BD™CompBeads или окрашенные одно-
цветными реагентами контрольные образцы клеток).
Автоматические протоколы подготовки прибора и завершения работы
Задание 10.9.2. Иммунофенотипирование образцовкрови методом проточной цитометрии с использованием набора двухцветных реагентовSimulTEST методом проточной цитометрии
Цель – освоение процедуры подсчета процентного и количественного содержания следующих зрелых субпопуляций лейкоцитов человека в лизированной цельной крови (LWB): Т-лимфоциты(СDЗ+), В-лимфоциты (CD19+), Т-хелперы (CD3+CD4+), цитотоксические Т-лимфоциты (CD3+CD8+), естест-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
501 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
венные киллеры – NK лимфоциты (CD3-CD16+ и/или CD56+). Определение соотношения Т-хелперов/цитотоксических Т-лимфоцитов –
CD3+CD4+/CD3+CD8+.
Определение содержания Т- и В-лимфоцитов может служить для характеристики некоторых форм иммунодефицита и аутоиммунных заболеваний.
Определение процентного содержания CD4+ и CD8+ лимфоцитов может быть полезно при мониторинге иммунного статуса пациентов с иммуннодефицитными и аутоиммунными заболеваниями, или иммунными реакциями. Показано, что относительный процент CD4+ субпопуляции снижен, а относительный процент CD8+ субпопуляции повышен у многих пациентов с врожденными или приобретенными иммунодефицитными состояниями, такими как тяжелый комбинированный иммунодефицит и синдром приобретенного иммунодефицита (СПИД).
Процент цитотоксических лимфоцитов может превышать нормальные значения при некоторых аутоиммунных заболеваниях и при некоторых иммунных реакциях, таких как острая реакция «трансплантант против хозяина (РТПХ) и отторжение трансплантанта. Относительный процент CD8популяции часто может быть снижен при активной форме системной красной волчанки (СКВ), но может также быть повышен у пациентов, получающих стероидную терапию.
Т-хелперы – субпопуляция Т-лимфоцитов(СDЗ+), которые также экспрессируют CD4 антиген. Цитотоксические Т-лимфоциты экспрессируют CD8 антиген и преимущественно являются субпопуляцией Т-лимфоцитов(СDЗ+), хотя субпопуляция NK-лимфоцитов также СD8-позитивна.
Соотношение СD4+/СD8+-лимфоцитов может быть определено количественно как отношение CD4 (Leu™-За) FITC-позитивных лимфоцитов к CD8 (Leu-2a) РЕ-позитивным лимфоцитам. Для определения соотношения CD4/CD8 принято использовать один двухцветный реагент, содержащий CD4 и CD8 антитела. Соотношение CD4+/CD8+ используется для оценки иммунного статуса пациентов с аутоиммунными нарушениями или с иммунодефицитом. Кроме того, эта характеристика важна при наблюдении паци ентов после трансплантантации костного мозга, чтобы отследить начало острой РТПХ.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
502 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
Условное отношение хелперов/цитотоксических лимфоцитов (CD4/CD8) не позволяет отличить экспрессию CD8-антигена на Т- и NKлимфоцитах или между Т-хелперами и моноцитами, которые экспрессируют CD4 антиген в небольших количествах. Состав реагентов, входящих в набор, позволяет количественно определять CD3+CD4+ Т-хелперы и CD3+CD8+ цитотоксические Т-лимфоциты отдельно от контаминации CD3-CD4+ моноцитов и CD3-CD8+ NK-лимфоцитов. Вместо одного реагента, содержащего CD4 и CD8, набор Simultest IMKLymphocyte использует два реагента моноклональных антител (CD3/CD4 и CD3/CD8), чтобы определить истинное отношение Т- хелперов/ цитотоксических Т-лимфоцитов (CD3+CD4+/CD3+CD8+). Истинное соотношение хелперы/ цитотоксические Т-лимфоциты не включает СD4позитивные моноциты и CD8-позитивные NK-лимфоциты.
Естественые киллеры (NK-лимфоциты), идентифицированные как CD3-CD16+ и/или CD56+, являются цитотоксичными по отношению к некоторым опухолям и инфицированным вирусом клеткам-мишеням.
Принцип метода
Simultest TM IMK – Lymphocyte – набор двухцветных реагентов для прямой иммунофлуоресценции. Моноклональные антитела, меченные флюорохромом, входящие в набор, добавляются к цельной крови человека и специфично связываются с поверхностными антигенами лейкоцитов. Окрашенные образцы обрабатываются лизирующим раствором для того, что бы разрушить эритроциты. После отмывки клеток фосфатно-буферным раствором образцы анализируют методом проточной цитометрии.
Метод состоит из пяти этапов:
•окрашивание образцов цельной крови с ЭДТА моноклональными антителами,
•лизирование эритроцитов,
•отмывка лейкоцитов от эритроцитарной массы
•измерение количества клеток на проточном цитометре – сбор данных,
•обработка полученных данных и выдача окончательного результата – анализ данных.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
503 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
Окрашивание образцов
На первом этапе цельная кровь с ЭДТА инкубируется с моноклональными антителами с флуоресцентными метками в шести пробирках.
Лизис эритроцитов
После инкубации цельной крови с моноклонами добавляется предварительно приготовленный раствор лизирующего раствора FACS Lysing Solution.
Отмывка образцов
Образцы подвергают процедуре отмывки для удаления разрушенных клеток и лизированной эритроцитарной массы.
Сбор данных
Образцы регистрируют в программном приложении FACS Diva.
Анализ данных
Данные анализируют пользователем в программе FACS Diva. Для получения абсолютных значений исследуемых популяций вносят данные о содержании лейкоцитов и относительном количестве лимфоцитов в исследуемом образце крови, полученные при помощи гематологического анализатора (двухплатформенный метод); при необходимости пользователь проводит корректировку гейта лимфоцитов и регионов, выставленных прибором вокруг исследуемых популяций клеток. Проводится контроль качества проведенных исследований.
 Материалы и оборудование
Материалы и оборудование
1.Ламинарный шкаф, соответствующий III-IV классу биологической. безопасности (класс I-II по международной классификации).
2.Темное место для инкубации образцов.
3.Лабораторная одежда: латексные перчатки, халат, защитный экран.
4.Контейнер с 6 %-м р-ром перекиси водорода для отработанного материала.
5.Набор реагентов Simultest TM IMK – Lymphocyte.
6.Дистиллированная вода.
7.Образец крови в вакутейнере с К3 ЭДТА.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
504 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
8.Полистириновые пробирки 12×75-мм Falcon, штатив к ним.
9.Вортекс.
10.Автоматическая микропипетка 5–40 мкл и разовые наконечники
кней.
11.Автоматическая пипетка постоянного объема на 50 мкл и разовые наконечники к ней.
12.Автоматическая пипетка 100 – 1000 мкл и разовые наконечники
кней.
13.Раствор CellWash для отмывки клеточной суспензии.
Порядок выполнения работы
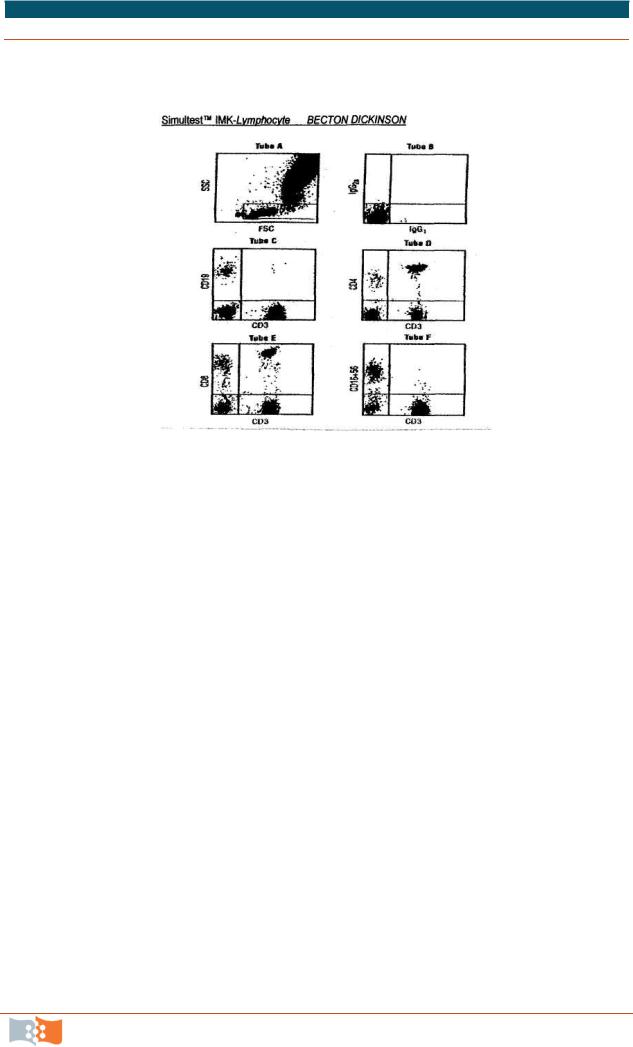
1.Для каждого образца пациента промаркировать шесть пробирок: A, B, C, D, E, F.
2.В промаркированные пробирки (A – F) внести по 20 мкл антител:
3.A – CD45/CD14. B – негативный контроль. C – CD3/CD19. D – CD3/CD4. E – CD3/CD8. F – CD3/CD16+CD56.
4.На дно каждой пробирки аккуратно добавить 50 мкл крови и пере-
мешать.
5.Пробирки инкубировать 20 мин при комнатной температуре в тем-
ноте.
6.Развезти лизирующий раствор 1:10 дистиллированной водой при комнатной температуре и перемешать.
7.Добавить 2 мл готового лизирующего раствора в исследуемые пробирки и тщательно перемешать!
8.Инкубировать 10 мин при комнатной температуре в темноте.
9.Центрифугировать исследуемые образцы 5 мин при 1000 об/мин.
10.Слить супернатант, добавить 2 мл CellWash и тщательно переме-
шать.
11.Центрифугировать исследуемые образцы 5 мин при 1000 об/мин.
12.Слить супернатант, добавить 0,5 мл CellWash и тщательно переме-
шать.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
505 |
РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.9. ЗНАКОМСТВО С ПРИНЦИПОМ РАБОТЫ ПРОТОЧНОГО ЛАЗЕРНОГО ЦИТОМЕТРА FACS Canto II BD
13. Анализировать приготовленные пробы на проточном цитометре FACS Canto II с помощью программы FACS Diva (рис. 10.19 – пример)
Рис. 10.19. Проба гематологически здорового пациента, окрашенная реагентами Simultest IMK- Lymphocyte. Для отделения дебриса, моноцитов и гранулоцитов был использован LeucoGATE (А). Дот плот выставляется по осям
FL1(oсь X) и FL2( ось Y) для проб B-F.
 Контрольные вопросы
Контрольные вопросы
1.В чем заключается принцип проточной лазерной цитомерии ?
2.Что такое двухплатформенный метод ?
3.Почему используют именно моноклональные антитела ?
4.Что такое гейтинг и как он формируется?
5.Какова диагностическая значимость параметров фенотипирования лимфоцитов, получаемых при использовании набора SimulTEST?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
506 |
