
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
 Цель работ раздела
Цель работ раздела
• ознакомление с основными биофизическими методами анализа метаболитов и клеточных макромолекул.
 Задачи раздела
Задачи раздела
•методы определения состава микробных биомасс;
•общая характеристика выделения и очистки целевых продуктов из клеточных биомасс и освоение методов экстракции клеточных метаболитов;
•освоение методов газовой хроматографии в сочетании с массспектрометрией;
•освоение методов высокоэффективной хроматографии на примере гель-проникающей и обращено-фазовой жидкостной хроматографии;
•освоение современных спектроскопических и термических методов исследования биологических макромолекул.
 Краткие теоретические сведения
Краткие теоретические сведения
Большое разнообразие биологических агентов и синтезируемых ими продуктов обмена, нашедших промышленное применение, приводит к необходимости рассмотреть общие, наиболее важные приемы идентификации их структуры и свойств.
Стадия выделения конечного продукта биосинтеза существенно различается в зависимости от природы продукта и его локализации. Если продукт находится в культуральной жидкости, то он, как правило, образует очень разбавленные растворы и суспензии, содержащие, помимо целевого, большое количество других веществ. При этом приходится разделять смеси веществ очень близкой природы, поэтому необходимо использовать методы, позволяющие провести разделение, например, установить тот или иной вид хроматографии. Если целевой продукт локализуется в клетке, то необходимо использовать более сложный подход к его извлечению из клетки.
Общим свойством большинства продуктов микробиологического синтеза является их недостаточная стойкость к хранению, поскольку они склон-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
262 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
ны к разложению и в таком виде представляют прекрасную среду для развития посторонней микрофлоры. Это делает необходимым принимать специальные меры для повышения сохранности биологических препаратов.
Независимо от локализации целевого продукта на первом этапе его очистки проводят отделение массы продуцента от жидкой фазы – сепарацию. Иногда сепарации предшествует специальная обработка – изменение рН, нагревание, добавление коагулянтов белков или флокуллянтов для более эффективного отделения биомассы и стабилизации продукта. Существует несколько способов сепарации.
Для выделения и очистки метаболитов, находящихся внутри клеток (например, интерферонов, гормонов), вводится стадия разрушения клеточных оболочек (дезинтеграция биомассы); обычно для этого применяют механические, химические или комбинированные методы.
К физическим методам дезинтеграции относятся обработка ультразвуком, вращение лопасти или вибратора, встряхивание со стеклянными бусами, продавливание через узкое отверстие под давлением, раздавливание замороженной клеточной массы, растирание в ступке, осмотический шок, замораживание-оттаивание, декомпрессия (сжатие с последующим резким снижением давления). Физические способы разрушения клеток более экономичные, чем химические и химико-ферментативные. В то же время этим способам дезинтеграции клеток присуща неизбирательность: обработка может влиять на качество получаемого продукта.
Химические и химико-ферментативные методы более избирательны. Клетки могут быть разрушены толуолом или бутанолом, антибиотиками, ферментами. Клетки грам-отрицательных бактерий обрабатывают лизоцимом в присутствии этилендиаминтетрауксусной кислоты или других детергентов, клетки дрожжей – зимолиазой улитки или ферментами грибов, актиномицетов. Можно использовать автолиз клеток при лимитировании по определенному субстрату роста или их лизис при заражении бактериофагом.
За дезинтеграцией клеток следует этап отделения клеточных стенок. Для этого используют те же методы фильтрации и центрифугирования. Однако применяют более высокоскоростное центрифугировании или фильтры с меньшим диаметром, чем при сепарации клеток. В большинстве биотехнологических процессов клеточные стенки отбрасывают, как балласт, но возможно и промышленное получение компонентов клеточных стенок как целевого продукта.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
263 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.1. ОПРЕДЕЛЕНИЕОБЩЕГОУЛЕРОДАИАЗОТАВОБРАЗЦАХ МИКРОБНОЙБИОМАССЫНАЭЛЕМЕНТНОМАНАЛИЗАТОРЕFlash EA 1112 CN
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с методами определения элементного состава биологического материала.
 Краткие теоретические сведения
Краткие теоретические сведения
Анализатор элементного состава модели Flash EA 1112 CN, фирмапроизводитель NEOLAB Ltd., Италия (рис. 6.1), обеспечивает определение углерода и азота в различных объектах окружающей среды и продуктах биотехнологии и полностью соответствует требованиям современной лаборатории к точности, воспроизводимости и низкой стоимости анализа. Прибор необходим для изучения круговорота углерода и азота в природных и искусственных экосистемах, а также для определения элементного состава индивидуальных органических соединений для их идентификации.
Рис. 6.1. CN-анализатор Flash EA 1112
 Материалы и оборудование
Материалы и оборудование
1.CN-анализатор Flash EA 1112.
2.Микроэлектронные весы.
3.Баллон с гелием.
4.Баллон с кислородом.
5.Сушильный шкаф с нагревом до температуры 105 0С.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
264 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.1. ОПРЕДЕЛЕНИЕ ОБЩЕГО УЛЕРОДА И АЗОТА В ОБРАЗЦАХ МИКРОБНОЙ БИОМАССЫ
6.Шпатель, пинцет, протирочные материалы.
7.Стандартные образцы для построения калибровочных кривых.
 Характеристики оборудования
Характеристики оборудования
Flash EA 1112 CN работает по принципу «динамической вспышки». Навеска пробы помещается в оловянный контейнер, который сбрасывается в реактор при помощи автоматической системы подачи образца MAS 200. Одновременно в камеру подается определенное количество кислорода. Продукты сгорания (CO2, NO2, H2O) увлекаются потоком газа-носителя гелия через систему ловушек в хроматографическую колонку, далее состав газа анализируется на детекторе по теплопроводности. Полный аналитический цикл длится менее 5 мин.
Программное обеспечение Eager 300 позволяет делать автоматический обсчет результатов анализа и их представление на экране компьютера. Однородные и неоднородные образцы анализируют в широком диапазоне концентраций с высокой точностью и воспроизводимостью. Система электронного контроля в канале газа-носителя и уникальная система дозирования кислорода OxyTune обеспечивают высочайшую стабильность аналитических условий и устраняют потребность в частых повторных калибровках.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.1.1. Ознакомиться сметодами определения элементногосостава биологическогоматериала
Порядок выполнения работы
1.На первом этапе занятия необходимо ознакомиться с основными принципами работы анализатора.
Прибор подразделяется на два блока: аналитический блок (рис. 6.2) и блок управления.
Аналитический блок состоит из печи, детектора по теплопроводности, хроматографической колонки, адсорбционного фильтра, реакторов и автосамплера.
Печь необходима для создания нужной температуры для работы реакторов. Печь состоит из кварцевой трубки, окруженной резистивным нагрева-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
265 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.1. ОПРЕДЕЛЕНИЕ ОБЩЕГО УЛЕРОДА И АЗОТА В ОБРАЗЦАХ МИКРОБНОЙ БИОМАССЫ
тельным элементом. Трубка помещена в огнеупорный теплоизоляционный материал, заключенный в металлический кожух. Температура в печи отслеживается с помощью термопары, соответствующим образом установленной в печи. В печь помещают два реактора, предварительно заполненных катализаторами для минерализации анализируемых проб. Реактор R1 заполняют со дна (конический конец) послойно кварцевым волокном в количестве, необходимом для образования слоя в 2 см, затем оксидом меди (4 см), слоем кварцевого волокна (2 см), посеребренной закисью/окисью кобальта (10 см) и опять слоем кварцевого волокна (2 см). Реактор R2 заполняют кварцевым волокном (5 см), восстановленной медью (35 см) и опять кварцевым волокном (5 см).
Рис. 6.2. Блок-схема Flash EA 1112 для определения CN: AS – автосамплер, R1
–окислительный реактор, установленный в печи, находящейся при температуре 900 0С; R2 – восстановительный реактор, установленный в печи при 680 0С; F – адсорбционный фильтр; СС – аналитическая колонка; TCD – детектор
Адсорбционный фильтр устанавливается сразу после реакторов и служит для улавливания воды из реакционной смеси. Фильтр заполнен кварцевым волокном и перхлоратом магния.
После фильтра сожженная проба в токе газа-носителя поступает на хроматографическую колонку, на которой осуществляется разделение продуктов реакции, полученных после процессов сжигания. Колонка работает при комнатной температуре. Она изготовлена из стали, длина 200 см, диаметр 5 мм, поставляется готовой к использованию.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
266 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.1. ОПРЕДЕЛЕНИЕ ОБЩЕГО УЛЕРОДА И АЗОТА В ОБРАЗЦАХ МИКРОБНОЙ БИОМАССЫ
После разделения пробы на колонке отдельные компоненты газовой смеси поступают в детектор. Детектор по теплопроводности чувствительный к любым веществам с теплопроводностью, отличной от теплопроводности газа-носителя. Детектор состоит из двух пар филамент, имеющих одинаковое электрическое сопротивление. Он помещен в термоизолированный металлический блок (термостат детектора), что способствует поддержанию постоянной температуры. Одна пара филамент омывается чистым газомносителем (канал сравнения), а вторая – потоком газа, выходящего из реактора (аналитический канал). Так как две пары филамент электрически соединены в соответствии со схемой моста Уитстона, то при прохождении через них чистого газа между элементами и стенками детектора устанавливается постоянный градиент температуры, мост Уитстона сбалансирован и выходной сигнал отсутствует. Если компонент из реактора будет элюирован, в аналитическом канале изменится температура филаменты и детектор будет выдавать сигнал, пропорциональный разности теплопроводности между элюируемый газом и газом-носителем. Выходной сигнал детектора подается на плату полученных данных.
Автосамплер производит инжекцию образцов в реактор в автоматическом режиме. Блок управления состоит из двух основных компонентов: отделения пневматики и отделения электроники.
2. Подготовка образцов к анализу.
Перед анализом образцы должны быть высушены в сушильном шкафу при 105 0С и гомогенизированы или на специальных мельницах, или в ступке. Обычно для размола образцов используют кофемолки. Гомогенизированные образцы снова подсушивают в сушильном шкафу при 105 0С и переносят в эксикатор для охлаждения и хранения.
3. Взвешивание образцов.
Для взвешивания образцов необходимо иметь весы, оловянные диски, пинцет, устройство для уплотнения и цилиндрический инструмент, шпатель, кисточку. Используя пинцет, нужно взять оловянный диск и поместить его на устройство для уплотнения. Цилиндрическим инструментом поджать оловянный диск так, чтобы он вошел в полость устройства для уплотнения. З а- тем изготовленный контейнер необходимо вынуть пинцетом из устройства и поместить его на чистую поверхность. Два пустых контейнера взвесить на электронных микровесах, один из них снять и поместить на чистую поверх-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
267 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.1. ОПРЕДЕЛЕНИЕ ОБЩЕГО УЛЕРОДА И АЗОТА В ОБРАЗЦАХ МИКРОБНОЙ БИОМАССЫ
ность. Затем с помощью шпателя внести в контейнер необходимое количество анализируемой пробы (для почв, грунтов – 20–25 мг, для биологических проб – 4–5 мг) и взвесить контейнер с пробой. Если пробы достаточно, то контейнер необходимо закрыть. Для этого используют рычаг, расположенный на верхней поверхности устройства для уплотнения. Образец не должен высыпаться из контейнера. Упакованный контейнер с пробой поместить во второй контейнер и закрыть его так же, как первый. Поместить полученный контейнер на чашку весов и взвесить. Результат необходимо занести в таблицу, структура которой будет представлена ниже.
4. Ознакомившись с основными принципами работы прибора, заполнив и установив все реакторы и фильтры, подготовив образцы для анализа,
переходим непосредственно к включению и запуску прибора.
5. К прибору необходимо присоединить баллоны с кислородом и гелием.
6. Для получения количественных результатов необходима калибровка. Все испытания проводятся с использованием K-Factor. Этот метод состоит в получении расчетной константы =с помощью% ( −следующего)/p соотношения:
где % – теоретическое процентное содержание, элемента в стандарте; р – вес образца в миллиграммах; I – площадь интегрированного пика; b – площадь интегрированного пика холостого образца.
Для расчета содержания элемента в образце в программном обеспечении используется обратное%соотношениеХ = /( − ).
7. Полученные результаты занести в таблицу, которая формируется в
Excel.
 Контрольные вопросы
Контрольные вопросы
1.В чем состоят основные принципы работы CN-анализатора?
2.Какие функции выполняют реакторы?
3.Для чего необходима хроматографическая колонка?
4.Основные принципы работы детектора по теплопроводности.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
268 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.1. ОПРЕДЕЛЕНИЕ ОБЩЕГО УЛЕРОДА И АЗОТА В ОБРАЗЦАХ МИКРОБНОЙ БИОМАССЫ
5.Подготовка образца к анализу.
6.Метод калибровки и калибровочные кривые.
7.Порядок заполнения Таблицы образцов и запуск анализа.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
269 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.2. ИССЛЕДОВАНИЕАМИНОКИСЛОТНОГОСОСТАВАБЕЛКОВ МИКРООРГАНИЗМОВ
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с биофизичеcким методом определения аминокислотного состава белков микробной биомассы.
 Краткие теоретические сведения
Краткие теоретические сведения
Нетрадиционным способом получения белка является микробиологический синтез, который по сравнению с традиционными сельскохозяйственными технологиями с большей эффективностью использует материальные и энергетические ресурсы, не требует больших земельных площадей и не зависит от климатических и погодных условий. Микробиологические технологии не загрязняют окружающую среду ядохимикатами, так как не используют пестициды. По скорости роста микроорганизмы превосходят сельскохозяйственные культуры в сотни, а сельскохозяйственных животных – в тысячи раз. Качество микробных биомасс близко к белкам животного происхождения.
Белок одноклеточных в качестве кормового продукта должен удовлетворять ряду специальных требований. При этом главными являются питательность, перевариваемость, экономическая эффективность. Питательность микробного белка, определяемая по химическому составу, близка традиционным белковым продуктам. Микробная биомасса питательна, если ее компоненты перевариваются ферментами пищеварительного тракта высших животных или человека. Препятствием этому могут быть клеточные стенки отдельных микроорганизмов.
Представления о питательной ценности исследуемого продукта формируются на базе определения общего содержания белков и их аминокислотном составе. Все аминокислоты, из которых состоят белки, являются L- формами. Из 20 аминокислот восемь (изолейцин, лейцин, лизин, метионин, треонин, триптофан, валин, фенилаланин) незаменимы для человека. Для сельскохозяйственных животных этот список дополняют гистидин и аргинин, а для молодняка птицы – еще и пролин. Анализы аминокислотного состава дают ценные сведения о потенциальной пищевой пригодности белка.
Анализ аминокислотного состава белков выполняется на анализаторе аминокислот A0326V2 (Knauer, Германия) (рис. 6.3).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
270 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.2. ИССЛЕДОВАНИЕ АМИНОКИСЛОТНОГО СОСТАВА БЕЛКОВ МИКРООРГАНИЗМОВ
Рис. 6.3. Внешний вид анализатора аминокислот A0326V2 (Knauer, Германия)
 Материалы и оборудование
Материалы и оборудование
1.Образец абсолютно сухой бактериальной биомассы.
2.Термостат.
3.Лабораторные весы «Adventurer»™ OH–AR2140 (США)
4.Ампулы для гидролиза.
5.Водяная баня-термостат WB-4MS фирмы «BioSan».
6.Буферные растворы, раствор соляной кислоты.
7.Аминокислотный анализатор A0326V2.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.1.1. Ознакомиться с биофизичеcкимметодом определения аминокислотногосостава белковмикробной биомассы
Порядок выполнения работы
1.Взять навеску биомассы 50 мг.
2.Поместить образец в ампулу из толстого стекла 12х120 мм и доба-
вить 20 мл 6N HCl.
3.Ампулу запаять, провести гидролиз сухого остатка в термостате при 110 0С в течение 22 час.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
271 |
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.2. ИССЛЕДОВАНИЕ АМИНОКИСЛОТНОГО СОСТАВА БЕЛКОВ МИКРООРГАНИЗМОВ
4.После гидролиза содержимое ампулы охладить, профильтровать и перенести в выпарительную чашку. Выпаривание производить на кипящей водяной бане.
5.Сухой остаток растворить в 20 мл буфера рН 2.2.
6.Отобрать 1900 мкл и добавить 100 мкл диметилсульфоксида (ДМС).
7.Взять 100 мкл раствора и пропустить через специальный патрон для очистки раствора аминокислот от примесей. Патрон промывали 1000 мкл буфера (буфер рН 2.2 + 5% ДМС).
8.Анализ проводить на аминокислотном анализаторе A0326V2 (Knauer, Германия). На колонку А0992-13vl нанести 20 мкл образца, разделение аминокислот проходит в градиенте температуры и элюента по прописи, предлагаемой фирмой.
Рис. 6.4. Хроматограмма аминокислотного состава белка бактерий R.eutropha (материалы А. А. Колмаковой)
Задание условий хроматографирования, расшифровку хроматограмм (рис. 6.4) проводить по предлагаемому фирмой стандарту и обсчет результатов – по специальной программе, прилагаемой к прибору.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
272 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.3. ВЫДЕЛЕНИЕЦЕЛЕВОГОПРОДУКТАИЗМИКРОБНОЙБИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕМЕТОДЫИССЛЕДОВАНИЯ
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с основными методами получения целевого продукта на примере биоразрушаемого полиэфира микробиологической природы (ПГА).
 Краткие теоретические сведения
Краткие теоретические сведения
Процесс выделение целевого продукта существенно зависит от его локализации и химической природы. Если продукт находится в культуральной жидкости, то он, как правило, образует очень разбавленные растворы и суспензии, содержащие, помимо целевого, большое количество других веществ. При этом приходится разделять смеси веществ очень близкой природы, поэтому необходимо использовать методы, позволяющие провести разделение, например тот или иной вид хроматографии. Если целевой продукт локализуется в клетке, то необходимо использовать более сложный подход к его извлечению из клетки.
Независимо от локализации продукта биосинтеза на первом этапе проводят отделение твердой фазы (биомассы продуцента) от жидкой фазы (культуральной среды) – сепарацию. Существует несколько способов сепарации.
1. Флотация – разделение мелких частиц и выделение капель дисперсной фазы из эмульсий. Этот метод основан на различной смачиваемости частиц жидкостью и на их избирательном прилипании к поверхности раздела. Основные виды флотации – пенная, масляная и пленочная. Наибольшее распространение в биотехнологии получила пенная флотация, которая заключается в следующем: культуральную жидкость с биомассой микроорганизмов непрерывно вспенивают воздухом, подаваемым снизу вверх под давлением. Клетки и их агломераты «прилипают» к пузырькам тонкодиспергированного воздуха и всплывают вместе с ними, собираясь в специальном отстойнике. Этот метод эффективен для культур дрожжей, которые имеют относительно большие клетки и способны флотироваться, поэтому после сгущения биомассы флотацией их отделяют на обычных барабанных вакуумфильтрах.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
273 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
2. Фильтрация. В этом случае используется принцип задержки биомассы на пористой фильтрующей перегородке. В настоящее время применяют разные фильтры: барабанные, дисковые, ленточные, тарелочные, карусельные вакуум-фильтры, фильтры-прессы различной конструкции, мембранные фильтры. Диаметр пор может превышать размеры клеток, однако при этом эффективность фильтрации практически не снижается, т.к. по мере прохождения жидкости диаметр капиллярных каналов сужается из-за прилипания частиц к стенкам. По мере утолщения слоя биомассы на фильтре скорость протока жидкости падает. Для фильтров непрерывного действия, рассчитанных на длительное время, предусматривают системы автоматического удаления слоя биомассы, забивающего поры. Биологический материал снимают с поверхности фильтра специальным ножом или обработкой сжатым воздухом.
Применяют также фильтры, предназначенные для однократного или многократного периодического использования. Среди них – мембранные фильтры, через которые возможно проводить фильтрацию очень разбавленных растворов. Однако проблемой использования таких фильтров является их закупорка клетками, белками, коллоидными частицами. Приемы сдувания или срезания для этих фильтров не приемлемы, т. к. они быстро разрушаются. Один из путей преодоления этих проблем – покрытие мембран гидрофильным слоем. В настоящее время создана целая отрасль по производству мембранных фильтров и существуют огромное количество фирм, которые поставляют фильтры для всех задач биотехнологии.
3. Центрифугирование. Осаждение взвешенных частиц из культуральной среды происходит под действием центробежной силы. После разделения фаз образуются две фракции: биомасса (твердая) и культуральная жидкость. Центрифугирование требует более дорогостоящего оборудования, чем выше перечисленные методы сепарации. Поэтому оно оправдывает себя, если, во-первых, суспензия фильтруется медленно, во-вторых, необходимо максимально освободить культуральную жидкость от частиц, в-третьих, необходимо наладить непрерывный процесс сепарации в условиях, когда фильтры рассчитаны только на периодический режим. Центрифугирование и фильтрация могут проходить одновременно, этот процесс реализован в фильтрационных центрифугах. Наиболее перспективны для осаждения цен- трифуги-сепараторы, в которых биомасса осаждается на стенках вращаемого цилиндра или на тарелках специальной тарельчатой вставки.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
274 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
Следующим этапом получения целевого продукта биосинтеза является
разрушение клеток (дезинтеграция). Разрушение клеток (дезинтеграцию)
проводят физическим, химическим и химико-ферментативным методами. К физическим методам дезинтеграции относятся обработка ультразвуком, вращение лопасти или вибратора, встряхивание со стеклянными бусами, продавливание через узкое отверстие под давлением, раздавливание замороженной клеточной массы, растирание в ступке, осмотический шок, замо- раживание-оттаивание, декомпрессия (сжатие с последующим резким снижением давления). Физические способы разрушения клеток более экономичные, чем химические и химико-ферментативные. В то же время этим способам дезинтеграции клеток присуща неизбирательность: обработка может влиять на качество получаемого продукта. Химические и химикоферментативные методы более избирательны. Клетки могут быть разрушены толуолом или бутанолом, антибиотиками, ферментами.
За дезинтеграцией клеток следует этап отделения клеточных стенок. Для этого используют те же методы фильтрации и центрифугирования. Однако применяют более высокоскоростное центрифугирование или фильтры с меньшим диаметром, чем при сепарации клеток. В большинстве биотехнологических процессов клеточные стенки отбрасывают, как балласт, но возможно и промышленное получение компонентов клеточных стенок как целевого продукта.
Выделение целевого продукта из культуральной жидкости или гомогената разрушенных клеток проводят путем его осаждения, экстракции или адсорбции.
Экстракция – это процесс избирательного извлечения одного или нескольких растворимых компонентов из твердых тел или растворов с помощью жидкого растворителя – экстрагента. Различают твердо-жидкостную и жидко-жидкостную экстракции. При твердо-жидкофазной экстракции вещество из твердой фазы переходит в жидкую; при жидко-жидкофазной – из одной жидкости в другую (например, хлорофилл из спиртовой вытяжки переходит в бензин). Жидко-жидкостную экстракцию органическими растворителями часто применяют для извлечения из культуральной среды антибиотиков, витаминов, каротиноидов, липидов. Витамин В12 экстрагируют фенолом, высокоспецифичным экстрагентом является бензиловый спирт. Такие фосфолипиды, как фосфатидилэтанол и фосфатидилхолин, извлекают хлороформом.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
275 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
Эффективность экстракции может быть повышена за счет повторной экстракции свежим экстрагентом, выбором оптимального растворителя, нагреванием экстрагирующего агента или экстрагируемой жидкости, понижением давления в аппарате для экстракции. Во многих случаях процесс нагревания может быть губительным для целевого продукта. Для предотвращения этого используется криоэкстракция, которая осуществляется растворителями, кипящими при низких температурах и находящимися при комнатной температуре в газообразном состоянии. Для экстракции неполярных соединений используют жидкий пропан или бутан. При последующем осторожном нагревании до 0 °С растворитель улетучивается и остается продукт в чистом виде.
Экстракция хлороформом используется при выделении из клеток соединений липидной природы (жирных кислот, липидов, полимер гидроксипроизводных алкановых кислот (полигидроксиалканоатов, ПГА). Этот класс полиэфиров хорошо растворяется в хлорсодержащих органических растворителях, таких как хлороформ, трихлорметан, трихлорэтан, но не растворяется в спиртах, ацетоне, гексане, воде. Эти свойства полимера используют при его отделении от липидов после извлечения из бактериальных клеток.
Существует несколько подходов для извлечения ПГА из клеток. Сырую биомассу, собранную центрифугированием, заливают 20 объемами хлороформа и оставляют на 15-20 ч в емкости при комнатной температуре при периодическом перемешивании. Далее разделяют биомассу и хлороформ с полимером в делительной воронке, нижний слой хлороформа собирают, а остаток биомассы еще трижды экстрагируют хлороформом для усиления полноты экстракции. Объединенные хлороформные экстракты полимера и липидов концентрируют, добавляют двойной объем спирта или гексана. Выпавший в осадок полимер отделяют от смеси растворителей. Второй подход, используемый в лабораторных условиях, заключается в следующем: предварительно лиофилизированная биомасса закладывается в патрон аппарата Сокслет, и полимер экстрагируется хлороформом в течение нескольких часов. Третий подход выделения полимера заключается в удалении из биомассы неполимерных компонентов и получения гранул полимера. Для это-
го обычно обрабатывают биомассу детергентами, такими как додецилсульфат натрия, ЭДТА, или лизирующими ферментами. Такое извлечение особенно эффективно для выделения полимера из клеток с высоким его содержанием. Однако чаще всего гранулы полимера, выделенные после химической или ферментативной обработки биомассы, загрязнены остатками бак-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
276 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
териальных клеток, и требуется дополнительная экстракция полимера и его осаждение.
Для идентификации структуры и степени чистоты биологических молекул применяют различные методы, среди которых наиболее значимыми сегодня являются хроматография и масс-спектрометрия.
Хроматография относится к 20 выдающимся открытиям прошедшего столетия, которые в наибольшей степени преобразовали науку, а через нее определили уровень развития техники и промышленности, цивилизации в целом. Хотя по образованию и роду занятий Цвет был ботаником, результаты его открытия оказались столь значимы для всех естественных наук, что Федерация европейских химических обществ приводит имя Цвета, наряду с четырьмя другими русскими именами – Ломоносова, Менделеева, Бутлерова и Семенова, – в числе ста выдающихся химиков прошлого.
В настоящее время хроматография представляет собой:
•самый распространенный и совершенный метод разделения смесей атомов, изотопов, молекул, всех типов изомерных молекул, включая и оптические изомеры, макромолекул (синтетических полимеров и биополимеров), ионов, устойчивых свободных радикалов, комплексов, ассоциатов, микрочастиц;
•уникальный метод качественного и количественного анализа сложных многокомпонентных смесей;
•самостоятельное научное направление и важный физикохимический метод исследования и измерения;
•препаративный и промышленный метод выделения веществ в чистом виде;
•мощную отрасль научного приборостроения.
Ни один аналитический метод не может конкурировать с хроматографией по универсальности применения и эффективности разделения самых сложных многокомпонентных смесей. На современных газохроматографических капиллярных колонках в одном эксперименте могут быть разделены более 1000 индивидуальных компонентов, например, в бензиновых фракциях нефти; двумерный электрофорез позволяет увидеть до 2000 белков в биологических объектах или пептидов в гидролизатах белков. Только благодаря сочетанию разнообразных методов хроматографии и капиллярного электро-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
277 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
фореза стала возможной расшифровка нуклеотидной последовательности ДНК и завершение работ по программе «Геном человека».
Диапазон применения хроматографических методов огромен: от анализа атмосферы планет Солнечной системы до полного анализа содержимого одной живой клетки. Исключительную роль хроматография играет в химической, нефтехимической, газовой, пищевой, целлюлозно-бумажной и многих других отраслях промышленности, прежде всего в технологическом контроле и поддержании оптимального режима производства, в контроле исходного сырья и качества готовой продукции, анализе газовых и водных сбросов производства.
В биотехнологии хроматография является основным процессом выделения вирусов гриппа, энцефалита, бешенства и ящура, очистки вакцин, промышленного производства инсулина, других белков и полипептидов. На промышленную основу поставлено хроматографическое выделение фуллеренов, сапонинов, интерлейкина-2 человека, гистонов, плазмид, ДНК, антибиотиков и многих других ценнейших природных и синтезируемых веществ.
Газовая хроматография (ГХ) – вид хроматографии, в которой подвижной фазой служит газ (пар). Разделение компонентов в ГХ основано на различии скоростей движения и размывания концентрационных зон исследуемых веществ, движущихся в потоке газовой фазы относительно слоя неподвижной фазы, причем эти вещества распределены между обеими фазами. Газ-носитель (воздух, Не, N2, Аr, СО2 и др.) должен обычно иметь небольшую вязкость и обеспечивать высокую чувствительность детектирования. Далее приводятся основные характеристики ГХ.
Основные уравнения в газовой хроматографии
Коэффициент распределения — отношение концентраций исследуемого соединения в неподвижной и подвижной фазах в равновесных условиях:
K = cн |
(6.1). |
cп |
|
Фазовое отношение — это отношение объемов подвижной и неподвижной фаз в колонке:
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
278 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
β = |
Vпод |
(6.2) |
Vнеп
Фактор удерживания (фактор емкости) – это отношение приведенных времен удерживания к мертвому времени:
k = |
tR′ |
(6.3) |
|
t м |
|||
|
|
Фактор разделения — величина, характеризующая селективность разделительной системы, равная отношению факторов удерживания или приведенных времен удерживания двух соседних пиков на хроматограмме:
α2 /1 = |
K2 |
= |
t2′ |
(6.4) |
|
K1 |
t1′ |
||||
|
|
|
Эффективность колонки — характеристика степени размывания полос в колонке, характеризуется числом теоретических тарелок N или H:
N = 5,545 |
|
t |
R |
2 |
|
|
|
|
(6.5) |
||
|
|
||||
|
|
|
|
|
|
|
W0,5 |
|
|
||
где W0,5 — ширина пика на половине высоты,
H = |
L |
(6.6) |
|
N |
, |
|
|
где L — длина колонки; N — безразмерная величина; Н имеет размерность длины обычно в мм.
Разрешение Rs – это отношение расстояния между максимумами исследуемых соседних пиков к сумме их полуширин, выраженных в одних и тех же единицах измерения:
Rs = 2 |
tR |
−tR |
|
(6.7) |
|
2 |
1 |
|
|
||
|
|
|
|
||
|
Wb |
+Wb |
|
|
|
|
1 |
2 |
|
|
|
Связь степени разрешения с фактором разделенияα, фактором уде р- |
|||||
живания и эффективностью : |
|
|
|
|
|
4 ( −1) |
|
√ |
(6.8) |
||
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
279 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
Число тарелок, необходимое для полного разделения при Rs = 1:
16 ( ( −1))2( |
)2 |
(6.9) |
при k > 10 это уравнение можно упростить: |
|
|
16 ( ( −1))2 |
|
(6.10) |
На хроматографическое разделение (на величины α, R и N) влияют многие факторы: природа сорбента, длина и сечение колонки, толщина жидкой пленки на носителе или на стенках капиллярной колонки.
При небольших давлениях инертные газы-носители практически не адсорбируются, особенно в газожидкостной хроматографии. Поэтому природа газа-носителя практически не влияет на селективность разделения, за исключением некоторых случаев в газоадсорбционной хроматографии при разделении газов на активных тонкопористых адсорбентах. В большинстве случаев на входе в колонку используют избыточное давление в пределах от 0,1 до 2 атм (в очень редких случаях выше). Изменение давления в этих пределах практически не влияет ни на селективность, ни на эффективность разделения.
Размер введенной пробы анализируемой смеси должен быть таким, чтобы не вызывать перегрузку колонки. При введении пробы, большей максимально допустимой, изменяются времена удерживания. Особенно важно не перегружать капиллярную колонку, так как ее эффективность резко падает с перегрузкой.
Развитие высокоэффективной ГХ связано прежде всего с изобретением капиллярных колонок. Первоначально капилляры выдували из стекла. Хрупкость таких колонок ограничивало их использование. Появление гибких колонок из кварца с инертной поверхностью дало толчок к развитию ГХ как метода с большей эффективностью разделения по сравнению с насадочными колонками, откуда и появился термин “высокоэффективная газовая хроматография”. Разработка программного обеспечения, производство колонок на коммерческой основе привели к совершенствованию хроматографического оборудования, что существенно расширило область применения газовой хроматографии в науке и промышленности.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
280 |
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
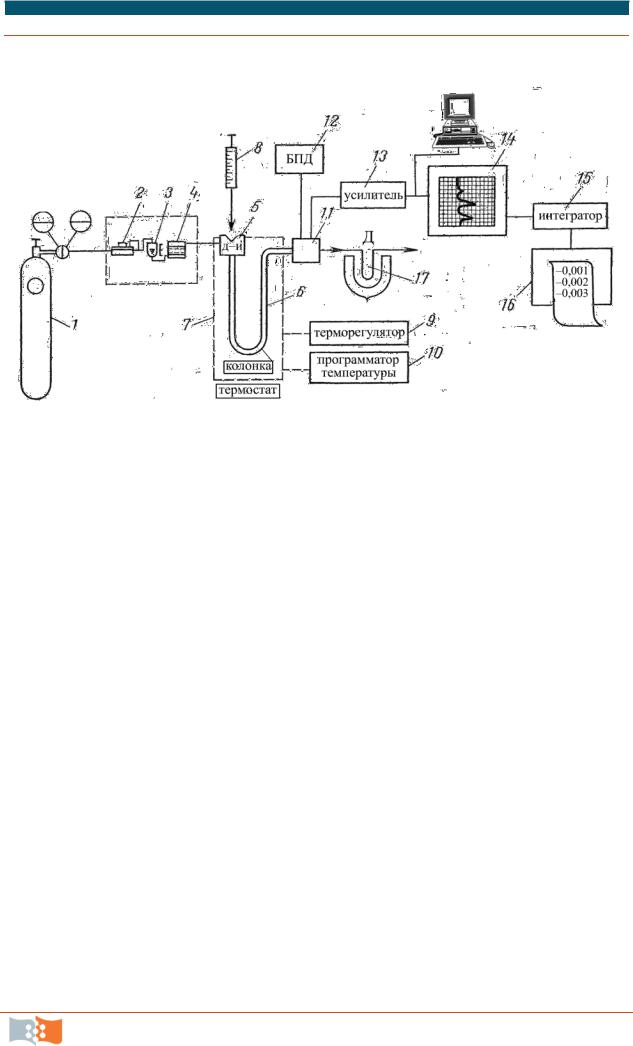
Схема современного газового хроматографа изображена на рис. 6.5.
Рис. 6.5. Функциональная схема газового хроматографа: 1 – баллон со сжатым газом; 2 – регулятор и стабилизатор расхода газа-носителя; 3 – измеритель расхода газа; 4 – фильтр; 5 – дозатор-испаритель; 6 – хроматографическая колонка; 7 – термостат; 8 – микрошприц; 9 – терморегулятор; 10 – программатор температур; 11 – детектор; 12 – блок питания детектора; 13 – усилитель; 14 – самопишущий прибор;
15 – интегратор; 16 – бумажный носитель результатов.
Для газовой хроматографии предложено более 60 типов детектирующих систем, к наиболее часто используемым относятся пламенноионизационный детектор, детектор по теплопроводности, электроннозахватный детектор, термоионный детектор, пламенно-фотометрический детектор, фотоионизационный детектор, масс-спектрометрический детектор. Хромато-масс-спектрометры – одни из наиболее распространенных современных аналитических приборов. В них различные типы газовых, жидкостных или ионных хроматографов (электрофореза) обеспечивают предварительное разделение вещества, а индикацию разделенных веществ и измерение их содержаний осуществляет масс-спектрометр. Поэтому массспектрометры в хроматографии большей частью имеют дело не со смесью соединений, а с индивидуальными соединениями. Масс-спектрометрия (масс-спектральный анализ) – метод анализа вещества путем определения массы (чаще отношения массы к заряду m/z) и относительного количества ионов, получаемых при ионизации исследуемого вещества или уже присут-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
281 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
ствующих в изучаемой смеси. Совокупность значений m/z и относительных величин токов этих ионов, представленная в виде графика или таблицы, называется масс-спектром вещества. Масс-спектрометры устанавливают молекулярную массу вещества, ее атомарный и изотопный состав, а также пространственную структуру расположения атомов.
Как аналитический метод масс-спектрометрия обладает исключительно высокой чувствительностью и позволяет обнаруживать следовые количества органического вещества в больших объемах газов и жидкостей, а также в биологических системах. С помощью масс-спектрометрии можно изучать превращения вещества в процессе химической реакции, что существенно для установления ее механизмов. Масс-спектрометрия в сочетании с газовой хроматографией активно используется в СФУ для решения ряда биотехнологических задач.
Масс-спектрометрия – это физико-химический метод измерения от-
ношения массы ионов к их заряду. Приборы, которые используют в этом методе, называются масс-спектрометрами или масс-спектрометрическими детекторами, которые имеют дело с материальным веществом, состоящим, как известно, из мельчайших частиц – молекул и атомов. Масс-спектрометры устанавливают молекулярную массу вещества, ее атомарный и изотопный состав, а также пространственную структуру расположения атомов.
Как аналитический метод масс-спектрометрия обладает исключительно высокой чувствительностью и позволяет обнаруживать следовые количества органического вещества в больших объемах газов и жидкостей, а также в биологических системах. С помощью масс-спектрометрии можно изучать превращения вещества в процессе химической реакции, что существенно для установления ее механизмов. Отличие масс-спектрометрии от других аналитических физико-химических методов состоит в том, что оптические, рентгеновские и некоторые другие методы детектируют излучение или поглощение энергии молекулами или атомами (например, такие методы как, ИК-, УФ-, КР-спектрометрия и ЯМР), а масс-спектрометрия имеет дело с самими частицами вещества и в отличие от вышеуказанных методов является деструктивным методом анализа, то есть из образующихся при разрушении молекулы ионов исходная молекула регенерироваться не может. Метод масс-спектрометрии основан на ионизации молекул, разделении ионов в газовой фазе, которое происходит в зависимости от соотношения их массы и заряда, а также регистрации разделенных ионов.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
282 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
Всовременной хроматографии для регистрации элюирующихся из колонки веществ используют самые разные детекторы с проточными измерительными ячейками – от простейших фотометров и кондуктометров до сложных и дорогих масс-спектрометров.
Вжидкостной хроматографии большое распространение получили фотометрические детекторы, которые пригодны для регистрации самого широкого круга веществ. Эти детекторы представляют собой либо фотометры с фиксированной длиной волны, перестраиваемой с помощью набора светофильтров, либо спектрофотометры, в которых длина волны монохроматора перестраивается путем поворота дифракционной решетки или призмы. Многие из таких детекторов позволяют не только регистрировать поглощение при любой заданной длине волны в диапазоне 190-800 нм, но и записывать спектр поглощения раствора вещества в элюенте. Полученная таким образом спектральная информация значительно расширяет аналитические возможности метода и повышает надежность идентификации пиков веществ на хроматограмме, что, в свою очередь, во много раз снижает вероятность получения ошибочного результата.
Наиболее универсальным и оптимальным по чувствительности, диапазону в газовой хроматографии является пламенно-ионизационный детектор, принцип работы которого основан на изменении ионного тока, вызванного введением в водородное пламя детектора анализируемого вещества. Он позволяет быстро и точно определять концентрации широкого круга органических соединений, не содержащих галогены и фосфор.
Наиболее информативным подходом для идентификации и количественного анализа органических веществ являются масс-спектрометрические детекторы, применяемые в сочетании с газовой хроматографией. Созданы обширные автоматизированные библиотеки масс-спектров низкомолекулярных органических соединений, позволяющие легко идентифицировать природу и структуру неизвестного метаболита или поллютанта.
Особое внимание следует уделить подготовке проб для хроматографического анализа. Подготовка пробы в химическом анализе часто является длительной, трудоемкой и, вследствие этого, наиболее дорогостоящей частью аналитического процесса. Ее целью может быть удаление из пробы веществ, мешающих определению, перевод определяемого соединения в форму, удобную для анализа, концентрирование определяемого соединения.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
283 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
Современные методы подготовки природных проб обычно направлены на извлечение определяемого вещества из матрицы. Для этих целей широко применяют методы экстракции, среди которых наиболее распространены твердофазная и жидко-жидкостная.
Твердофазная экстракция (ТФЭ) – это метод подготовки проб, основанный на процессах сорбции компонентов пробы на твердом сорбенте при реализации граничных режимов: максимального и минимального удерживания. ТФЭ как метод подготовки пробы используется довольно широко. Основными достоинствами ТФЭ являются быстрота, простота аппаратного оформления, экономичность и повышение безопасности работы аналитика за счет уменьшения расхода токсичных растворителей.
В настоящее время это наиболее эффективный и универсальный метод выделения, очистки и концентрирования индивидуальных веществ из достаточно сложных по составу матриц, позволяющий значительно упростить всю процедуру анализа и повысить его метрологические характеристики.
К недостаткам метода можно отнести низкую эффективность колоноккартриджей (50-100 теоретических тарелок), что позволяет отделить только те компоненты, которые значительно отличаются по удерживанию от определяемого вещества. Существенным недостатком является и ограниченное время эксплуатации экстракционной колонки, что сильно увеличивает стоимость анализа.
Жидко-жидкостная экстракция (ЖЖЭ) – перевод одного или несколь-
ких компонентов пробы из одной жидкой фазы в контактирующую и не смешивающуюся с ней другую жидкую фазу, содержащую избирательный растворитель (экстрагент). ЖЖЭ – традиционный метод подготовки проб, требующих концентрирования определяемого вещества перед анализом. К достоинствам ЖЖЭ можно отнести высокую производительность при необходимости извлечения веществ из больших объемов (более 500 мл) воды; метод может быть реализован практически в любой лаборатории. Классическая ЖЖЭ, с другой стороны, имеет ряд существенных недостатков: трудно автоматизируется, требует больших объемов высокочистых, дорогих и токсичных органических растворителей, процедура экстракции весьма продолжительна по времени и трудоемка. По сравнению с ТФЭ метод ЖЖЭ менее универсален, так как позволяет использовать лишь ограниченный набор растворителей и их смесей, которые не смешиваются с водой (в ТФЭ этой проблемы нет).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
284 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
 Материалы и оборудование
Материалы и оборудование
1.Суспензия бактерий Ralstonia eutropha B-5786, выращенных в условиях лимитирования роста бактерий по азоту.
2.Высокоскоростная центрифуга Avanti J-26XPI (Beckman Int., США).
3.Лабораторные весы «Adventurer»™ OH–AR2140
4.Диспергатор IKA (Германия).
5.Делительная воронка объемом 1–2 литра.
6.Роторный испаритель Rotovapor R210/V (Buchi, Германия).
7.Водяная баня-термостат WB-4MS фирмы «BioSan».
8.Обратный холодильник.
9.Реагенты (хлороформ, спирт этиловый, гексан, серная кислота, безводный сернокислый натрий).
10.Лабораторная посуда (делительные воронки, колбы со шлифом, бюксы).
11.Хромато-масс-спектрометр Agilent 5975Inert (Agilent, США).
 Характеристики оборудования
Характеристики оборудования
 Высокоскоростнаяцентрифуга
Высокоскоростнаяцентрифуга
Для осаждения биомассы бактерий используется высокоскоростная центрифуга, позволяющая центрифугировать большие объемы бактериальной суспензии при 6000 об/мин в условиях пониженной температуры (рис. 6.6).
Технические характеристики центрифуги:
Размеры 865х876х711 мм.
Максимальная скорость вращения 26 000 об/мин. Максимальное ускорение 82 000 g. Максимальная вместимость ротора 6 л. Контроль скорости ±10 об/мин.
Объем центрифужных пробирок от 1,5 до 1000 мл.
Система охлаждения камеры: экологически безопасный хладогент. Устанавливаемый температурный режим камеры от минус 10 0С до 40
0С.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
285 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
Рис. 6.6. Высокоскоростная напольная центрифуга
с охлаждением Avanti J-26XPI Beckman Coulter Int.S.A.,(США)
Контроль температуры камеры ±2 0С.
Контроль дисбаланса ±2,5% при загрузке в противоположные позиции. Тип двигателя: вентильно-индукторный.
Программы, устанавливаемые пользователем: 30 программ (двухэтап-
ные).
Установка времени до 180 мин.
Динамическое определение ротора: автоматическое. Набор роторов.
Ротор на 8 стаканов: 8 x 50 мл, 26000 об/мин, 81770 g. Ротор на 6 пробирок: 6 х 1000мл, 8000 об/мин, 15910 g.
 Роторныйиспаритель
Роторныйиспаритель
Для концентрирования экстрактов и отгонки растворителей используется роторный испаритель Rotovapor R210/V (Buchi, Швейцария) высокой производительности (рис. 6.7).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
286 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
Рис. 6.7. Роторный испаритель Rotovapor R210/V (Buchi, Швейцария)
 Хромато-масс-спектрометр
Хромато-масс-спектрометр
Непосредственно работа выполняется на хромато-масс-спектрометр
Agilent 5975Inert (Agilent, США) (рис. 6.8).
Технические характеристики
Хромато-масспектрометрическая система представляет собой совокупность самых современных технологий: применение химически инертных материалов для изготовления источника ионизации позволяет практически полностью устранить возможность разложения и деградации термолабильных соединений и получать в процессе масс-спектрометрического анализа данные, максимально пригодные для идентификации по библиотекам массспектров.
В модели Agilent 5975 Inert упрощена процедура настройки режима химической ионизации: поток газов-реактантов управляется электронными регуляторами, настройка их оптимальных значений осуществляется в автоматическом режиме практически без участия оператора. К прибору могут быть одновременно подключены два газа-реактанта, их переключение осуществляется при помощи программного обеспечения. Возможность использования источника химической ионизации для работы с ионизацией элек-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
287 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
тронным ударом позволяет программно переключать способ ионизации во время анализа одной пробы.
Рис. 6.8. Внешний вид хромато-масс-спектрометра Agilent 5975Inert (Agilent, США)
Применение технологии QuickSwap дает возможность в считанные минуты производить замену аналитической хроматографической колонки без выключения хромато-масс-спектрометра, проводить обратную продувку колонки для удаления тяжелых компонентов. Используя функцию eMethod, оператор может загружать аналитические методы, разработанные компанией Agilent для анализа тех или иных групп химических соединений, непосредственно с интернет-сайта www.agilent.com
Программа выявления индивидуальных спектров позволяет находить и идентифицировать целевые соединения в сложных матрицах даже в случаях, когда эти вещества не имеют выраженного хроматографического пика.
Система управляется химической станцией на базе современного компьютера, работающего в среде Windows XP. Управление хроматографом и детектором осуществляется посредством LAN-коммуникации.
В стандартный комплект входят программы автоматической настройки, программы сбора и обработки данных, включая библиотечный поиск массспектров и распечатки отчетов о различных форматах. Для удобства обслуживания и ухода за системой имеется комплект стандартных диагностических программ. Дополнительно включены библиотеки масс-спектров NIST-05
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
288 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
(190 825 соединений) со структурными формулами, WiLey (621 600 соединений).
Технические характеристики масс-селективного детектора:
•диапазон масс – от 1,6 до 1050 а.е.м.,
•параметры могут быть выбраны внутри этого диапазона; максимальная скорость сканирования составляет 10000 а.е.м./с.
Рекомендуемая скорость сканирования составляет 800-1600 а. е. м./с, что позволяет получать два или три спектра в 1 с.
Чувствительность при ионизации электронным ударом, режим сканирования 1 пикограмм октафторнафталина при введении в 1 мкл изооктана и использовании стандартной колонки HP-5MS 0,25мм*30м*0,25мкм дает отношение сигнал/шум не хуже 200:1 на отдельной хроматограмме по массе m/z 272. Чувствительность при ионизации электронным ударом, режим регистрации отдельных ионов 20 фемтограмм октафторнафталина при введении в 1 мкл изооктана и использовании стандартной колонки HP5MS 0,25мм*30м*0,25мкм дают отношение сигнал/шум не хуже 50:1 на отдельной хроматограмме по массе m/z272.
Система Agilent 6890/5975 Inert работает при объемной скорости потока газа-носителя (гелия или водорода) до 2 мл/мин при использовании стандартного турбомолекулярного насоса, до 4 мл/мин при использовании высокоэффективного турбомолекулярного насоса (262 л/с) и колонок с внутренним диаметром 0,32 мм.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.3.1. Ознакомиться с основнымиметодами получения целевого продуктана при-меребиоразрушаемого полиэфира микробиологической природы (ПГА).
Порядок выполнения работы
1. Суспензию бактериальных клеток мерно поместить в центрифужные стаканы и уравновесить на весах. Далее уравновешенные стаканы поместить в ротор центрифуги Avanti J-26XPI. Центрифугирование проводить в течение 20 мин при 7000 об/мин.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
289 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
2.После остановки центрифуги вынуть стаканы, слить супернатант, из биомассы, осевшей на дно стакана, взять навеску 1 г на аналитических весах
иперенести в стакан дезинтегратора.
3.Для определения содержания сухого вещества в биомассе в предварительно взвешенный бюкс (А г) поместить 200-250 мг сырой биомассы, взвесить бюкс с сырой навеской (Б г), поставить в сушильный шкаф и сушить в течение 24 ч при температуре 105 °С.
4.После высушивания бюкс вынуть из шкафа и охладить в эксикаторе. Охлажденный бюкс взвесить и записать навеску (В г). Затем снова поставить бюкс с высушенной биомассой в сушильный шкаф и сушить пробу в течение 0,5 часа. Процедуру охлаждения бюкса повторить и снова взвесить. Если вес бюкса не изменился, то проба высохла до абсолютно сухого веса и можно рассчитать сухой вес биомассы по формуле
сухой вес = (В−А)х100/(Б−А) (в %).
5.К сырой биомассе в стакане дезинтегратора добавить 10 мл смеси хлороформа и спирта (2:1 по объему) и обработать биомассу на дезинтеграторе IKA в течение 30 с для разрушения бактериальных клеток.
6.Затем количественно перенести разрушенную биомассу в колбу с притертой пробкой и добавить еще 10 мл смеси спирт-хлороформ, колбу закрыть и оставить на 3 ч для экстракции полимера и липидов из биомассы бактерий при периодическом помешивании.
7.Отделить фильтрованием на стеклянном фильтре под вакуумом водоструйного насоса растворитель и остатки биомассы. Промыть тремя порциями хлороформа по 5 мл осадок на фильтре для полноты извлечения полимера. Хлороформ объединить с растворителем.
8.Смесь растворителей пропустить через безводный сернокислый натрий. Для этого используется обычная воронка с ватой, на которую наносится слой соли.
9.Обезвоженный экстракт поместить во взвешенную коническую колбу (А г), отогнать растворитель на роторном испарителе Rotovapor R210/V, поместить колбу с экстрагированными липидами и полимером в эксикатор на 2 ч, а затем взвесить (Б г).
10.Для отделения полимера от липидов в колбу с экстрактом налить 5 мл хлороформа. После полного растворения экстракта добавить два объема
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
290 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
гексана (10 мл). В этих условиях происходит осаждение полимера в виде хлопьев, а липиды остаются растворенными в хлороформе.
11.Отделить полимер от растворителя на стеклянном фильтре, промыть тремя (по 5 мл) порциями гексана полимер, осевший на фильтр, количественно собрать с фильтра полимер во взвешенный бюкс (В г), сушить в т е- чение 2 ч в сушильном шкафу при 60 °С.
12.Перенести бюкс с полимером в эксикатор. После остывания взвесить бюкс с полимером и рассчитать содержание выделенного из биомассы полимера.
13.Для расчета содержания полимера в сухой биомассе учитывается абсолютно сухой вес образца сырой биомассы, взятой исходно для анализа. Если сухой вес составляет 50 %, то для экстракции полимера было взято 500 мг сухой биомассы. Далее по разности бюкса с полимером и пустого (Г-Б) находим количество выделенного полимера. Если за 100 % принять вес сухой биомассы, то содержание полимера будет составлять (Г-Б)х100/500 (%). Таким образом определяется содержание полимера весовым методом. Выделенный полимер сохраняется для следующих лабораторных работ.
14.Растворитель с липидами собрать в отдельную колбу, отогнать на роторном испарителе, липидный экстракт сохранить для следующих лабораторных работ в морозильной камере холодильника.
15.Для проверки полноты экстракции необходимо определить содержание полимера в сухой биомассе хроматографическим методом. Для этого взвешиваем на аналитических весах 4 мг сухой биомассы, переносим навеску в колбу со шлифом, добавляем 1 мл метанола, 0,75 мл концентрированной серной кислоты и 1 мл хлороформа с внутренним стандартом. В качестве внутреннего стандарта используется бензойная кислота (0,5 мг/мл). Прикрепляем колбу к обратному холодильнику, помещаем в водяную баню и проводим метанолиз в течение 2,5 ч при температуре 90 °С. После того как колба
среакционной смесью остынет, ее снимаем и добавляем 2 мл дистиллированной воды.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
291 |
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
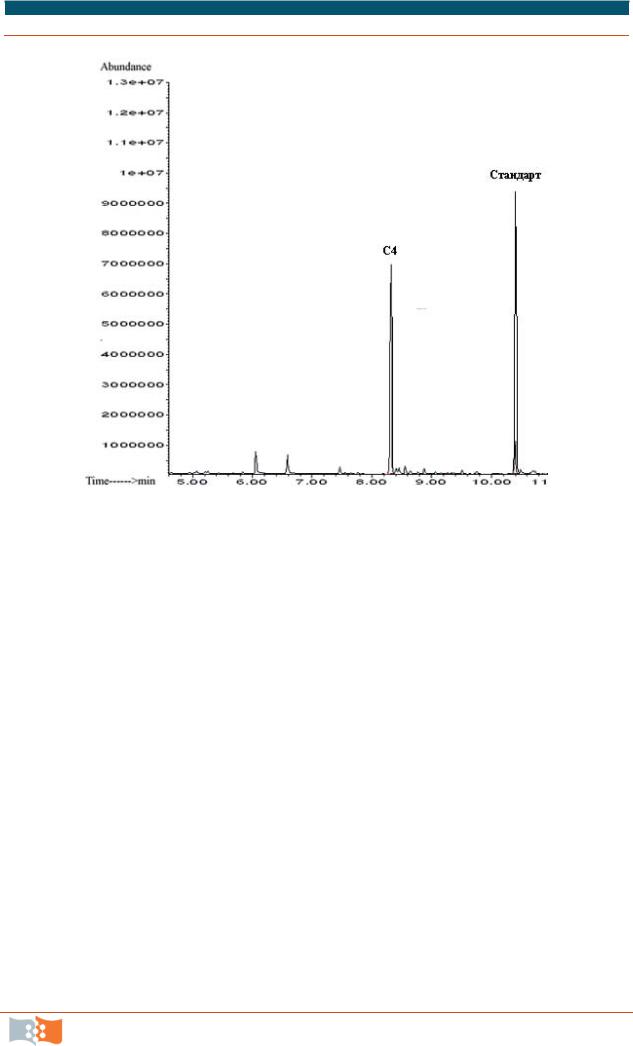
Рис. 6.9. Типичная хроматограмма метилированного образца полигидроксибутирата: пик, обозначенный как С4, соответствует мономеру гидроксибутирата, внутренний стандарт – бензойная кислота (материалы Г. С. Калачевой)
16.После расслоения фаз (нижняя хлороформная фаза содержит метиловые эфиры мономеров полимера и бензойной кислоты) записываем пробу на газовом хроматографе и рассчитываем содержание полимера в исходной биомассе (образец хроматограммы дан на рис. 6.9; масс-спектр анализируемого вещества – рис. 6.10).
17.Расчет проводится следующим образом: Sстандарт соответствует 0,5
Х= · 4 · 0,5/ стандарт,
где k – коэффициент, полученный экспериментальным путем. Процентное содержание полимера находим из учета навески.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
292 |
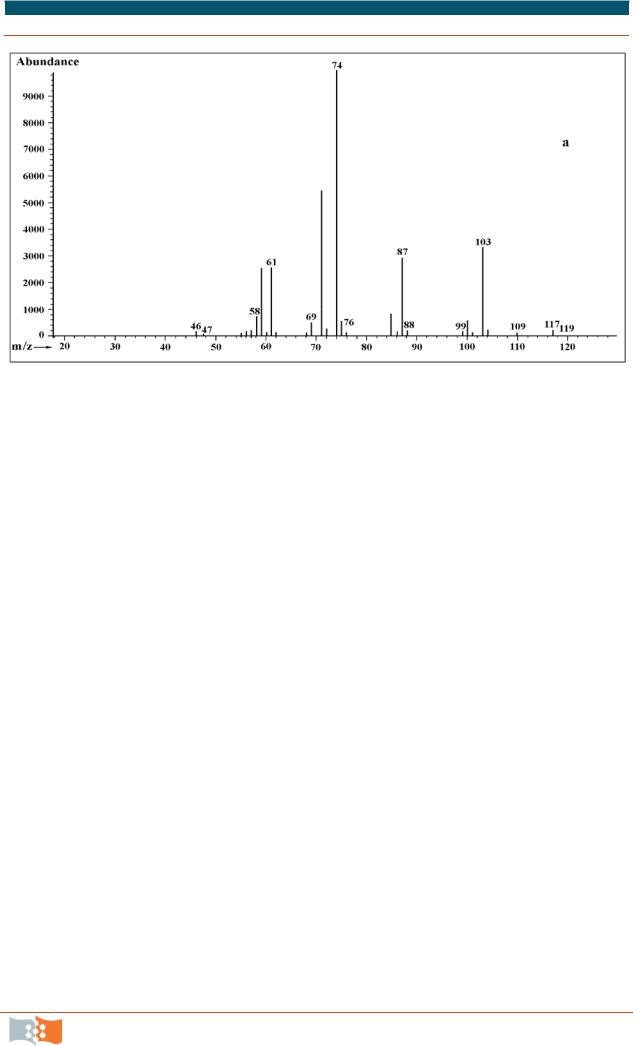
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
Рис. 6.10. Масс-спектры метилового эфира β-гидроксибутирата, входящего в состав полимера (ПГА) (материалы Г. С. Калачевой)
18.Оценить полноту экстракции, сравнивая результаты весового и хроматографического методов определения полимера в биомассе.
19.Оформить результаты в виде табл. 6.1.
Таблица 6.1
Сравнение весового и хроматографического методов определения содержания
полимеров в биомассе бактерий
|
Содержание полимера, % |
Полнота экстрак- |
||
Навеска, г |
|
|
||
|
Хроматографический |
|||
Весовой метод |
ции, % |
|||
|
|
|||
|
метод |
|
||
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
293 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.3. ВЫДЕЛЕНИЕ ЦЕЛЕВОГО ПРОДУКТА ИЗ МИКРОБНОЙ БИОМАССЫИ ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫИССЛЕДОВАНИЯ
 Контрольные вопросы
Контрольные вопросы
1.Перечислить основные методы сбора биомассы и дать краткую характеристику этим методам.
2.Методы разрушения клеток.
3.Перечислить основные этапы выделения целевого продукта.
4.Что такое экстракция?
5.Какой экстрагент подходит для выделения полигидроксиалканоатов из бактерий?
6.Каков принцип весового метода определения содержания полимера
вбактерия?
7.В чем преимущество хроматографического метода определения содержания полимера?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
294 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.4. ИССЛЕДОВАНИЕСОСТАВАЖИРНЫХКИСЛОТЛИПИДОВ БИОМАССЫRALSTONIA EUTROPHA B-5786 МЕТОДОМХРОМАТО-МАСС- сПЕКТРОМЕТРИИ
 Цель лабораторной работы
Цель лабораторной работы
•идентификация состава жирных кислот методом газовой хроматографии и масс-спектрометрии.
 Материалы и оборудование
Материалы и оборудование
1.Липидный экстракт из Ralstonia eutropha B-5786.
2.Реактивы: хлороформ, этанол, метанол, концентрированная серная кислота, гексан, бензол, дистиллированная вода, натрия сульфат безводный.
3.Лабораторная посуда: грушевидные колбы на 50 мл, пипетки, обратные холодильники, воронки, делительные воронки, пробки, шприц хроматографический на 10 мкл.
4.Лабораторное оборудование: роторный испаритель Rotovapor R210/V (Buchi, Германия), Водяная баня-термостат WB4MS фирмы «BioSan», хромато-масс спектрометр Agilent 5975Inert (Agilent, США).
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.4.1. Определение состава жирных кислотметодом газовой хроматографии и масс-спектрометрии
Порядок выполнения работы 1. Приготовление метиловых эфиров жирных кислот (ЖК):
–приготовить смесь из 10 мл метанола и 0,2 мл концентрированной серной кислоты;
–добавить в колбу к осушенным липидам 2-3 капли бензола и 0,5 мл метанольной смеси;
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
295 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.4. ИССЛЕДОВАНИЕ СОСТАВА ЖИРНЫХ КИСЛОТ ЛИПИДОВ БИОМАССЫRALSTONIA EUTROPHA B-5786
–нагреть водяную баню до 90 оС, подключить водяное охлаждение к обратным холодильникам, установить колбу на шлиф холодильника и поместить нижнюю часть колбу (1/2-1/3) в воду;
–длительность метанолиза составляет 1,5-2 ч, в течение этого времени необходимо наблюдать за охлаждением, температурой в бане, целостью колбы и пр.;
–по окончании процесса снять колбу, добавить 1 мл дистиллированной воды и 2 мл гексана, интенсивно встряхнуть несколько раз;
–перелить смесь в делительную воронку, добавить 5 мл дистиллированной воды, слить из воронки нижний водный слой, повторно добавить и слить 5 мл дистиллированной воды;
–верхний слой, состоящий из гексана с растворенными метиловыми
эфирами ЖК, пропустить через слой Na2SO4 в грушевидную колбу, затем испарить гексан на роторном испарителе так, как описано ниже;
–готовые метиловые эфиры ЖК хранить в морозильной камере непосредственно до проведения газовой хроматографии.
2. Выпаривание гексана:
–подключить вакуум, водяное охлаждение к роторному испарителю, отрегулировать температуру водяной бани в пределах 35-40 оС;
–поместить колбу с экстрактом на стеклянный выход-шлиф испарителя, закрыть герметизирующий кран и включить вращение колбы;
–по окончании испарения растворителей из колбы выключить вращение, открыть герметизирующий кран, снять колбу, отключить вакуум и охлаждение.
3.Подготовка газового хроматографа к выполнению анализов:
–открыть газовую линию (гелий) и проверить ее на герметичность;
–включить хроматограф, масс-спектрометр, запустить управляющую компьютерную программу;
–дождаться прогрева вакуумного насоса, установить температурный режим всех блоков хроматографа, через 4 ч работы провести тестирование и настройку детектора с помощью программного обеспечения;
–при успешном результате тестирования прибор готов к работе.
4.Газовая хроматография метиловых эфиров ЖК:
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
296 |
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.4. ИССЛЕДОВАНИЕ СОСТАВА ЖИРНЫХ КИСЛОТ ЛИПИДОВ БИОМАССЫRALSTONIA EUTROPHA B-5786
–выбрать нужный метод проведения анализа из имеющихся, установить режим ввода пробы «split», т.е. с делением потока газа при вводе пробы;
–заполнить данные о пробе при формировании файла, где будут храниться результаты анализа;
–в колбу с метиловыми эфирами с помощью микрошприца добавить 20-40 мкл гексана, смыть и сконцентрировать вещество на дне колбы, по окончании отобрать шприцом 1-3 мкл раствора;
–запустить «анализ пробы» из компьютерной программы, дождаться сигнала готовности прибора, ввести пробу в инжектор;
–процесс хроматографии происходит далее около 1 ч, за это время введенные метиловые эфиры ЖК разделяются на колонке, подаются в массспектрометрический детектор, где производится регулярное сканирование спектров вещества, выходящего из колонки, спектры и общая ионная интенсивность записываются в соответствующий файл (рис. 6.11).
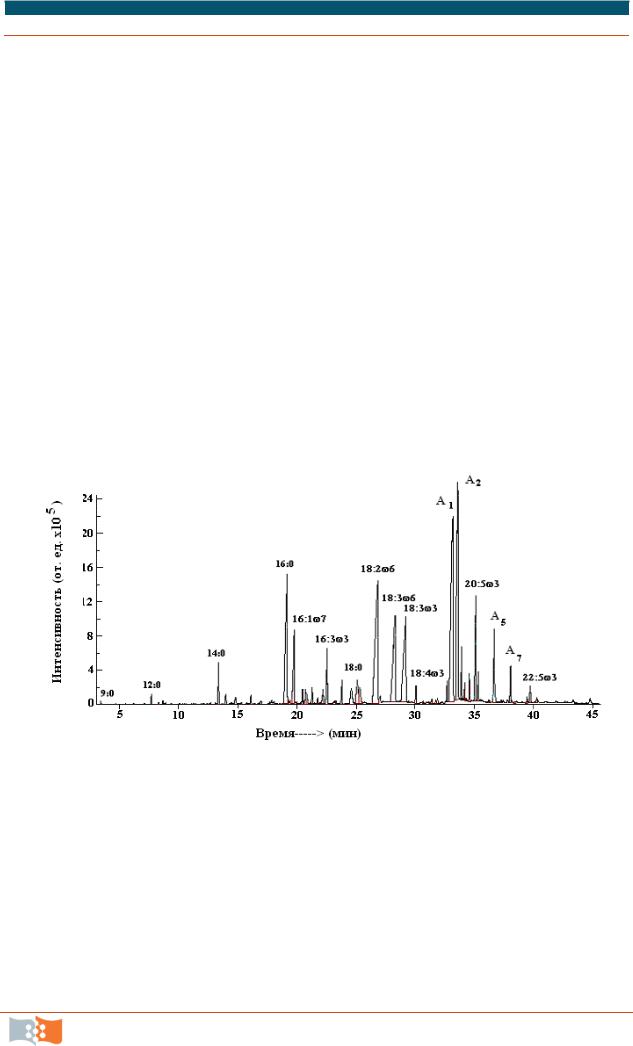
Рис. 6.11. Хроматограмма метиловых эфиров жирных кислот (материалы Г. С. Калачевой)
5. Идентификация пиков метиловых эфиров ЖК:
– по окончании анализа возможна работа со сформированным файлом пробы с помощью специальной программы обработки данных;
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
297 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.4. ИССЛЕДОВАНИЕ СОСТАВА ЖИРНЫХ КИСЛОТ ЛИПИДОВ БИОМАССЫRALSTONIA EUTROPHA B-5786
–провести идентификацию пиков на хроматограмме путем сравнения масс-спектров веществ с имеющимися в базе данных;
–рассчитать процентное содержание основных жирных кислот от их общей суммы;
–провести сравнение результатов с литературными данными.
 Контрольные вопросы
Контрольные вопросы
1.В чем заключается принцип действия газовой хроматографии, каковы основные функциональные блоки газового хроматографа?
2.Принцип метода масс-спектрометрии.
3.Для чего необходимо образование метиловых эфиров жирных кислот перед выполнением газохроматографического анализа?
4.Как происходит формирование и запись масс-спектров веществ в детекторе прибора, каковы основные блоки масс-спектрометрического детектора квадрупольного типа?
5.Какую информацию о структуре молекулы ЖК можно получить с п о- мощью масс-спектрометрии?
6.Какие ЖК являются наиболее распространенными у бактерий?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
298 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.5. ОПРЕДЕЛЕНИЕУГЛЕВОДОРОДОВ, СИНТЕЗИРЕМЫХВОДОРОСЛЬЮ BOTRYOCOCCUS BRTAUNII, МЕТОДОМХРОМАТО-МАСС-СПЕКТРОМЕТРИИ
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с методом определения структуры водорослевых углеводородов.
 Краткие теоретические сведения
Краткие теоретические сведения
Необходимость разработки новых и эффективных способов производства энергетических носителей и восполнения сырьевых ресурсов стала особенно актуальной в последние два десятилетия из-за острого дефицита сырья и энергии в глобальном масштабе и повышения требований к экологической безопасности технологий. Первые попытки поиска среди фотосинтезирующих организмов потенциальных продуцентов энергоносителей в виде жидких углеводородов относятся к 1978 г., когда исследователи пытались обнаружить в соке некоторых растений, главным образом у представителей семейства молочайных, жидкие углеводороды. Однако попытки не увенчались успехом, так как концентрация углеводородов у высших растений оказалась крайне низкой. Несколько позже удалось установить способность к синтезу жидких углеводородов у водорослей и бактерий.
Обнаружено, что у зеленой водоросли Botryococcus braunii содержание углеводородов может составлять от 15 до 75 % от суммы липидов. Эта вод о- росль, как оказалось, достаточно широко распространена в природе, встречается в самых разных местах: от солоноватых озер Австралии до водохранилищ в окрестностях Лондона. Обнаруженные в прошлом в Австралии высохшие остатки этой водоросли под названием «коорнангит» явились даже поводом для возникновения своеобразной нефтяной «лихорадки». Сходные породы (остатки углеводородпродуцирующей водоросли) время от времени обнаруживают в различных частях света – в районе оз. Мозамбик в Африке («N′haugellite»), в Казахстане в районе озера Балхаш («балхашит»); известно, что данная водоросль втсречается и в солоноводном озере Шира.
Данная водоросль существует в двух разновидностях: красная и зеленая, потому что хлоропласты этой водоросли имеют разную окраску, обусловленную присутствием пигментов в виде хлорофиллов всех типов, а также каротинов и их окисленных производных (ксантофиллов, лютеина, неоксантина, зеоксантина и др.). В составе клеточной оболочки водоросли, помимо
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
299 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.5. ОПРЕДЕЛЕНИЕ УГЛЕВОДОРОДОВ, СИНТЕЗИРЕМЫХ ВОДОРОСЛЬЮ BOTRYOCOCCUS BRTAUNII
жира, белков, углеводов и внутреннего целлюлозного слоя, обнаружен спорополлениновый слой, состоящий из окисленных полимеров каротинов и каротиноидных веществ. В неблагоприятных условиях роста, вызванных, например, дефицитом каких-либо биогенов или повышением солености среды, соотношение основных групп пигментов изменяется в сторону доминирования каротиноидов, и тогда водоросли приобретают оранжево-красную окраску. При дефиците, например, ионов магния в среде концентрация углеводородов в клеточной стенке достигает 70–75 %. При этом было выявлено, что зеленая водоросль синтезирует линейные углеводороды с нечетным числом углеродных атомов в цепи (С25–С31) и бедна ненасыщенными связями. Красная разновидность синтезирует линейные углеводороды с четным числом углеродных атомов в цепи (С34–С38) и с несколькими ненасыщенными связями. Данные углеводороды, «ботриококкцены», накапливаются водорослью в ростовой фазе в клеточной стенке. Извлечь углеводороды без разрушения клеток можно центрифугированием биомассы водоросли, в ходе которого углеводороды «вытекают» из клеток. Последние можно вновь поместить в среду в условия аккумуляции углеводородов. Варьируя условия роста, освещенность, температуру, концентрацию солей, исследователи из Французского института нефти сократили время удвоения от семи до двух суток, при этом выход углеводородов составил 0,09 г/л в сутки, что соответствует 60 т/га в год. Фракция углеводородов, синтезируемая водорослью, аналогична керосину или дизельному топливу.
 Материалы и оборудование
Материалы и оборудование
1.Липидный экстракт (получение – см. работу 6.3) из биомасса водоросли B. вraunii, выращенная в лабораторной люминостатной культуре.
2.Центрифуга лабораторная.
3.Пластинки для тонкослойной хроматографии.
4.Силикагель, гипс.
5.Хроматографическая камера.
6.Хромато-масс-спектрометр Agilent 5975Inert (Agilent, США).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
300 |
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.5. ОПРЕДЕЛЕНИЕ УГЛЕВОДОРОДОВ, СИНТЕЗИРЕМЫХ ВОДОРОСЛЬЮ BOTRYOCOCCUS BRTAUNII
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.5.1. Знакомство с методом определенияструктуры водорослевых углеводородов
Порядок выполнения работы
1.Липидный экстракт нанести тонкой полосой на пластинку для тонкослойной хроматографии.
2.Поместить пластинку в хроматографическую камеру с элюентом.
3.Пластинку извлечь из камеры, высушить на воздухе в вытяжном шкафу и проявить соответствующие полосы обработкой пластинки йодом
(рис. 6.12).
Рис. 6.12. Хроматограмма липидов изолята Botryococcus озера Шира. Система: гексан–эфир–уксусная кислота (85:15:1 по объему): 1 – полярные липиды, 2 – свободные жирные кислоты, 3 – триацилглицерины, 4 – углеводороды, x – неидентифицированнная фракция, S – стандарты
(материалы Г.С. Калачевой)
4.Фракцию, соответствующую углеводородам, снять с пластинки вместе с силикагелем, растворить в гексане (фракция углеводородов получена!)
5.Далее проба анализируется на хромато-масс-спектрометр Agilent 5975 Inert (Agilent, США).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
301 |
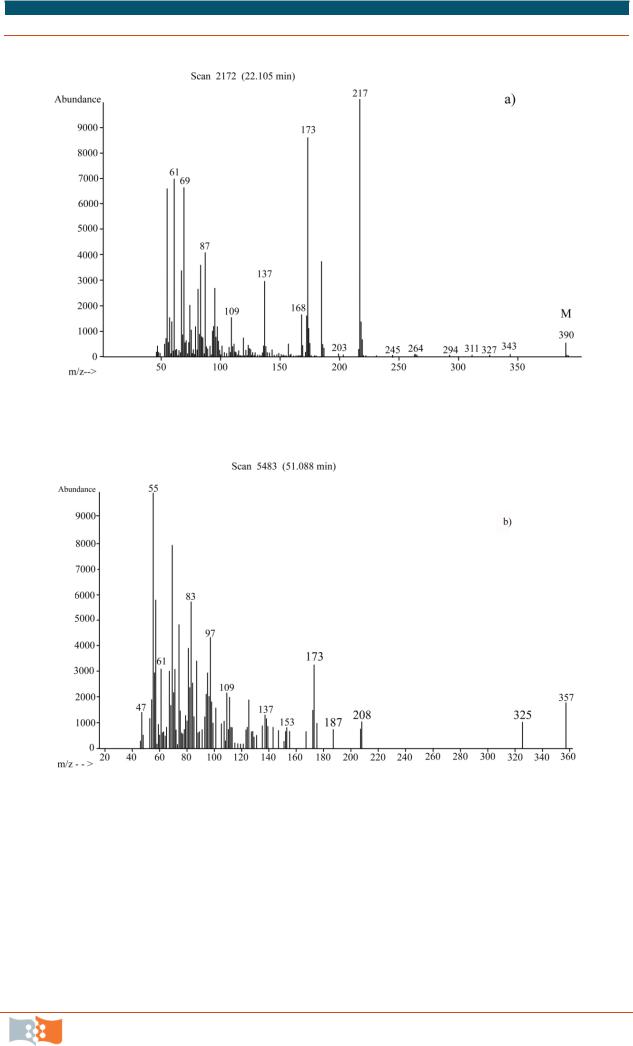
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.5. ОПРЕДЕЛЕНИЕ УГЛЕВОДОРОДОВ, СИНТЕЗИРЕМЫХ ВОДОРОСЛЬЮ BOTRYOCOCCUS BRTAUNII
Рис. 6.13. Масс-спектры основных диенового и триеновых углеводородов изолята Botryococcus озера Шира: а – 29:2; б – 29:3 (материалы Г. С. Калачевой)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
302 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.6. МЕТОДЫДЕТЕКТИРОВАНИЯБИОЛОГИЧЕСКИХМОЛЕКУЛС ПРИМЕНЕНИЕМВЫСОКОЭФФЕКТИВНОЙЖИДКОСТНОЙХРОМАТОГРАФИИ (ВЭЖХ)
 Цель лабораторной работы
Цель лабораторной работы
•освоение методов высокоэффективной жидкостной хроматографии, знакомство с современными методами детектирования, применяемыми для исследований химического состава биологических объектов.
 Задачи лабораторной работы
Задачи лабораторной работы
•ознакомление со способами пробоподготовки, обучение технике экстракции низкомолекулярных классов органических веществ;
•освоение метода высокоэффективной жидкостной хроматографии в сочетании с УФ-детектированием на основе высокоэффективной хроматографической системы «Милихром А-02» (ЗАО «ЭкоНова», г. Новосибирск);
•освоение метода исследования молекулярной массы биологических макромолекул методом гель-фильтрации с использованием системы ВЭЖК Breeze фирмы Waters (США).
 Краткие теоретические сведения
Краткие теоретические сведения
ВЭЖХ – это жидкостная колоночная хроматография, механизмы сорбции в которой могут использоваться самые различные. По существу, ВЭЖХ
– это современная форма реализации классической жидкостной колоночной хроматографии. Ниже перечислены некоторые наиболее существенные качественные характеристики ВЭЖК:
•высокая скорость процесса, позволившая сократить продолжительность разделения от нескольких часов и суток до минут;
•минимальная степень размывания хроматографических зон, что дает возможность разделять соединения, лишь незначительно различающиеся по константам сорбции;
•высокая степень механизации и автоматизации разделения и обработки информации, благодаря чему колоночная жидкостная хроматография достигла нового уровня воспроизводимости и точности.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
303 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.6. МЕТОДЫ ДЕТЕКТИРОВАНИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ С ПРИМЕНЕНИЕМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ (ВЭЖХ)
 Материалы и оборудование
Материалы и оборудование
1. Хроматограф жидкостный микроколоночный «Милихром А-02« (ЗАО «Эконова», г. Новосибирск); колонка Ø2х75 мм с ОФ со р-
бентом prontosil 120-5C18 AQ # 1410 («Bischoff Analysentechnik und Geräte gmbh», Германия) (рис. 6.14).
2.Пипетки-дозаторы переменного объема 10÷100 мкл со сменными наконечниками.
3.Стеклянные пробирки с пробками на 5 мл.
4.Ацетонитрил чистоты «для ВЭЖХ».
5.Раствор веществ-стандартов (полиароматические вещества) состава: нафталин, антрацен, пирен (в ацетонитриле).
 Хроматографжидкостныймикроколоночный
Хроматографжидкостныймикроколоночный
Рис. 6.14. Внешний вид хроматографа «Милихром А-02» с портативным компьютером
Технические характеристики
Хроматограф «Милихром А-02» – микроколоночный высокоэффективный костный хроматограф с УФ-спектрофотометрическим детектором (рис. 6.14) является настольным лабораторным прибором, оснащенным градиентной системой элюирования, автоматическим вводом пробы и спектрофотометрическим детектором. Он выполнен в виде портативного переносного прибора и может использоваться в составе любых аналитических лабораторий, в том числе в составе подвижных (например, на автомобилях или водных судах).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
304 |
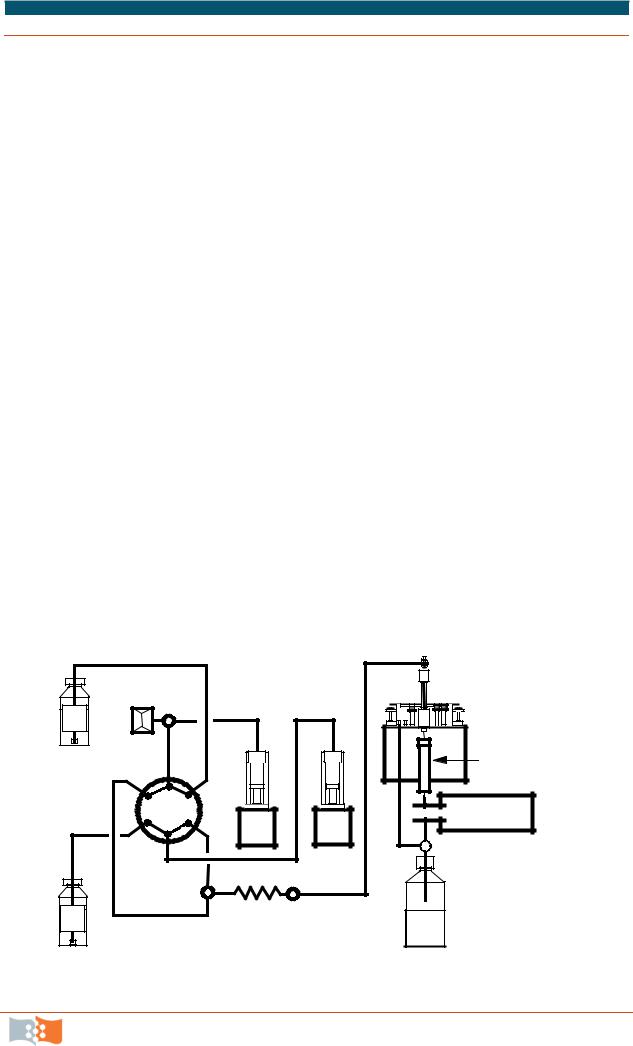
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.6. МЕТОДЫ ДЕТЕКТИРОВАНИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ С ПРИМЕНЕНИЕМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ (ВЭЖХ)
Прибор характеризуется:
•100%-й автоматизацией, может работать круглосуточно и обеспечивает максимальную производительность;
•высокой чувствительностью анализов;
•гарантирует высокую достоверность результатов анализа, что достигается сочетанием высоких метрологических характеристик хроматографической системы с одновременно получаемой спектральной информацией;
•низкой стоимостью одного анализа;
•малым весом и малыми габаритными размерами;
•работоспособностью в широком температурном диапазоне;
•минимальным потреблением электрической энергии и малой чувствительностью к изменениям параметров питающей сети;
•минимальным расходом легкогорючих и токсичных органических растворителей, которые требуют особых мер безопасности в передвижных лабораториях;
•минимальным временем приведения в рабочее состояние после транспортировки.
На рис. 6.15 приведена схема жидкостного хроматографа «Милихром
А-02».
Датчик |
|
|
давления |
Насосы |
|
A |
|
|
|
|
|
Элюент А |
|
|
Кран |
A |
B |
|
||
B |
Смеситель |
|
|
|
|
Элюент В |
|
|
Автодозатор |
Колонка в
термостате

 Детектор
Детектор
Сборник
Рис. 6.15. Схема хроматографа «Милихром А-02»
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
305 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.6. МЕТОДЫ ДЕТЕКТИРОВАНИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ С ПРИМЕНЕНИЕМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ (ВЭЖХ)
Хроматограф «Милихром А-02» состоит:
•из двухкомпонентного градиентного насоса шприцевого типа, который через шестипортовый двухходовой кран одновременно соединяется либо с резервуарами для элюентов А и В (положение НАБОР), либо через тройник – со входами смесителя (положение РАБОТА), обеспечивающего эффективное смешивание элюентов. В линии насоса А установлен датчик давления, включенный через дополнительный капилляр;
•из автоматического дозатора (автодозатора), который имеет верхнее основание с установленной на нем съемной круглой кассетой на 46 проб. На нем смонтирован узел инжекции и узел привода инжекционной иглы, установлены резервуары для буферного раствора и для промывки инжекционной иглы и специальные гнезда для слива элюента через иглу и для тестирования гидравлической системы;
•из подвижной вращающейся инжекционной иглы, которая служит для набора пробы, нанесения ее на колонку и элюирования, она постоянно соединена с выходом смесителя;
•из хроматографической колонки, помещенной в термостат, в котором нагревательным элементом и термометром служит прецизионная медная обмотка;
•из спектрофотометрического детектора УФ-диапазона (190-360 нм). Спектрофотометрический детектор с проточной микрокюветой и объемом менее 1,2 мкл специально оптимизирован для работы с микроколонками с объемом около 150-200 мкл.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.6.1. Ознакомлениес конструкцией и приобретение навыков эксплуатации жидкостного хроматографа «Милихром А-02»
Цель – приобретение навыков работы на хроматографе «Милихром А- 02», математическая обработка хроматографических данных с использованием программы МУЛЬТИХРОМ (фирма «Амперсенд», г. Москва).
Задачи:
• ознакомление с основными блоками и схемой работы прибора;
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
306 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.6. МЕТОДЫ ДЕТЕКТИРОВАНИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ С ПРИМЕНЕНИЕМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ (ВЭЖХ)
•освоение программы МУЛЬТИХРОМ, управляющей сбором и обработкой данных;
•запись хроматограммы смеси стандартных веществ, ее анализ и получение информации о имеющихся пиках веществ, их количественных характеристиках.
Порядок выполнения работы
1.Включить компьютер и запустить управляющую программу МУЛЬТИХРОМ.
2.Включить хроматограф и подготовить его к работе согласно инструкции эксплуатации прибора.
3.Наполнить резервуары для элюентов 100%-ным ацетонитрилом.
4.Погрузить капилляры насосов А и В в резервуары с элюентами (элюенты должны быть комнатной температуры). После опускания фильтра в сосуд несколько раз встряхнуть фильтр и сосуд для удаления воздушных пузырьков с поверхности фильтра.
5.Открыть диалоговое окно ручного управления прибором.
6.Установить температуру анализа 35 °С.
7.Провести процедуру смены растворителей для обоих насосов. Цикл необходимо повторить 3-5раз.
8.Выполнить тест на герметичность.
9.Провести процедуру промывки иглы.
10.Провести процедуру промывки инжекционного порта для того, чтобы исключить наличие в инжекционном порту остатков предыдущих проб или грязи.
11.Проверить правильность установок параметров анализа и колонки
вменю Параметры/Конфигурация анализа:
•задать параметры хроматографического процесса;
•просмотреть и напечатать общий отчет.
 Контрольные вопросы
Контрольные вопросы
1.Кем и когда была открыта жидкостная хроматография?
2.Какое агрегатное состояние имеет подвижная фаза в ВЭЖХ?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
307 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.6. МЕТОДЫ ДЕТЕКТИРОВАНИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ С ПРИМЕНЕНИЕМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ (ВЭЖХ)
3.Какой вариант жидкостной хроматографии реализуется в случае, когда сорбент является неполярным, а подвижная фаза – полярной?
4.От чего зависит площадь хроматографического пика вещества?
5.От чего зависит объем или время удерживания вещества?
6.Хроматографическое разделение можно проводить в двух режимах: изократическом и градиентном. Чем определяется выбор режима хроматографирования?
7.В ходе лабораторной работы было проведено разделение смеси трех полиароматических углеводородов: нафталина, антрацена и пирена. Объясните порядок выхода компонентов, исходя из их химического строения.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
308 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.7. СПЕКТРОФОТОМЕТРИЧЕСКИЙДЕТЕКТОРВЭЖХ. СКАНИРОВАНИЕ СПЕКТРОВАРОМАТИЧЕСКИХСОЕДИНЕНИЙ
 Цель лабораторной работы
Цель лабораторной работы
•сформировать представление об информативности спектрофотометрического анализа в сочетании с ВЭЖХ для идентификации органических веществ биологических объектов, имеющих ароматические группы.
 Задачи лабораторной работы
Задачи лабораторной работы
•ознакомиться с принципами работы и устройством спектрометрического детектора ВЭЖХ;
•провести запись спектров поглощения стандартных ароматических веществ (полиароматических углеводородов);
•провести идентификацию структуры веществ по имеющейся базе спектров.
 Краткие теоретические сведения
Краткие теоретические сведения
В ВЭЖХ наиболее универсальным является спектрофотометрический детектор, так как с его помощью можно решать практически все задачи, включающие определение веществ, не поглощающих УФ-излучение (для таких случаев применяют метод косвенного детектирования).
Спектрофотометрический детектор обеспечивает измерение оптической плотности раствора (элюата), вытекающего из колонки и проходящего через проточную фотометрическую кювету, при одной или нескольких длинах волн света. Принцип действия спектрофотометрического детектора ос-
нован на известном законе светопоглащения Бугера-Ламберта-Бера. |
|
|
||||||||
вещества с |
|
К |
|
|
|
|
|
|
|
па- |
Пусть монохроматический свет от источника интенсивностью |
|
|||||||||
дает на кювету |
|
длиной |
|
(оптический путь). Кювета |
заполнена |
раствором |
||||
|
|
|
|
|
||||||
|
концентрацией . Вещество способно поглощать монохроматиче- |
|||||||||
ское излучение; мерой |
способности поглощения данного монохроматиче- |
|||||||||
|
С |
|
|
|
|
|||||
ского излучения служит величинаε – коэффициент молярного поглощения, или экстинкция. Из кюветы выходит ослабленный световой пучок интенсивностью (рис. 6.16).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
309 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.7. СПЕКТРОФОТОМЕТРИЧЕСКИЙ ДЕТЕКТОР ВЭЖХ. СКАНИРОВАНИЕ СПЕКТРОВ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Рис. 6.16. Иллюстрация к закону светопоглощения Бугера-Ламберта-Бера
Согласно закону светопоглощения, при длине волны λ=const:
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
(6.11) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где – интенсивность светового потока после прохождения кюветы; |
|
– ин- |
|||||||||||||||||
тенсивность |
падающего светового потока; – экстинкция; |
|
– |
молярная кон- |
|||||||||||||||
|
|
0 |
|
||||||||||||||||
центрация вещества в кювете; – длина |
кюветы. |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
||||||||||||||
Т |
|
|
А = ( 0/6.) |
|
|
|
в процентах, называется пропусканием |
||||||||||||
|
Отношение |
|
к |
0 |
, |
выраженное |
|||||||||||||
|
, а величина |
|
|
|
|
– оптической плотностью вещества. При логариф- |
|||||||||||||
мировании выражения ( |
11) получаем: |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(6.12) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
т. е. оптическая плотность вещества прямо пропорциональна концентрации анализируемого вещества. В спектрофотометрических детекторах выходным сигналом является именно оптическая плотность А.
Формула (6.12) – основа количественного анализа при использовании спектрофотометрического детектора, так как оптическая плотность А вещества прямо пропорциональна высоте или площади хроматографического пика.
Зависимость оптической плотности А вещества от длины волны падающего на кювету с веществом света в диапазоне длин волн 190–360 нм (сплошное излучение дейтериевой лампы) называется ультрафиолетовым спектром поглощения.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
310 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.7. СПЕКТРОФОТОМЕТРИЧЕСКИЙ ДЕТЕКТОР ВЭЖХ. СКАНИРОВАНИЕ СПЕКТРОВ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Считается, что УФ-спектры индивидуальны для каждого вещества, однако УФ-спектры растворов слишком сглажены и имеют широкие полосы поглощения, что делает эти спектры не очень информативными. Тем не менее, получение УФ-спектров компонентов разделяемой смеси необходимо для определения оптимальной длины волны анализа, что позволяет значительно поднять порог обнаружения этого вещества (любое вещество, поглощающее в ультрафиолетовой части электромагнитного спектра, имеет длину волны, при которой у вещества максимальное поглощение; при использовании такой длины волны детектор определяет наименьший порог концентраций вещества).
Среди спектрофотометрических детекторов наибольшее распространение получили сканирующие УФ-спектрофотометры с быстрым циклическим переключением нескольких длин волн в процессе разделения и с возможностью записи спектра после остановки потока. Использование детекторов данного типа существенно повышает достоверность результатов анализа. На одноволновой хроматограмме идентификация пика осуществляется только путем сравнения его времени удерживания с временем удерживания пика стандарта. Когда же веществу на хроматограмме соответствует несколько пиков при разных длинах волн, то в качестве критерия идентификации можно использовать еще и значения относительных площадей этих пиков (спектральные отношения).
= 0 = 0 = 0 = |
(6.13) |
 Материалы и оборудование
Материалы и оборудование
1.Хроматограф жидкостный микроколоночный «Милихром А- 02« (ЗАО «ЭкоНова», г. Новосибирск); колонка Ø2х75 мм с ОФ сорбентом ProntoSIL 120-5C18 AQ # 1410 («Bischoff Analysentechnik und Geräte GmbH», Германия); – пипетки-
дозаторы переменного объема 10÷100 мкл со сменными наконечниками;
2.Стеклянные пробирки с пробками, на 5 мл.
3.Ацетонитрил чистоты для ВЭЖХ.
4.Раствор веществ-стандартов (полиароматические вещества) состава: нафталин, антрацен, пирен (в ацетонитриле).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
311 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.7. СПЕКТРОФОТОМЕТРИЧЕСКИЙ ДЕТЕКТОР ВЭЖХ. СКАНИРОВАНИЕ СПЕКТРОВ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.7.1. Наосновании измеренных спектров поглощения стандартных ароматических веществ провести идентификацию структуры веществ
Порядок выполнения работы
1.Включить компьютер и запустить управляющую программу МУЛЬТИХРОМ, подготовить хроматограф к работе (см. работу 6.6).
2.В процессе хроматографии, когда через фотометрическую ячейку протекает чистый элюат, необходимо сделать паузу и запустить сканирование спектра.
3.Записать спектры веществ-стандартов: нафталина, антрацена, пире-
на.
4.По полученным спектрам определить оптимальные для анализа длины волн (не менее трех).
5.Записать хроматограмму стандартной смеси в стандартных условиях (см. работу 6.6).
6.Используя обрабатывающую программу «МультиХром», рассчитать спектральные отношения, нормированные на длину волны λ=250 нм.
7.Результаты предоставить в виде распечатанных спектров всех веществ и распечатанного отчета, включающего имя компонента, объем удерживания, спектральные отношения для каждого компонента.
 Контрольные вопросы
Контрольные вопросы
1.Почему для корректной записи спектра поглощения вещества необходимо вычитать базовую (нулевую) линию?
2.Объясните, почему при использовании УФ-фотометрического детектора необходимо, чтобы применяемые элюенты обладали хорошим пропусканием в области ультрафиолетового спектра?
3.Объясните принцип работы спектрофотометрического детектора?
4.Расположите приведенные ниже типы УФ-фотометрических детекторов в порядке возрастания их информационных возможностей и универсальности, обоснуйте свой ответ.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
312 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.7. СПЕКТРОФОТОМЕТРИЧЕСКИЙ ДЕТЕКТОР ВЭЖХ. СКАНИРОВАНИЕ СПЕКТРОВ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
1)УФ-фотометры с ртутной лампой на одну длину волны λ=254 нм;
2)УФ-фотометры с набором фильтров на несколько длин волн;
3)УФ-спектрофотометры с фиксируемой для всего анализа длиной волны – любой из полного диапазона;
4)УФ-спектрофотометры с возможностью переключения длины волны на разных участках хроматограммы;
5)Сканирующие УФ-спектрофотометры с быстрым циклическим переключением нескольких длин волн в процессе разделения и с возможностью записи спектра после остановки потока.
5. Какой из приведенного выше списка детектор используется в хроматографе «Милихром А-02»?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
313 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.8. КОЛИЧЕСТВЕННЫЙАНАЛИЗВВЭЖХ
 Цель лабораторной работы
Цель лабораторной работы
•ознакомление с базовыми методами определения абсолютной концентрации органических веществ, идентифицируемых ВЭЖХ.
 Задачи лабораторной работы
Задачи лабораторной работы
•сформировать представление о количественных методах ВЭЖХ, т. е. абсолютной калибровки, нормализации, добавок, внутреннего стандарта;
•определить концентрацию нафталина в растворе ацетонитрила с помощью ВЭЖХ методом абсолютной калибровки.
 Краткие теоретические сведения
Краткие теоретические сведения
Количественный анализ проводят после того, как идентификация уже сделана и пик на хроматограмме можно отнести к конкретному веществу. Таким образом, задачей количественного анализа является определение содержания одного или нескольких компонентов в пробе.
Мерой количества вещества служит площадь соответствующего ему пика на хроматограмме. При ручной обработке хроматограммы площадь пика с достаточной точностью можно найти как произведение его высоты на полуширину. В современных хроматографах вычисление площади пика производится автоматически интеграторами или системами сбора информации на базе компьютеров.
Для отнесения найденной площади пика некого компонента к его концентрации в пробе необходимо провести калибровку – установление количественной зависимости площади пика от концентрации. Существует несколько методов калибровки: нормализация, абсолютная калибровка по внешнему стандарту, метод добавок, калибровка по внутреннему стандарту.
Метод нормализации
Согласно методу нормализации концентрацию (%) i-го компонента пробы рассчитывают как отношение его площади к сумме площадей всех других пиков
|
(6.14) |
|
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
314 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.8. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В ВЭЖХ
Метод пригоден только для оценочной характеристики состава разделяемой смеси.
Метод абсолютной калибровки
Метод абсолютной калибровки позволяет гораздо точнее определять концентрацию компонентов в анализируемой пробе. Для реализации этого метода необходим стандарт – анализируемое вещество в чистом виде. Из него готовят ряд растворов с известными концентрациями, перекрывающими ожидаемый диапазон содержания этого компонента в пробе.
Далее эти растворы последовательно хроматографируют в одинаковых условиях и получают ряд площадей пиков, соответствующих концентрационному ряду калибровочных растворов. На основании этих данных строят калибровочный график, по которому и определяют концентрацию данного компонента в пробе, находя соответствие площади пика количеству компонента. График в идеале имеет вид прямой линии и может быть обсчитан методом наименьших квадратов по линейной регрессии. Полученное уравнение зависимости концентрации от площади пика можно использовать для расчета концентрации аналита.
Метод абсолютной калибровки довольно прост в реализации и часто используется на практике, но имеет существенный недостаток: компоненты матрицы могут влиять на форму пика и его площадь, особенно при неполном разделении аналитов на хроматограмме, что увеличивает погрешность определения концентрации компонентов пробы.
Метод добавок
В исследуемую пробу вводят известное количество анализируемого вещества. При этом на хроматограмме пик определяемого компонента увеличивается пропорционально количеству введенного стандарта. В этом методе удобнее проводить сравнение не площадей, а высот пиков. Но при этом нужно обязательно проверить несколькими последовательными добавками сохранение линейной зависимости высоты пика от концентрации вещества в пробе. Определение концентрации вещества проводят по калибровочному графику.
Существенным недостатком метода абсолютной калибровки и метода добавок является необходимость использования стандарта. Часто стандарт может быть недоступен в чистом виде. Также стандарт может быть химически нестоек (лабилен) или летуч и не допускает сколько-нибудь продолжи-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
315 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.8. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В ВЭЖХ
тельной работы с ним, а также хранения стандартного раствора без изменения концентрации.
Метод внутреннего стандарта
В качестве внутреннего стандарта подбирается вещество со свойствами, близкими к определяемому, которое добавляется в анализируемую пробу в известной концентрации. При этом необходимо, чтобы при данных условиях разделения это вещество выходило на хроматограмме в области, свободной от других компонентов пробы.
Вычисление концентрации определяемого компонента в пробе проводят по соотношению
|
|
ст |
ст |
(6.15) |
|
Следует отметить, что при использовании метода внутреннего стандарта линейность детектирования необходимо проверять уже по отношению к обоим веществам.
 Материалы и оборудование
Материалы и оборудование
1.Хроматограф жидкостный микроколоночный «Милихром А- 02« (ЗАО «эконова», г. Новосибирск).
2.Колонка Ø2х75 мм с ОФ сорбентом prontosil 120-5C18 AQ #
1410 («Bischoff Analysentechnik und Geräte gmbh», Германия); –
пипетки-дозаторы переменного объема 10÷100 мкл со сменными наконечниками.
3.Стеклянные пробирки с пробками на 5 мл;
4.Ацетонитрил чистоты для ВЭЖХ;
5.Растворы разной концентрации нафталина в ацетонитриле.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.8.1. Определить концентрацию нафталина врастворах используя базовыеметодами определения абсолютной концентрации органических веществ, идентифицируемых ВЭЖХ
Порядок выполнения работы
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
316 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.8. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В ВЭЖХ
1.Включить компьютер и запустить управляющую программу «МультиХром», подготовить хроматограф к работе (см. работу 6.6).
2.Последовательно записать пять хроматограмм с различной концен-
трацией нафталина в ацетонитриле: С1 = 5 мг/мл, С2= 2,5 мг/мл, С3=1 мг/мл, С4 – Х мг/мл, С5 -У мг/мл, задав следующие условия хроматографического процесса.
3.По команде «Старт» запустить анализ.
4.После окончания анализа данные автоматически запишутся в файлы.
5.По градуировочному графику определить концентрацию нафталина
врастворах №4 и №5 (метод/градуировка/графики).
 Контрольные вопросы
Контрольные вопросы
1.В чем преимущество использования баз данных по сравнению с известными методами количественного анализа?
2.Какие методы количественного анализа, применяемые в ВЭЖХ, вам известны?
3.Каким образом следует выбирать диапазон концентраций градуировочного графика при методе абсолютной калибровки?
4.Перечислите основные действия для создания и сохранения градуировочной таблицы концентраций исследуемого вещества в виде файла в программе «МультиХром».
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
317 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.9. ИЗУЧЕНИЕРАСПРЕДЕЛЕНИЯМОЛЕКУЛЯРНЫХМАСС БИОЛОГИЧЕСКИХМАКРОМОЛЕКУЛМЕТОДОМГЕЛЬ-ПРОНИКАЮЩЕЙ ХРОМАТОГРАФИИ
 Цель лабораторной работы
Цель лабораторной работы
•приобретение навыков работы с жидко-жидкостной хроматографией.
 Краткие теоретические сведения
Краткие теоретические сведения
Важнейшими характеристиками высокомолекулярных биомолекул (например, полиэфиров) служат величина молекулярной массы и степень полимеризуемости. Реакции полимеризации приводят к распределению отрезков цепи в полимере и к распределению молярной массы (Mв). Предполагается, что распределение Mв может быть разбито на количество цепей в смеси, каждая из которых имеет определенную длину. Свойства полимеров в значительной мере зависят от величины молярной массы.
|
Значение средней молекулярной массы полимера определяется мето- |
||||||||||||||||
/ ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
дами, с помощью которых ведется подсчет молекул, например: |
|
||||||||||||||||
|
Вес |
|
|
|
|
|
|
|
|
|
|
|
— |
|
количество |
||
|
, |
где |
|
|
— количество молекул массы |
|
; |
|
|
|
общее |
= ( ∙ |
|||||
|
, где |
i – доля массы ( |
|
|
|
|
). |
|
|
|
в = ( ∙ |
||||||
молекул; |
|
|
|
— масса молекул длины . |
|
|
|
|
|
|
|
|
|||||
) |
|
|
|
|
|
|
|
|
= / ( ∙ |
|
|
|
|
|
|
||
|
|
|
средней молярной массы полимера находят из: |
|
|||||||||||||
|
|
в |
|
|
|
|
|
|
|
|
|
|
|
Полидисперсность поли- |
|||
меров позволяет оценить, каково соотношение в полимере фрагментов с
= /
различной степенью полимеризуемости, и вычисляется из соотношения
в .
Корректная регистрация данных параметров возможна только с применением гель-проникающей хроматографии, которая позволяет определить вес средней молекулярной массы полимера ( в) и полидисперсность материала.
Гель-фильтрация обычно используется и для разделения молекул, и для определения их размеров. Колонки, предназначенные для гельфильтрации, заполнены крошечными пористыми инертными шариками; при использовании таких колонок происходит разделение белков или других соединений по размерам. Молекулы небольшого размера по мере прохождения через колонку проникают внутрь шариков, а более крупные молекулы остаются в промежутках между шариками. В результате они быстрее прохо-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
318 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.9. ИЗУЧЕНИЕ РАСПРЕДЕЛЕНИЯ МОЛЕКУЛЯРНЫХ МАСС БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ
дят через колонку и выходят из нее первыми. В качестве матрикса можно использовать зерна поперечно-сшитого полисахарида (декстран или агароза). Таким образом, при помощи гель-фильтрации можно разделить смеси веществ в зависимости от размеров их молекул. Выход веществ из колонки происходит в порядке уменьшения их молекулярной массы. Так можно разделить полипептиды, белки и другие макромолекулы. Метод гельпроникающая хроматографии является разновидностью гель-фильтрации, при котором водные элюенты заменены неполярными растворителями. Этот метод хорошо себя зарекомендовал при очистке пестицидов, а также жирорастворимых витаминов перед их определением методом ВЖХ.
Основной тип сорбенты для гель-проникающей хроматографии – сти- рол-ДВБ. Гель-проникающая хроматография широко используется для изучения распределения молекулярных масс полимеров. Этот процесс можно реализовать на специально собранной системе высокоэффективной жидкостной хроматографии Breeze фирмы Waters (США). На рис. 6.17 представлен общий вид прибора, который комплектуется изократическим насосом, ручным инжектором, рефрактометрическим детектором и собственным программным обеспечением, адаптированным для пользователей, имеющих начальный опыт работы с ВЭЖХ. Гельпроникающая хроматография наиболее простая технология для молекулярномассового разделения полимеров. Олигомеры, мономеры и добавки в комплексных полимерных растворах также могут быть разделены, если молекулярно-массовые разницы между компонентами существенны. Для характеристики полимеров разработаны специальные колонки: Styragel®, UltraStyragel™ и Shodex®, которыми снабжена хроматографическая система Breeze.
 Характеристики оборудования
Характеристики оборудования
 Системавысокоэффективнойжидкостнойхроматографии
Системавысокоэффективнойжидкостнойхроматографии
Для выполнения работы используется система высокоэффективной жидкостной хроматографии Breeze фирмы Waters (США) (рис. 6.17). Система позволяет осуществить гель-проникающую хроматографию, которая широко используется для изучения распределения молекулярных масс полимеров. Олигомеры, мономеры и добавки в комплексных полимерных растворах также могут быть разделены, если молекулярно-массовые разницы между компонентами существенны. Для характеристики полимеров фирмой разра-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
319 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.9. ИЗУЧЕНИЕ РАСПРЕДЕЛЕНИЯ МОЛЕКУЛЯРНЫХ МАСС БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ
ботаны специальные колонки: Styragel®, UltraStyragel™ и Shodex® , которыми снабжена хроматографическая система Breeze.
Рис. 6.17. Общий вид ВЭЖХ Breeze фирмы Waters (США)
 Материалы и оборудование
Материалы и оборудование
1.Полигидроксибутират, выделенный из биомасса бактерий R. eutrophus B-5786.
2.Система ВЭЖХ Breeze с ручным инжектором и рефрактометрическим детектором для анализа молекулярномассовых распределений полимеров.
3.Набор полистероловых стандартов с молекулярной массой от 50 000 до 1 000 000 дальтон для построения калибровочного графика.
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 6.9.1. Ознакомиться спорядкомапорведения жидко- жидкостной хроматографии
Порядок выполнения работы
1. Приготовить 0,1 % раствор полимера в хлороформе. Для этого надо взвесить 50 мг полимера, выделенного на предыдущем занятии, перенести в
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
320 |
РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.9. ИЗУЧЕНИЕ РАСПРЕДЕЛЕНИЯ МОЛЕКУЛЯРНЫХ МАСС БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ
мерную колбу на 50 мл, добавить в колбу 10-15 мл хлороформа и после растворения полимера довести хлороформом объем до метки.
2.Таким же способом приготовить 0,1 %-е растворы полистероловых стандартов с различной молекулярной массой – от 50 000 до 1 000 000 дальтон.
3.Приготовить элюент, в качестве которого служит обезвоженный и перегнанный хлороформ, перед использованием хлороформ дегазируется пропусканием через элюент инертного газа – гелия.
4.Включить систему «Бриз» и задать программу хроматографирования.
5.Ввести через ручной инжектор 10 мкл стандартного раствора и дать команду «Старт» для проведения хроматографирования.
6.После завершения хроматографирования стандартов записать пробу полимера.
7.Провести расчеты хроматограмм в соответствии с заданной калиб-
ровкой.
8.Результаты оформляются в виде графика распределения молекулярных масс полимера (рис. 6.18).
Интенсивность, отн. ед.
18000 |
1 |
|
2 |
||
|
||
16000 |
3 |
|
14000 |
4 |
|
|
12000
10000
8000
6000
4000
2000
0
10 |
12 |
14 |
16 |
18 |
20 |
22 |
24 |
Время выхода, мин
Рис. 6.18. Хроматограммы распределения молекулярных масс у образцов ПГА различного химического состава: 1 – 1420 кДа (ПГБ 100 %); 2 – 980 кДа (ПГБ 100 %); 3 – 570 кДа (ПГБ 27 %, ПГВ 63 %); 4 – 380 кДа (ПГБ 93 %, ПГВ 7 %) (материалы Т. Г. Воловой)
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
321 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.9. ИЗУЧЕНИЕ РАСПРЕДЕЛЕНИЯ МОЛЕКУЛЯРНЫХ МАСС БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ
 Контрольные вопросы
Контрольные вопросы
1.История открытия хроматографии.
2.Перспективы использования хроматографического метода.
3.Виды хроматографии по агрегатному состоянию элюента.
4.Перечислить и охарактеризовать основные виды хроматографии в зависимости от природы взаимодействия, обусловливающего распределение компонентов между элюентом и неподвижной фазой.
5.Преимущества и достоинства ВЭЖК.
6.Какой метод используется для исследования молекулярного распределения высокомолекулярных биомолекул?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
322 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА6.10. СПЕКТРОСКОПИЧЕСКИЕИТЕРМИЧЕСКИЕМЕТОДЫ ИССЛЕДОВАНИЯБИОЛОГИЧЕСКИХМАКРОМОЛЕКУЛ
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с физическими методами исследования структуры и свойств биологических макромолекул на примере микробных полиэфиров полигидроксиалканоатов.
 Краткие теоретические сведения
Краткие теоретические сведения
Важный вопрос для характеристики высокомолекулярных биологических макромолекул – композиционное распределение мономеров. Понимание механизма этого процесса позволяет прояснить такие важные моменты, как закономерности образования концентрационных областей (сокристаллизованных и блочных), структура аморфной и кристаллической фаз, появление концентрационных эффектов подавления кристаллизации и ограничение образования малокомпозиционных полиэфиров. Анализ литературы свидетельствует о том, что эффекты внутримолекулярного движения в различных многокомпонентных полиэфирах практически всегда тесно связываются с процессами со-кристаллизации и структурой макромолекулярных цепей.
Конфигурация биополимеров определяется химической структурой.
Конформация полимера относится к его трехмерной структуре, и требуется только вращение связей для того, чтобы преобразовать одну конформацию в другую. Виниловые полимеры типа СНХ=СНХ и CH2=CXY образуют синдио-
тактические, атактические и изотактические формы. Полимеры типа СН2=СНХ являются стереорегулярными и не обладают никакой регулярностью молекулярной структуры. Свойства полимеров определяются типом хирального центра. Хиральным центром называют атом углерода с четырьмя пр и- крепленными различными группами. Существуют левые (L) и правые (D) формы хирального центра. Хиральные центры, как правило, приводят к оптической активности полимеров. Молекула полимера может поворачивать поляризованный свет плоскости. Наличие хиральных центров в структуре полимеров влияет на процесс полимеризации, который может реализовываться несколькими способами:
1) левосторонний и правосторонний хиральные центры могут связываться произвольно, или атактически;
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
323 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.10. СПЕКТРОСКОПИЧЕСКИЕ И ТЕРМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ
2)хиральные центры могут соединяться чередующимся образом, что называется синдиотактически;
3)хиральные центры могут связываться друг с другом с помощью одной схемы, или изотактически.
Для переработки термопластичных полимеров в специализированные изделия большое влияние на процесс оказывают температурные характеристики. Температурные характеристики полиметров относят к наиболее значимым параметрам полимеров, так как они определяют термомеханические свойства и, следовательно, возможность получения из этих полимеров изделий. У ряда полимеров, в том числе у ПГА, температура, при которой происходит их деформация, несколько ниже температуры кипения (температуры деградации), поэтому газовое состояние в этих полимерах не реализуется и основным видом фазового равновесия в них является конденсированное состояние – кристаллическое, стеклообразное, вязкотекучее и жидкое. Температура, при которой полимерный материал из стеклообразного состояние переходит в резиноподобное, является температурой стеклования (Тg). Температура стеклования совпадает с сегментным перемещением полимерных цепей и 4-5-кратным уменьшением модуля. Процессы диффузии в полимере увеличиваются на несколько порядков при прохождении Тg. Весьма важны также значения температуры плавления (Тпл) и термической деградации (Тдегр.) полимеров. Если у полимера существует значительный разрыв (80100 оС) между значениями этих величин, можно применять методы переработки из расплава.
Полимеры по механическим свойствам существенно различаются между собой; среди них – упругие твердые вещества, резиноподобные эластомеры, вязкие жидкости. В отличие от металлов и керамики, механические свойства полимеров (абсолютная прочность, модуль Юнга, степень кристалличности) могут изменяться во времени. Это поведение известно под названием «вязкоупругость».
Основными гидродинамическими характеристиками полимерных макромолекул являются их поступательные, вращательные и более сложные конформационные движения, экспериментально исследуемые методами диффузии, седиментации, рассеяния света, осмометрии и вискозиметрии. В растворах в равновесном состоянии макромолекулы полимерных материалов могут образовывать различные конформационные структуры, зависящие от типа растворителя, длины и жесткости молекулярных цепей, химической
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
324 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.10. СПЕКТРОСКОПИЧЕСКИЕ И ТЕРМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ
структуры мономолекулярных секторов. В области больших молекулярных масс для анализа внутримолекулярного состояния часто используются представления о конформациях в виде запутанных «клубков», при этом цепи повышенной жесткости образуют более рыхлую упаковку по сравнению с гибкоцепными полимерами. Как следствие этого, в жесткоцепных молекулах практически отсутствуют эффекты «исключенного» объема, поэтому их свойства очень мало будут зависеть от качества растворителя. В гибкоцепных молекулах растворитель, наоборот, оказывает определяющее влияние на гидродинамические и вязкоупругие характеристики. Для изучения структуры высокомолекулярных биоматериалов используют ЯМР- и ЭПРспектроскопию, рентгеноструктурный анализ, ИК-спектроскопию.
С помощью ИК-спектроскопии возможно изучение спектров поглощения различных, в том числе высокомолекулярных соединений. По форме интенсивности полос в низкочастотной области получают информацию о соотношении аморфной и кристаллической фаз в полимерах (например, полиэтилене, полипропилене и политетрафторэтилене), так как по мере увеличения степени кристалличности (Сх) становятся более узкими и интенсивными полосы спектра, обусловленные регулярными участками макромолекул, из которых построена кристаллическая область.
 Материалы и оборудование
Материалы и оборудование
1.Образцы полимеров (ПГА) в виде пленочных дисков, растворов, прессованных форм.
2.Реагенты: стирол, вазелиновое масло, хлороформ.
3.ИК-Фурье-спектрометр «Инфралюм ФТ-02», кюветы разборные с вкладышами.
4.Набор колец-стаканов, держатели для кювет, прокладки.
5.Автоматические пипетки
6.Агатовая ступка с пестиком.
7.Прибор для комплексного термического анализа STA 449 Jupiter
(NETZSCH, Германия).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
325 |

РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
РАБОТА 6.10. СПЕКТРОСКОПИЧЕСКИЕ И ТЕРМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ
 Характеристики оборудования
Характеристики оборудования
 ИК-спектрометр
ИК-спектрометр
Качественный структурно-групповой анализ мономера гидроксимасляной кислоты и полимера проводят методом ИК-спектроскопии с использованием ИК-спектрометра «Инфралюм ФТ-02» (рис. 6.19).
Технические характеристики ИК-спектрометра «Инфралюм ФТ-02»
Универсальный Фурье-спектрометр среднего и дальнего ИК-диапазона (350–6500 см-1). Прибор обеспечивает качественный и количественный анализ чистых соединений, в том числе биополимеров, а также многокомпонентных растворов и смесей. Позволяет проводить исследование структуры образцов биополимеров в виде растворов, суспензий в вазелиновом масле, в твердом состоянии в виде пленок или таблетированных с КВr тонких образцов.
Рис. 6.19. Общий вид ИК-спектрометра фирмы «Люмэкс» «Инфралюм ФТ-02»
 Прибордлякомплексноготермическогоанализа
Прибордлякомплексноготермическогоанализа
Для определение температур физических и химических превращений полимеров (температуры плавления и термодеструкции) по кривой ДТА (ДСК) и ТГ используется прибор для комплексного термического анализа –
STA 449 Jupiter фирмы NETZSCH (Германия) (рис. 6.20).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
326 |
