
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
 Цель раздела
Цель раздела
•освоение методов современной аналитической и молекулярной диагностики; изучение возможностей и ограничений каждого метода, соблюдение технологических требований к условиям проведения анализа.
 Задачи раздела
Задачи раздела
•ознакомление с технологическими требованиями к условиям проведения анализа биологических образцов;
•обучение технике экстракции генетического материала из биологических образцов;
•обучение технике постановки полимеразной цепной реакции;
•освоение метода анализа продуктов ПЦР с помощью гельэлектрофореза;
•обучение технике постановки иммуноанализа (на примере
ELIZA);
•освоение колориметрического и биолюминесцентного вариантов иммуноферментного анализа.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
436 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
Подраздел10.1. СОВРЕМЕННЫЕКЛИНИЧЕСКИЕМЕТОДЫЛАБОРАТОРНОЙ ДИАГНОСТИКИ
 Краткие теоретические сведения. Методы клинической молекулярной диагностики
Краткие теоретические сведения. Методы клинической молекулярной диагностики
Развитие и достижения геномики человека обеспечили новые возможности для развития целого ряда других научных направлений. К настоящему времени в мире идентифицировано множество генов, ответственных за болезни человека, в том числе болезнь Альцгеймера, болезнь Гоше, атаксию, муковисцидоз, мышечную дистрофию Дюшенна, дистонию, гемофилию А и В, фенилкетонурию, серпо- видно-клеточную анемию, талассемию, синдром хрупкости Х-хромосомы, наследуемый рак молочных желез и яичников и др. Структуры этих генов расшифрованы и сами они клонированы. Это позволяет проводить эффективную раннюю и даже пренатальную диагностику и лечение. Тестирование будущих родителей на высокий риск генетического заболевания теперь может проводиться для постоянно растущего числа генов. При этом типичным подход базируется на исследованиях с использованием гибридизации или ПЦР-анализа. Можно протестировать здорового человека из семьи, где встречался, например, кистозный фиброз, и определить, есть ли у него копия дефектного гена или нет. Если неблагополучного сочетания генов избежать не удалось и оба потенциальных родителя являются носителями рецессивного дефекта, они должны сами решать, рисковать ли им, чтобы иметь детей. В любом случае раннее начало профилактического лечения ребенка позволит предотвратить или отодвинуть заболевание. Сегодня в практику медикогенетического консультирования введены десятки систем для генодиагностики наиболее распространенных наследственных заболеваний. Установленная последовательность генома поможет идентифицировать новые гены и выявить среди них те, что обусловливают предрасположенность к тем или иным заболеваниям.
Успехи современной медицины в огромной мере зависят от того, удастся ли вовремя обнаружить специфические инфекционные агенты (вирусы, бактерии, паразитические микроорганизмы) или изменения в содержании важных биологически активных белков или низкомолекулярных соединений в организме. Стоит ли говорить, что профилактику и лечение любого заболевания существенно облегчает ранняя и точная диагностика. Современные методы молекулярной диагностики обладают высокой специфичностью и чувствительностью и при этом являются достаточно продуктивными, эффективными и недорогими для рутинного применения.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
437 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА10.1. БИОЛЮМИНЕСЦЕНТНЫЙТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙАНАЛИЗ
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с процедурой проведения твердофазного иммуноферментного анализа, демонстрация использования в качестве метки генетически слитого бифункционального химерного белка, обладающего биолюминесцентной активностью Са2+- активируемого фотопротеина обелина и иммуноглобулинсвязывающей способностью белка А из Staphylococcus aureus;
•знакомство с построением и процедурой твердофазного иммуноферментного анализа, получение экспериментальных навыков для проведения аналитического исследования на базе взаимодействия антиген-антитело.
 Краткие теоретические сведения
Краткие теоретические сведения
Анализ биологических образцов, построенный на базе взаимодействия антиген-антитело, называется иммуноанализом. На сегодня иммуноаналитические системы наиболее широко распространены в качестве диагностического инструмента. Одной из разновидностью иммуноанализа является так называемая ELIZA – система, названная по первым буквам английского обо-
значения: enzyme-linked immunosorbent assay (фермент-связанный твердо-
фазный иммуноанализ). Специфичность этого анализа обусловлена высокой аффинностью взаимодействия антиген-антитело. Наличие этого взаимодействия определяют с помощью фермента, который присоединяется к иммуноглобулину. При добавлении к этому комплексу субстрата данного фермента развивается реакция, продукт которой обладает определенной визуальной характеристикой, например окраской или свечением. По количеству продукта (интенсивности окраски или свечения) судят о количестве антигена.
На рис. 10.1 показаны последовательность операций проводимых при иммуноферментном анализе: на поверхности иммунологической лунки иммобилизуется искомый антиген и другие белки (Шаг 1), затем вносится раствор первичного антитела к данному антигену (Шаг 2), после инкубирования и промывок вносится вторичное антитело, помеченное ферментом (Шаг 3), после инкубирования и промывок в лунки вносят субстрат фермента, который при взаимодействии с ферментом дает окрашенный продукт (Шаг 4).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
438 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.1. БИОЛЮМИНЕСЦЕНТНЫЙ ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
Окрашивание раствора происходит только в тех лунках, куда вносили образцы, содержащие искомый антиген (рис. 10.1–10.2).
Рис. 10.1. Последовательность операций при проведении ELIZA
Рис. 10.2. Так выглядит результат ELIZA
Современный рынок предлагает иммунодиагностикумы для определения чрезвычайно широкого спектра молекул – от инфекционных агентов до токсинов, гормонов и т. п.
 Материалы и оборудование
Материалы и оборудование
Для задачи 10.1.1:
1.0,1 М фосфатный буфер, содержащий 0,9 % NaCl (PBS).
2.1 %-й раствор бычьего сывороточного альбумина (БСА) в PBS.
3.Растворы иммуноглобулинов классаG кролика, мыши и человека
(RIgG, MIgG, HIgG), в PBS, 10 мкг/мл.
4.Раствор для помывки планшетов (PBS, содержащий 0, 05 % Tween-20 и 5мМ ЭДТА).
5.Непрозрачные планшеты для иммунологического микроанализа.
6.Раствор химерного белка с активностью 500 мV/мл.
7.Микропланшетный люминометр Luminoscan v1.30.
8.Набор автоматических пипеток и наконечники к ним.
Для задачи 10.1.2:
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
439 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.1. БИОЛЮМИНЕСЦЕНТНЫЙ ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
1.Набор реагентов для проведения анализа ELIZA Immuno Explorer Kit № 166-2400EDU (BioRad), включающий:
•образец антигена («положительный контроль»);
•образец первичных антител (ПА);
•образец вторичных антител, меченых пероксидазой хрена (HRP) (ВА);
•раствор субстрата пероксидазы (тетраметилбензидина, TMB);
•10-ти кратный раствор фосфатного буфера и NaCl (PBS);
•10 %-й раствор Tween 20.
2.Набор пластиковой посуды: пробирки Eppendorf (1,5 мл), наконечники для набора растворов, резервуары для промывочных растворов.
3.Комплект автоматических пипеток, штативы.
4.Иммунологические планшеты стандартного или стрипового типа (12луночные).
5.Бумажные полотенца.
6.Микропланшетный денситометр Model 680 (BioRad).
 Характеристики оборудования
Характеристики оборудования
 Микропланшетныйлюминометр
Микропланшетныйлюминометр
Микропланшетный люминометр Luminoscan v1.30 (ThermoElectron, Финляндия). Прибор предназначен для измерения люминесцентного сигнала от растворов в лунках микропланшет для иммуноферментного анализа (рис. 10.3).
Технические характеристики
Диапазон измерений 270-670 нм.
Люминометрический диапазон до 5000 относительных световых еди-
ниц.
Чувствительность 1 фмол АТФ.
Люминометрический динамический диапазон 9 порядков.
Прибор оснащен орбитальным шейкером, что позволяет проводить инкубирование планшет при перешивании, скорость вращения 60-1200 rpm, диаметр 50 мм.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
440 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.1. БИОЛЮМИНЕСЦЕНТНЫЙ ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
Рис. 10.3. Внешний вид микропланшетного люминометра Luminoscan v1.30 (ThermoElectron, Финляндия)
Прибор позволяет производить измерения при термостатировании в температурном режиме от 25 до 37 ºС. Оснащен системой впрыска реагентов
– диспенсером с объемом от 1 до 1000 мкл, с разрешением 1 мкл.
Имеется возможность производить измерения как в стандартном 96луночном микропланшете, так и других, от 6 до 384-луночных планшетах.
Для коммуникации через PC прибор укомплектован соответствующим программным обеспечением.
Наличие шейкера – орбитальный, скорость 60-1200 rpm. Температурный режим 25-37 ºС.
Наличие диспенсера – 1, 1-1000 мкл, с разрешением 1 мкл.
 Микропланшетныйденситометр
Микропланшетныйденситометр
Микропланшетный денситометр Model 680 («BioRad», США) (рис. 10.4). Прибор предназначен для измерения оптической плотности растворов в лунках микропланшет для иммуноферментного анализа.
Технические характеристики
Диапазон измерений 400-750 нм. Фотометрический диапазон 0,000-3,5 ОД.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
441 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.1. БИОЛЮМИНЕСЦЕНТНЫЙ ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
Линейность ± 1 % в диапазоне 0,000-2,000; ± 2 % в диапазоне 2,000-
3,000.
Погрешность ± 1% или 0,01 ОД в диапазоне 0,000-3,000 на 490 нм.
Рис. 10.4. Внешний вид микропланшетного денситометра Model 680
(«BioRad», США)
К прибору прилагаются 8 оптических фильтров.
Время считывания 6 с на одной длине волны, 10 с на двух длинах волн. Прибор оснащен жидкокристаллическим дисплеем, имеются опции встроенного хранения стандартных кривых и графиков и интерфейс к друго-
му принтеру.
Результаты измерений выдаются с помощью встроенного принтера на термической ленте.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 10.1.1.Принцип твердофазного иммуноферментного анализа
Порядок выполнения работы
1. В лунки с координатами А2 -F12 (всего 66 лунок) планшета для имм у- ноферментного анализа внести по 100 мкл PBS.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
442 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.1. БИОЛЮМИНЕСЦЕНТНЫЙ ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
2.В лунки А1,В1 внести по 200 мкл раствора иммуноглобулинов кролика; в лунки С1,D1 внести по 200 мкл раствора иммуноглобулинов мыши; в лунки E1, F1 внести по 200 мкл раствора иммуноглобулинов человека (концентрации растворов иммуноглобулинов – 5 мкг/мл).
3.В каждом ряду раститровать растворы иммуноглобулинов с шагом 2. Последние две лунки каждого ряда оставить с PBS для контроля.
4.Для эффективной сорбции планшет выдержать при 37 оС в течение часа, либо при 4оС в течение ночи.
5.Удалить содержимое лунок и промыть их раствором для промывки трижды.
6. В каждую лунку внести по 120 мкл раствора БСА и проинкубировать планшет при 37 оС в течение 1 ч.
7.Промыть планшет, как описано в п.5.
8.В каждую лунку внести по 100 мкл раствора химерного белка и пр о- инкубировать планшет при комнатной температуре в течение 1 ч.
9.Промыть планшет, как описано в п.5.
10.Провести измерения биолюминесценции сорбированного химерного белка с помощью микропланшетного люминометра Luminoscan v1.30.
11.Построить зависимость люминесцентного сигнала от концентрации каждого из иммуноглобулинов, усредняя соответствующие сигналы и вычитая сигнал в контрольной лунке.
Задание 10.1.2. Определение модельной эпидемической вспышки с помощьюELIZA
В рамках данного здания предлагается провести иммуноанализ на присутствие модельного антигена в данных биологических образцах с помощью ELIZA. Образцам будут присвоены имена, и часть из них будет смешана с другими. Таким образом будет смоделировано распространение модельной контактной инфекции среди близкой группы людей. Это распространение должно быть обнаружено по результатам проведенного анализа ELIZA. Репортерным ферментом, используемым в работе, является пероксидаза хрена.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
443 |
РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.1. БИОЛЮМИНЕСЦЕНТНЫЙ ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
Порядок выполнения работы
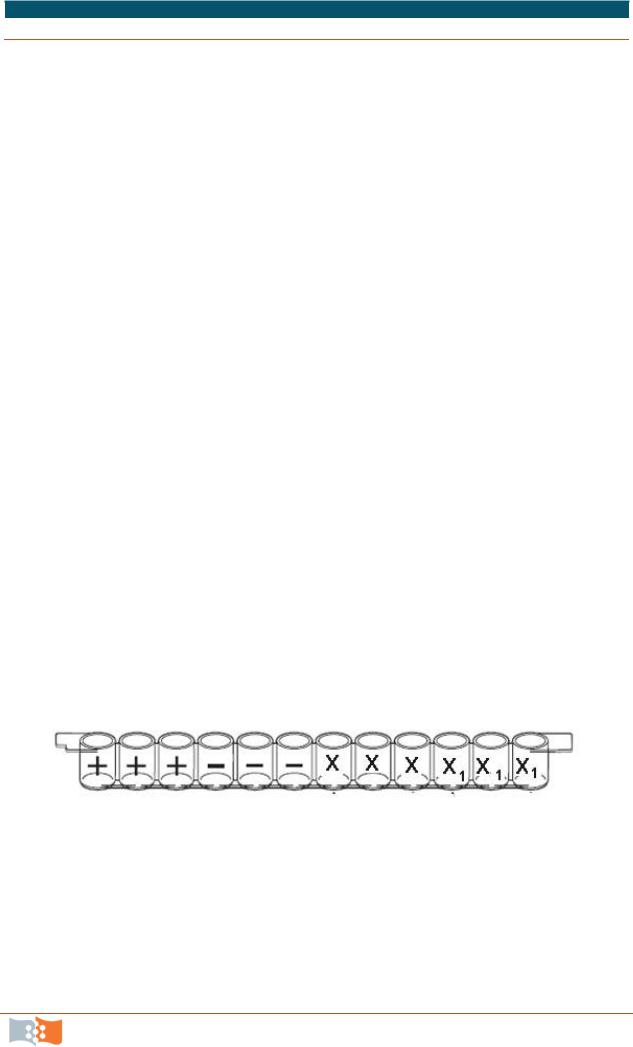
1.Каждый студент получает образец «своей биологической жидкости» (таблица 10.1).
2.Часть студентов по указанию преподавателя смешивают свой Х образец с другим студентом – получается образец Х1.
Образцы хранить при 4 °С.
Таблица 10.1
Образцы для проведения анализа ELIZA Immuno Explorer Kit № 1662400EDU (BioRad)
Пробирка |
Описание |
Обозначение |
Содержание, мл |
|
|
|
|
Фиолетовая |
Положительный кон- |
+ |
0,5 |
|
толь |
|
|
|
|
|
|
Синяя |
Отрицательный кон- |
_ |
0,5 |
|
троль |
|
|
|
|
|
|
Зеленая |
Первичные антитела |
ПА |
1,5 |
|
|
|
|
Оранжевая |
Вторичные антитела |
ВА |
1,5 |
|
|
|
|
Коричневая |
Субстрат для HRP |
Суб |
1,5 |
|
|
|
|
Желтая |
«Инфицированный» |
Х |
0,75 |
|
субъект |
|
|
|
|
|
|
«Желтая» |
Не «инфицирован- |
Х |
0,75 |
|
ный» субъект |
|
|
|
|
|
|
3. Подписать лунки стрипа, как показано на рис. 10.5.
Рис. 10.5. Схема маркировки лунок
4.В каждую лунку внести по 50 мкл соответствующего раствора. (Использовать только свежие носики!)
5.Инкубировать 5 мин при комнатной температуре, затем промыть
трижды.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
444 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.1. БИОЛЮМИНЕСЦЕНТНЫЙ ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
6.Свежими носиками внести в каждую лунку по 50 мкл раствора ПА и нкубировать 5 мин при комнатной температуре.
7.Промыть трижды.
8.Свежими носиками внести в каждую лунку по 50 мкл раствора ВА и нкубировать 5 мин при комнатной температуре.
9.Промыть трижды.
10.Свежими носиками внести в каждую лунку по 50 мкл раствора ВА и нкубировать 5 мин при комнатной температуре.
11.Наблюдать полученный результат и, заполнив таблицу 10.2, проследить распространение условной инфекции при контактах внутри замкнутой популяции.
|
|
Таблица 10.2 |
|
|
Результаты работы |
|
|
|
|
|
|
Имя студента |
Полученный |
Наличие контактов |
|
образец (+) или (-) |
|||
|
|
||
|
|
|
|
|
|
|
|
|
|
|
 Контрольные вопросы
Контрольные вопросы
Для задачи 10.1.1:
1.На чем основан иммуноферментный анализ?
2.За счет чего происходит сорбция иммуноглобулинов? Как еще можно проводить первичную сорбцию?
3.Для чего проводится обработка поверхности лунок раствором БСА
(п.6)?
4.За счет чего происходит сорбция химерного белка? Обоснуйте ответ.
5.Как меняется величина биолюминесцентного ответа от происхождения иммуноглобулинов? За счет чего?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
445 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.1. БИОЛЮМИНЕСЦЕНТНЫЙ ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
Для задачи 10.1.2:
1.Как иммунная система защищает организм от инфекций?
2.Почему при пересадке органов необходимо принимать иммуносупрессанты?
3.Для чего служит ELIZA?
4.Почему и как работают репортерные ферменты?
5.Зачем необходимы «положительный» и «отрицательный» контроли?
6.Зачем проводят тщательные промывки лунок после каждой стадии?
7.Если получен негативный ответ по результатам иммуноанализа, означает ли это на 100 %-е отсутствие заболевания?
8.Какой иммунотест можно купить в любой аптеке?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
446 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА10.2. ИДЕНТИФИКАЦИЯИНДИВИДУУМАСПОМОЩЬЮ ГЕНОТИПИРОВАНИЯ
 Цель лабораторной работы
Цель лабораторной работы
•знакомство с постановкой процедуры генотипирования на основе вариабельности длины участков коротких тандемных повторов – STR, овладение навыками постановки и проведения полимеразной цепной реакции (ПЦР) и анализа продуктов ПЦР с помощью гель-электрофореза.
 Краткие теоретические сведения
Краткие теоретические сведения
На сегодня наиболее надежным методом идентификации человека является метод отпечатки ДНК (DNA profil) – молекулярно-биологических метод, определяющий генотип данного образца ДНК и однозначно устанавливающий его принадлежность (или её отсутствие) данному индивидууму. Этот подход используется в судебной экспертизе, при поиске людей, массовых катастрофах, установление родителей и пр. Какого типа ДНК последовательности можно использовать для этих целей? Известно, что ДНК человека содержит 3 млрд п.о., 99,5 % из которых являются общими для всех людей. Оставшиеся 0,5 % содержат различия, и именно эти полиморфные участки пригодны для идентификации (генотипирования), в том числе в судебной экспертизе. По всеобщему соглашению используют некодирующие последовательности ДНК, расположенные в разных участках хромосом (локусы). Для судебной экспертизы применяют некодирующие последовательности ДНК, содержащие так называемые участки коротких тандемных повторов – STR, от английского словосочетания short tandem repeats. STR представляют собой короткие последовательности ДНК (2, 3, 4, иногда 6, 8 нуклеотидов), которые многократно повторяются в 5’→3’ направлении. На рис. 10.6 показан локус, известный как ТН01, реально использующийся для генотипирования. Его ДНК содержит четыре повтора [ТСАТ].
Рис. 10.6. Нуклеотидная последовательность ТН01 локуса
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
447 |
РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.2. ИДЕНТИФИКАЦИЯ ИНДИВИДУУМА С ПОМОЩЬЮ ГЕНОТИПИРОВАНИЯ
Для этого ТН01 STR локуса существуют более 20 альтернативных форм (аллелей), найденных у людей по всему миру, которые различаются количеством повторов [ТСАТ]. Однако у каждого человека имеется только 2 аллеля
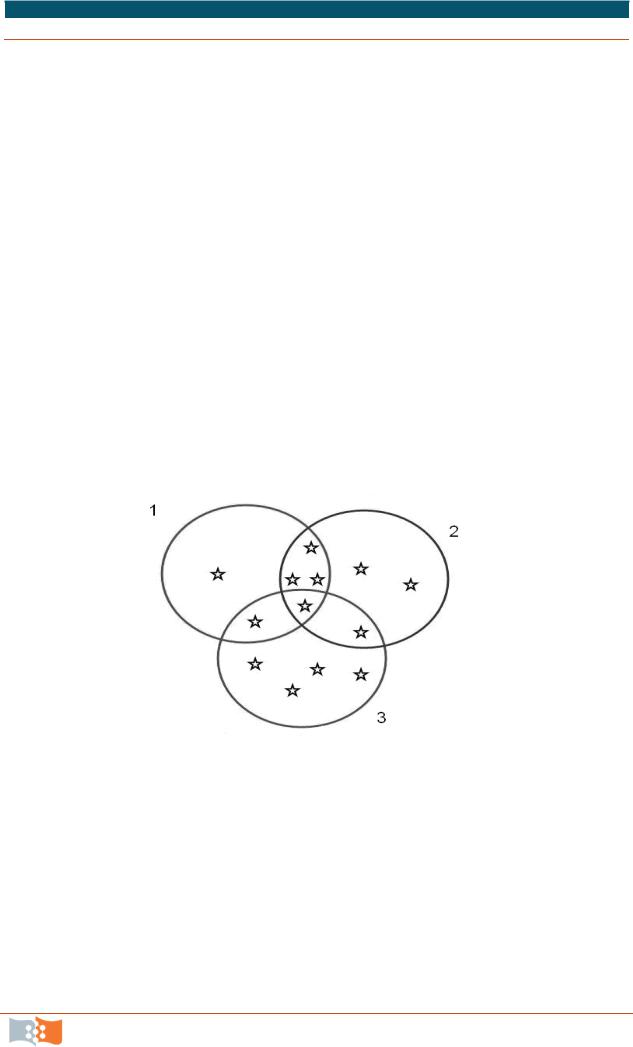
– один унаследован от отца, другой от матери. Для получения ДНК-отпечатка исследуемый образец ДНК амплифицируют с помощью ПЦР, с использованием специфических праймеров, последовательность которых комплементарна последовательностям с обеих сторон локусов, и получают миллионы копий двух оригинальных аллелей. Эти копии содержат то же самое число STR повторов, что и исходный образец ДНК, и разделяются по размеру с помощью гель-электрофореза. Полученный набор полос является индивидуальной характеристикой индивидуума. Для дискриминации (исключения персоны из числа подозреваемых, например) одного локуса недостаточно. Он может определить разницу между 1000 людьми, два локуса – между 10000, в обычной практике пользуются результатами генотипирования по 3-5 локусам. На рис. 10.7 показано как, используя генотипирование сразу по трем локусам (TH01 gt6-3, D3S1358 gt16-17 и FGA gt21-23), из 13 возможных лиц (обозначены звездочками), можно идентифицировать только одно.
Рис. 10.7. Увеличение количества локусов использованных при генотипировании повышает вероятность идентификации индивидуума: 1 – TH01 генотип 6-3; 2 – D3S135 8 генотип 16-17; 3 – FG генотип 21-23
В настоящее время существует несколько баз данных по ДНКтипированию Одной из наиболее обширных является база данных американского федерального бюро расследований (организована в 1998 г.), в которой собраны данные о проходящих по криминальным делам и осужден-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
448 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.2. ИДЕНТИФИКАЦИЯ ИНДИВИДУУМА С ПОМОЩЬЮ ГЕНОТИПИРОВАНИЯ
ных лиц, база CODIS (COmbined DNA Index System). В ней хранятся данные,
полученные по генотипированию с использованием 13 локусов.
В рамках работы планируется следующая последовательность операций: 1) проведение ПЦР предложенных образцов ДНК (один из них принадлежит неизвестному Х и получен с условного места пре ступления, остальные принадлежат условным подозреваемым лицам А-Г) с определенными парами праймеров; 2) разделение полученных ДНК по молекулярной массе с помощью гель-электрофореза; 3) определение размеров полученных ДНК с помощью набора стандартных ДНК и сопоставление состава ДНК-фрагментов в полученных образцах для идентификации неизвестной ДНК.
 Материалы и оборудование
Материалы и оборудование
1.Набор реагентов для проведения анализа Crime Scene Investigator PCR Basics™ Kit Catalog #166-2600EDU (BioRad), включающий:
•5 образцов ДНК;
•смесь для проведения ПЦР – Master mix;
•набор праймеров для генотипирования по локусу BXP007;
•набор маркерных аллельных ДНК;
•краситель для гелей Orange G.
2.Набор пластиковой посуды: пробирки Eppendorf (1,5 мл), пробирки для ПЦР, наконечники для набора растворов, наконечники с фильтрами.
3.Комплект автоматических пипеток, штативы.
4.Водяная баня.
5.Микроцентрифуга модель 5417R (Eppendorf, США).
6.Термоциклер MJ MiniCycler (Био-Рад, США).
7.Реактивы и оборудование для проведения гель-электрофореза: горизонтальная камера с подносом для заливки геля и гребенки, генератор постоянного тока, агароза, ТАЕ-буфер.
8.Персональный термоциклер MJ MiniCycler (Био-Рад, США)
9.Центрифуга модель 5417R (Eppendorf, США)
10.Комплект, состоящий из: горизонтальной камеры с подносом для заливки геля Mini-Sub cell GT (Bio Rad, США) и гребенки, генератора постоянного тока PowerPac (Bio Rad, США).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
449 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.2. ИДЕНТИФИКАЦИЯ ИНДИВИДУУМА С ПОМОЩЬЮ ГЕНОТИПИРОВАНИЯ
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 10.2.1.Постановка и проведение ПЦР с данными образцами ДНК
Внимание! Работы с генетическим материалом и при постановке ПЦР требуют специальных условий:
1.Все работы проводятся в перчатках, спецодежде (лабораторные халаты) и очках.
2.В лаборатории нельзя есть, пить, курить, наносить косметику.
3.До и после проведения работ необходимо тщательно вымыть руки.
4.Обо всех нестандартных ситуациях необходимо немедленно уведомить преподавателя.
Порядок выполнения работы
1.Подписать 5 пробирок для ПЦР: Х, А, Б, В, Г.
2.Внести в пробирки ДНК и смесь Master mix + прамеры по следующей табл. 10.3, при этом каждый забор производить свежим носиком с фильтром
исразу закрывать пробирки.
|
|
Таблица 10.3 |
|
|
|
Обозначение |
ДНК-матрица |
Master mix + прамеры |
|
|
|
Х + имя студента |
20 мкл, Х-ДНК |
20 мкл |
|
|
|
А + имя студента |
20 мкл, А-ДНК |
20 мкл |
|
|
|
Б + имя студента |
20 мкл, Б-ДНК |
20 мкл |
|
|
|
В + имя студента |
20 мкл, В-ДНК |
20 мкл |
|
|
|
Г + имя студента |
20 мкл, Г-ДНК |
20 мкл |
|
|
|
3. Поместить пробирки в термоциклер и включить прибор по заданной программе (табл. 10.4).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
450 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.2. ИДЕНТИФИКАЦИЯ ИНДИВИДУУМА С ПОМОЩЬЮ ГЕНОТИПИРОВАНИЯ
|
|
|
Таблица 10.4 |
||
|
|
|
|
|
|
Шаг |
Функция |
Температура |
Длительность |
Число |
|
циклов |
|||||
|
|
|
|
||
|
|
|
|
|
|
Начальная |
Денатурация |
94 °С |
2 мин |
1 |
|
денатурация |
|||||
|
|
|
|
||
|
Денатурация |
94 °С |
30 с |
35 |
|
|
|
|
|
||
Амплификация |
Отжиг |
52 °С |
30 с |
||
|
|||||
|
|
|
|
|
|
|
Удлинение |
72 °С |
1 мин |
|
|
|
|
|
|
|
|
Финальное |
Удлинение |
72 °С |
10 мин |
|
|
удлинение |
|
||||
|
|
|
|
||
Хранение* |
Хранение |
4 °С |
неопределенное |
1 |
|
Задание 10.2.2.Анализ продуктов ПЦР спомощью гель- электрофореза
Порядок выполнения работы
1. Приготовить аппарат для гель-электрофореза по инструкции к при-
бору.
2.Пробирки после ПЦР отцентрифугировать (пульс-режим).
3.В каждую пробирку внести по 10 мкл раствора красителя Orange G, пользуясь каждый раз свежим носиком и тщательно перемешивая.
4.В лунки геля поместить по 20 мкл образцов в следующем порядке
(табл. 10.5).
5.Провести электрофорез на агарозном геле в течение 30 мин при напряжении 100 V.
6.Окрасить гель и проанализировать полученные результаты.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
451 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.2. ИДЕНТИФИКАЦИЯ ИНДИВИДУУМА С ПОМОЩЬЮ ГЕНОТИПИРОВАНИЯ
Таблица 10.5
№ лунки |
Образец |
|
|
1 |
Набор стандартов мол. массы |
|
|
2 |
Х |
|
|
3 |
А |
|
|
4 |
Б |
|
|
5 |
В |
|
|
6 |
Г |
|
|
 Контрольные вопросы
Контрольные вопросы
1.Какие образцы пригодны для проведения ДНК анализа?
2.Зачем мы использовали ПЦР?
3.Какая разница между аллелем и локусом?
4.Почему для ДНК-типирования (в частности, в судебной экспертизе) используют ДНК некодирующих участков генома?
5.Что такое Master mix и для чего нужен каждый из её компонентов?
6.Какие стадии включает ПЦР и что происходит на каждой из них?
7.Как происходит визуализация материала после проведения гельэлектрофореза?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
452 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА10.3. ВЫЯВЛЕНИЕМУТАЦИЙ(ПОЛИМОРФИЗМОВ) ВГЕНОМЕ ЧЕЛОВЕКАСИСПОЛЬЗОВАНИЕМКОМПЛЕКТАРЕАГЕНТОВ«SNP-ЭКСПРЕСС» ФИРМЫЛИТЕХ
 Задачи лабораторной работы
Задачи лабораторной работы
•выделение ДНК из лейкоцитов цельной крови с помощью реагента «ДНК-экспресс-кровь»;
•проведение ПЦР с использованием комплекта реагентов для амплификации «SNP-экспресс»;
•детекция продуктов амплификации;
•разделение продуктов амплификации методом горизонтального электрофореза в агарозном геле;
•анализ результатов.
 Краткие теоретические сведения
Краткие теоретические сведения
Выявление генных (хромосомных) мутаций имеет целью решение ряда взаимосвязанных клинических и фундаментальных задач.
Во-первых, оно позволяет устанавливать достоверный диагноз наследственного заболевания непосредственно на молекулярном уровне, устраняя любой элемент субъективности в оценке конкретного клинического синдрома. Важно отметить, что диагностика на основе методов ДНК-анализа может осуществляться не только в развернутой стадии болезни, но и на пресимптоматической стадии носительства мутантного гена, что в ряде случаев может способствовать своевременному началу превентивной терапии и решению ключевых вопросов планирования семьи, образа жизни, профессиональной ориентации и т. д.
Во-вторых, установление генетического дефекта в консультируемой семье дает ключ к активной профилактике повторных случаев болезни на основе современных протоколов пренатальной и преимплантационной ДНКдиагностики, позволяющих достоверно прогнозировать «генетический исход» конкретной беременности (т.е. генетический статус эмбриона).
В-третьих, идентификация мутаций в конкретных генах лежит в основе построения наиболее совершенной геномной (генетической) классификации наследственной патологии, значимость которой становится особенно очевидной с учетом выраженной генетической гетерогенности основных групп наследственных заболеваний человека. Наконец, точный ДНК-диагноз явля-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
453 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
ется необходимым условием для разработки подходов к коррекции имеющегося у больного молекулярного дефекта на основе интенсивно развивающихся методов генной инженерии.
Развитие методов генодиагностики неразрывно связано с впечатляющим прогрессом последних лет в области молекулярной биологии и генетики, триумфально увенчавшимся в начале XXI в. идентификацией генома человека. В настоящее время мутантные гены выделены или, по крайней мере, картированы на хромосомах для большинства из 5000 известных нозологических форм наследственных болезней, что делает знание общих принципов генодиагностики абсолютно необходимым не только для врачей-генетиков, но и для специалистов многих других областей клинической медицины – неврологов, психиатров, кардиологов, офтальмологов, дерматологов и др.
Более того, ряд базовых методов ДНК-анализа, таких как полимеразная цепная реакция, блот-гибридизация или рестрикционный анализ, все шире входит в практику различных областей биомедицинской науки, не связанных с наследственными болезнями судебной медицины (идентификация личности на основе геномной дактилоскопии), инфекционной патологии (диагностика инфекций на основе идентификации специфических генных последовательностей микроорганизмов в биологическом материале), клинической фармакологии (изучение механизмов чувствительности к действию лекарственных препаратов на основе анализа индивидуальных особенностей генома конкретного индивида) и т. д. Все это знаменует собой наступление новой эпохи, весьма удачно определяемой термином молекулярная медицина и в значительной степени базирующейся на современных ДНКтехнологиях.
 Материалы и оборудование
Материалы и оборудование
Для задачи 10.3.1
1.Термостат для микропробирок типа Эппендорф, поддерживающий температуру до 99 ºС.
2.Высокоскоростная центрифуга для пробирок 1,5 мл 8–12 тыс. об/мин
3.Микроцетрифуга-вортекс 1,5–3 тыс. об/мин.
4.Пипетка-дозатор переменного объема 100-1000 мкл.
5.Одноразовые полипропиленовые пробирки типа Эппендорф 1,5 мл с замком.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
454 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
6.Одноразовые наконечники до 1000 мкл.
7.Одноразовые наконечники с фильтром (аэрозольным барьером) до 1000 мкл.
8.Штатив для хранения пробирок 1,5 мл.
9.Штатив для пробирок 1,5 мл «рабочее место».
10.Одноразовые перчатки.
11.Холодильник с морозильной камерой.
12.Емкость для сброса использованных наконечников.
13.Емкость с дез. раствором для удаления плазмы крови.
14.Реагент для выделения ДНК из биопроб «ДНК-экспресс-кровь» (универсален для всех полиморфизмов).
15.Венозная кровь с раствором антикоагулянта (0,05М раствор ЭДТА или 4% раствор цитрата натрия). Гепарин использовать не
рекомендуется.
Внимание! При использовании для забора крови вакуумных пробирок с ЭДТА или цитратом натрия дополнительное внесение антикоагулянта не требуется. Неохлажденные пробы использовать в течение 2-х часов для выделения ДНК; хранить при 4-8 ºС – не более 1 сут; не замораживать!
Для задачи 10.3.2
1.ПЦР-бокс с УФ-лампой.
2.Программируемый термостат (амплификатор) с активным типом регулирования.
3.Микроцентрифуга-вортекс 1,5–3 тыс. об/мин.
4.Пипетка-дозатор переменного объема 5 – 50 мкл.
5.Пипетки-дозаторы переменного объема (0,5–10; 5–50; 20–200; 100–1000 мкл).
6.Одноразовые полипропиленовые микропробирки 0,5 мл (или 0,2 мл).
7.Одноразовые наконечники до 200 мкл и до 1000 мкл.
8.Одноразовые наконечники с фильтром (аэрозольным барьером) до 100 или до 200 мкл.
9.Штатив для пробирок 0,5 мл (или 0,2 мл) «рабочее место».
10.Штативы для наконечников 200 мкл.
11.Одноразовые перчатки.
12.Емкость для сброса использованных наконечников.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
455 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
13.Холодильник с морозильной камерой для хранения исходных реагентов.
14.Комплект реагентов для проведения ПЦР (индивидуален для каждого полиморфизма).
Для задачи 10.3.3
1.Камера для горизонтального электрофореза.
2.Источник постоянного тока с напряжением не менее 150 В.
3.УФ-трансиллюминатор.
4.СВЧ-печь для плавления агарозы.
5.Технические весы.
6.Аквадистиллятор.
7.Система видеодокументирования гелей «Molecular Imager Gel Doc XR» производства «Bio-Rad» (США) с трансиллюминатором.
8.Пипетка-дозатор переменного объема 5 – 50 мкл для нанесения образцов на гель.
9.Пипетка-дозатор переменного объема 100-1000 мкл.
10.Одноразовые наконечники до 200 мкл.
11.Одноразовые наконечники до 1000 мкл.
12.Штатив для пробирок 0,5 мл (или 0,2 мл) «рабочее место».
13.Агароза, раствор бромистого этидия, 50хТАЕ буфер для приготовления геля и проведения электрофореза (или готовый комплект реагентов для электрофоретической детекции).
14.Планшет для заливки геля, гребенки, зажимы типа «бульдог».
15.Пластиковая емкость большого объема для дезактивации буфера и гелей.
 Характеристики оборудования
Характеристики оборудования
Для выполнения работы используется стандартное оборудование для молекулярно-генетических исследований (см. разделы 1 и 2) и амплификаторы (рис. 10.8–10.9). Амплификация нуклеиновых кислот и их детекция – одни из наиболее ценных современных методов, используемых в биологических исследованиях. Детекция продуктов полимеразной цепной реакции (ПЦР) в режиме реального времени стала возможной благодаря введению в
реакцию флуоресцирующих реактивов, сообщающих об увеличении количества дезоксирибонуклеиновой кислоты (ДНК) пропорциональным увеличением флуоресцентного сигнала. К флуоресцирующим веществам, используемым для этой цели, относятся красители, связывающие ДНК, и флуоресцентно меченные праймеры или зонды.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
456 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
Детекция ПЦР-продуктов в режиме реального времени обеспечивает точное и высокочувствительное определение исходного числа копий нуклеиновой кислоты в пределах всего динамического диапазона. Для измерения уровня флуоресцентного сигнала во время амплификации используются специальные термоциклеры, снабженные модулями для детекции флуоресценции. Система iQTM5 для мультиканальной детекции ПЦР-продуктов в режиме реального времени основана на достоинствах термоциклера iCycler®, который обеспечивает оптимальную амплификацию.
 Амплификатор«Терцик»
Амплификатор«Терцик»
Амплификатор «Терцик» (рис. 10.8) – модель со встроенным микропроцессором и жидкокристаллическим дисплеем, возможно подключение к компьютеру. Программирование и управление прибором происходит непосредственно с панели прибора. Нагрев и охлаждение матриц реализуются с помощью элементов Пельтье.
Рис. 10.8. Амплификатор «Терцик»
Прибор выполнен в виде единого модуля, объединяющего четыре независимо управляемых термоблока.
Формат: 4-го блока по 10 пробирок с объемом по 0,5 мл.
Матрицы, термоблоков симметричны и пробирки в них располагаются по кругу, что обеспечивает одинаковые температурные условия.
Отсутствие движущихся частей делает работу прибора бесшумной. Отвод тепла обеспечивает металлический корпус амплификатора. Каждый термоблок имеет крышку с тарельчатой пружиной, создающей
надёжный тепловой контакт пробирки с матрицей.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
457 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
Каждый прибор снабжен индивидуальным выносным датчиком температуры.
Жидкокристаллический графический дисплей. Наличие собственного процессора. Независимое от компьютера программирование.
 Bio-Rad ДНК-амплификатор
Bio-Rad ДНК-амплификатор
Bio-Rad ДНК-амплификатор iCycler (iQ5) (рис. 10.9).
Рис. 10.9. Bio-Rad ДНК-амплификатор iCycler (iQ5)
Технические характеристики
Система iQ5 имеет широкополосный источник света (вольфрамгалогеновая лампа), позволяющий проявлять максимальную гибкость при выборе флуоресцирующих реактивов. При работе оптического модуля, основанного на системе фильтров, используются оптимальные длины волн возбуждающего и испускаемого света, что обеспечивает превосходную чувствительность и четкое различение сигналов от нескольких флуорофоров. CCDдетектор фиксирует картину сигналов от всех 96 ячеек одновременно. Это приводит к получению исчерпывающего набора данных, показывающего кинетическое изменение флуоресценции во время каждого цикла.
Одновременная фиксация изображения всех ячеек обеспечивает надежное сравнение данных отдельных ячеек. Система iQ5 в реальном време-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
458 |
