
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
ни отображает данные текущей полимеразной цепной реакции, обеспечивая немедленную обратную связь по ее завершении.
Источник возбуждения – галогеновая лампа. Детектор – ПЗС-матрица.
Количество каналов измерения флуоресценции – 5.
Длина волны возбуждения, нм – 475–495, 515–545, 530–560, 560–590, 615–645.
Длина волны флуоресценции, нм – 515–545, 565–585, 575–595, 610– 640, 670–700.
Исполнительное устройство термоблока – элемент Пельтье. Гомогенность температур не более, °С±0,4.
Абсолютная погрешность ±0,3 °С. Скорость нагрева/охлаждения – 3,3/2 °С/с.
Программируемая температура градиента 30 105 °С. Диапазон градиента 1 24 °С
Интерфейс – USB2.
ПО IQ5 для анализа результатов. Контекстное меню для упрощения по-
иска.
Габариты, ШхГхВ, мм – 290х580х390. Масса, кг – 17,6.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 10.3.1. Выделение ДНК из биопроб
Внимание!!! Необходимо строго соблюдать условия хранения и транспортировки реагентов.
Комплект «ДНК-экспресс-кровь» должен храниться при 2 – 8 ºС в теч е- ние всего срока годности (6 мес с даты производства). Допускается хранение и транспортировка этого комплекта при комнатной температуре не более 5сут.
Комплекты для проведения амплификации должны храниться при температуре минус 18-25 ºС в течение всего срока годности (6 месяцев с даты производства). Допускается хранение и транспортировка этого комплекта при температуре не выше 0 ºС не более 2,5 сут.
Для получения надежных результатов необходимо строгое соблюдение методики проведения исследования.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
459 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
Порядок выполнения работы
1.В пробирку типа «Эппендорф» с замком внести 1000 мкл цельной крови. Если кровь расслоилась в процессе хранения, то перед внесением ее необходимо перемешать до однородности.
2.Закрыть пробирку и центрифугировать со скоростью 3000 об/мин при комнатной температуре в течение 5 мин. После центрифугирования кровь разделится на плазму и форменные элементы. На поверхности осадка форменных элементов расположен тонкий слой лейкоцитов.
3.Аккуратно удалить пипеткой плазму, не захватив при этом лейкоци-
ты.
4.Закрыть пробирку и выдержать ее при минус 20ºС (в морозилке) до полного замораживания форменных элементов (в течение 1 ч.).
5.Полностью разморозить содержимое пробирки при комнатной температуре.
6.Внести в пробирку реактив «ДНК-экспресс-кровь». Его объем должен быть равен объему оставшихся в пробирке форменных элементов и плазмы (в примере объем остатка равен ~550 мкл, суммарный объем остатка и реактива составил, таким образом, 1100 мкл). Закрыть пробирку, защелкнуть замочек.
7.Содержимое пробирки в течение 10 сек. тщательно перемешать на встряхивателе (вортексе).
8.Установить пробирку в предварительно прогретый до 98ºC термостат
ивыдерживать течение 15 мин.
9.Установить пробирку в высокоскоростную микроцентрифугу замком в сторону оси. Центрифугировать со скоростью 8000-14000 об/мин при комнатной температуре в течение 15 с. Полученный таким образом супернатант использовать в качестве исследуемого образца ДНК
Задание 10.3.2.Проведение ПЦРс использованиемкомплекта реагентов для амплификации«SNP-экспресс»
Порядок выполнения работы Внимание!!!
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
460 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
При приготовлении рабочей амплификационной смеси необходимо все компоненты добавлять отдельными наконечниками с аэрозольными барьерами (фильтрами). Такие же наконечники необходимо использовать и для внесения в пробирки препарата ДНК. Недопустимо использование для приготовления смесей реактивов из комплектов других форматов. Разбавитель, Taq-полимераза и минеральное масло являются одинаковыми для всех комплектов формата «SNP-экспресс», но не могут использоваться для комплектов других форматов.
Рабочие смеси следует готовить непосредственно перед амплификацией. После внесения образца пробирки с амплификационными смесями должны быть как можно скорее помещены в амплификатор.
1.Приготовить и пронумеровать пробирки для проведения амплификации вместимостью 0,5 мл (или 0,2 мл) в соответствии с количеством анализируемых проб плюс отрицательный контроль. Для каждой пробы готовятся две пробирки (N (норма) и Р (патология)).
2.За 20-30 мин до приготовления рабочей амплификационной смеси извлечь комплект реагентов для ПЦР из морозильника, разморозить содержимое. Пробирки с реакционной смесью и полностью размороженным раствором разбавителя тщательно встряхнуть для перемешивания содержимого.
3.Из компонентов комплекта приготовить рабочие смеси реагентов для амплификации из расчета на одну пробу:
•17,5 мкл разбавителя;
•2,5 мкл реакционной смеси;
•0,2 мкл Taq-полимеразы.
Готовят две рабочие смеси: с реакционной смесью «НОРМА» и с реакционной смесью «ПАТОЛОГИЯ».
4.После добавления Taq-полимеразы, которое производится в последнюю очередь, необходимо тщательно перемешать смесь пипетированием.
5.Добавить по 20 мкл соответствующей рабочей амплификационной смеси во все соответствующие пробирки, подготовленные для амплификации.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
461 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
6.Добавить во все пробирки по одной капле (около 25 мкл) минерального масла.
7.Внести по 5 мкл образца из обработанной анализируемой пробы (см п. «Выделение ДНК») в пробирку с рабочей амплификационной смесью «норма» и в пробирку с рабочей амплификационной смесью «патология» под слой масла. В качестве отрицательного контрольного образца вносится разбавитель в объеме 5 мкл в оба типа реакционной смеси.
8.Пробирки закрыть и центрифугировать в течение 3–5 с при 1,5– 3000 об/мин при комнатной температуре (18–25 Сº) на микроцентрифуге - вортексе.
9. Перенести пробирки в прогретый до температуры +94ºС |
(устано- |
вившаяся температура в режиме Пауза) программируемый |
термостат |
(амплификатор) и провести амплификацию по следующей программе (табл. 10.6).
|
|
Таблица 10.6 |
|
|
|
T, Сº |
Время |
Циклов |
|
|
|
94º |
Pause |
|
|
|
|
93º |
1 мин |
1 |
|
|
|
93º |
10 сек |
|
|
|
35 |
64 |
10 сек |
|
|
|
|
72º |
20 сек |
|
|
|
|
72º |
1 мин |
1 |
|
|
|
10º |
Storage |
|
|
|
|
Задание 10.3.3. Детекция продуктов амплификации методом горизонтальногоэлектрофореза вагарозном геле
Порядок выполнения работы
1.Залить в аппарат для электрофореза ТАЕ-буфер, приготовленный на дистиллированной воде разбавлением 50хТАЕ в 50 раз (рН=8,3).
2.К 3,0 г агарозы добавить 2 мл 50х ТАЕ-буфера и 100 мл дистиллированной воды (3% гель)!!!
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
462 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
3.Приготовленную смесь расплавить на электрической плите или в СВЧ-печи. Добавить к 100 мл расплавленной агарозы 10 мкл 1 % -го раствора бромистого этидия. Перемешать.
4.Охладить расплавленную агарозу до температуры 50-60 ºС и залить в планшет для заливки геля. Для получения в агарозном геле карманов для нанесения образцов установить на планшет гребенку, используя зажим типа «бульдог».
Внимание! Толщина гребенки и толщина геля должны обеспечивать объем карманов не менее 20-25 мкл! После застывания агарозы осторожно вынуть гребенку из геля и перенести планшет с гелем в камеру для проведения электрофореза.
5.Нанести в карманы геля по 15 -20 мкл амплификата в последовательности, соответствующей нумерации проб.
6.Подключить электрофоретическую камеру к источнику питания и задать напряжение, соответствующее напряженности электрического поля 1015 В/См геля. Провести электрофоретическое разделение продуктов амплификации в направлении от катода (-) к аноду (+). Контроль за электрофоретическим разделением осуществляется визуально по движению полосы красителя. Полоса красителя должна пройти от старта 1,5-2 см (полосы ампликонов будут опережать полосу красителя, оптимальное время разгонки 15 мин).
7.Вынуть гель из формы и перенести его на стекло УФтрансиллюминатора.
ВНИМАНИЕ! С гелем агарозы следует работать в перчатках. Бромистый этидий является сильным мутагеном.
8. Включить трансиллюминатор и проанализировать результаты анализа (визуальную детекцию проводить только с защитным экраном, либо в очках, не пропускающих УФ-излучение). Фрагменты анализируемой ДНК проявляются в виде светящихся оранжево-красных полос при облучении УФизлучением с длиной волны 310 нм.
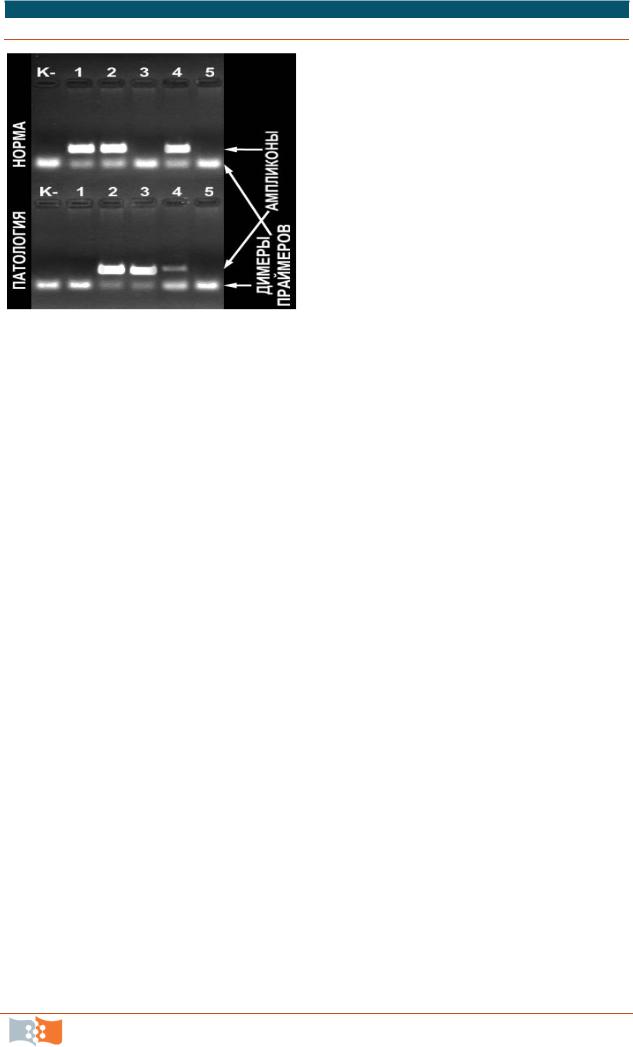
При интерпретации результатов важно помнить о невозможности появления в данных анализах слабоположительных проб.Все полосы на электрофорезе должны быть четкими и примерно одинаковой интенсивности (допускаются небольшие различия в яркости как между тестами на норму и патологию, так и от пробы к пробе) (рис.10.10).
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
463 |
РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.3. ВЫЯВЛЕНИЕ МУТАЦИЙ (ПОЛИМОРФИЗМОВ) В ГЕНОМЕ ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМКОМПЛЕКТА РЕАГЕНТОВ
Рис. 10.10 Пример интерпретации ре-
|
|
|
|
зультатов анализа: |
||
|
|
|
|
К °С – отрицательный контрольный |
||
|
|
|
|
образец; 1 – нормальная гомозигота; 2 |
||
|
|
|
|
– гетерозигота; 3 – патологическая (му- |
||
|
|
|
|
тантная) гомозигота; 4 – контаминация |
||
|
|
|
|
или затекание из соседнего кармана |
||
|
|
|
|
геля в тесте на патологическую (мутант- |
||
|
|
|
|
ную) аллель; 5 – реакция не прошла |
||
|
|
|
|
(ошибка при проведении анализа или |
||
|
|
|
|
некорректная работа амплификатора) |
||
Результаты занести в табл. 10.7. |
|
|
|
|||
|
|
|
|
|
Таблица 10.7 |
|
|
|
|
|
|||
Полоса (длины ампликонов для каждого |
|
|
||||
|
набора |
|
|
Интерпретация результата |
|
|
указана в таблице в начале инструкции) |
|
|
||||
|
|
|
|
|
|
|
Реакционная |
|
Реакционная смесь |
|
|
|
|
смесь |
|
|
|
|
||
|
Р («патология») |
|
|
|
||
N («норма») |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
- |
|
нормальная гомозигота |
|
+ |
|
|
+ |
|
гетерозигота |
|
- |
|
|
+ |
|
патологическая (мутантная) гомо- |
|
|
|
|
зигота |
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
Причины появления малоинтенсивных полос на электрофорезе: |
||||||
•ошибка при проведении анализа или некорректная работа амплификатора;
•частичное вытекание амплификата из кармана (малоинтенсивна как полоса ампликона, так и полоса димеров праймеров);
•контаминация образца или затекание амплификата из соседнего кармана геля.
Во всех этих случаях необходимо повторить амплификацию и детекцию, а при повторном появлении малоинтенсивных полос – повторить анализ, начиная со стадии выделения ДНК из соответствующей пробы.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
464 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА10.4. ПРОВЕДЕНИЕПЦРСДЕТЕКЦИЕЙРЕЗУЛЬТАТАВРЕЖИМЕ РЕАЛЬНОГОВРЕМЕНИПРИПОМОЩИСИСТЕМЫДЕТЕКЦИИПРОДУКТОВПЦРВ РЕЖИМЕРЕАЛЬНОГОВРЕМЕНИ«ICYCLER IQ5» (BIORAD)
 Цель лабораторной работы
Цель лабораторной работы
• ознакомление с принципом проведения ПЦР.
 Задачи лабораторной работы
Задачи лабораторной работы
•выделение ДНК из лейкоцитов цельной крови с помощью реагента «ДНК-экспресс-кровь»;
•проведение ПЦР с использованием комплекта реагентов для амплификации «SNP-экспресс-РВ»;
•детекция продуктов амплификации;
•анализ и интерпретация результатов.
 Материалы и оборудование
Материалы и оборудование
1.Система детекции продуктов ПЦР в режиме реального времени
«iCycler iQ5».
2.Система «SNP-экспресс-РВ».
 Характеристики оборудования
Характеристики оборудования
 СистемадетекциипродуктовПЦРврежимереальноговремени
СистемадетекциипродуктовПЦРврежимереальноговремени
Система детекции продуктов ПЦР в режиме реального времени «iCycler iQ5» представляет собой программируемый термостат (амплификатор), сопряженный с оптической системой детекции флуоресцентного сигнала по 5 каналам через крышки пробирок. Система позволяет проводить ПЦР
ирегистрировать сигнал от образцов по заданным каналам в каждом цикле. По окончании реакции управляющая программа строит кривые накопления фонового сигнала от каждого образца в каждом из задействованных каналов, по которым в дальнейшем и производится анализ результатов. Для работы с наборами SNP-экспресс-РВ используется канал SYBR I. В данном рук о- водстве указаны только операции, необходимые для использования прибора
иего программного обеспечения для работы с наборами «SNP-экспресс-РВ».
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
465 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.4. ПРОВЕДЕНИЕ ПЦР С ДЕТЕКЦИЕЙ РЕЗУЛЬТАТА В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
За дополнительной информацией следует обращаться к инструкции по использованию прибора или к его изготовителям.
 Система«SNP-экспресс-РВ»
Система«SNP-экспресс-РВ»
Система «SNP-экспресс-РВ» представляет собой комплект реагентов для выявления мутаций (полиморфизмов) в геноме человека. Анализу подвергается геномная ДНК человека, выделенная из лейкоцитов цельной крови с помощью реагента «ДНК-экспресс-кровь».
Внимание! Выделение данным методом является принципиальным для работы с наборами «SNP-экспресс-РВ», в случае использования других методов выделения, а также выделения из других биологических материалов адекватные результаты не гарантированы!
С образцом выделенной ДНК параллельно проводят две реакции амплификации – с двумя парами аллель-специфичных праймеров. В смеси присутствует интеркалирующий краситель SYBR Green, флуоресценция которого многократно возрастает при встраивании в образующийся двуцепочечный продукт. Результаты анализа позволяют дать три типа заключений: «нормальная гомозигота»; «гетерозигота»; «мутантная гомозигота».
Состав набора реагентов «SNP–экспресс- РВ» приведен в табл. 10.8.
|
|
|
|
Таблица 10.8 |
|
|
|
|
|
||
|
Комплект |
Комплект |
|
||
|
на 50 исследований/ |
на 100 исследований/ |
|
||
|
10 контрольных образцов |
20 контрольных образцов |
|
||
Положительный |
|
|
|
|
|
контрольный обра- |
60 |
мкл |
120 мкл |
|
|
зец |
|
|
|
|
|
|
|
|
|
|
|
Краситель SYBR |
25 |
мкл |
55 |
мкл |
|
Green |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Реакционная смесь |
150 мкл |
300 мкл |
|
||
«норма» |
|
||||
|
|
|
|
|
|
Реакционная смесь |
150 мкл |
300 мкл |
|
||
«мутация» |
|
||||
|
|
|
|
|
|
Разбавитель |
2 |
мл |
4 |
мл |
|
Taq-полимераза |
25 |
мкл |
50 |
мкл |
|
Минеральное масло |
2 |
мл |
4 |
мл |
|
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
466 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.4. ПРОВЕДЕНИЕ ПЦР С ДЕТЕКЦИЕЙ РЕЗУЛЬТАТА В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
Комплект реагентов для амплификации (на 50/100 образцов): хранить при минус 20ºС (для разбавителя и минерального масла допускается хран е- ние при 4 ºС), краситель SYBR Green хранить только при 4 ºС.
Внимание! Краситель SYBR Green разрушается под действием яркого света и хранится в коричневых непрозрачных пробирках. Перемещать его в прозрачные пробирки строго запрещено!
 Задание на выполнение лабораторной работы
Задание на выполнение лабораторной работы
Задание 10.4.1.Проведение ПЦР с детекцией результата врежиме реальноговремени
Порядок выполнения работы Внимание!!!
При приготовлении рабочей амплификационной смеси необходимо все компоненты добавлять отдельными наконечниками с аэрозольными барьерами (фильтрами). Такие же наконечники необходимо использовать и для внесения в пробирки препарата ДНК.
Недопустимо использование для приготовления смесей реактивов из комплектов других форматов. Разбавитель, Taq-полимераза и минеральное масло являются одинаковыми для всех комплектов формата «SNP-экспресс- РВ», но не могут использоваться для комплектов других форматов.
Рабочие смеси следует готовить непосредственно перед амплификацией. После внесения образца пробирки с амплификационными смесями должны быть как можно скорее помещены в амплификатор.
1. Приготовить и расставить в указанном в протоколе измерений порядке бесцветные пробирки с оптическими крышками, соответствующие рекомендациям производителя прибора, вместимостью 0,2 мл для проведения амплификации, включая пробирки для положительного контрольного образца ДНК и отрицательного контрольного образца. Маркировка пробирок не допускается! Для каждой пробы готовятся 2 пробирки N (норма) и M (мутация).
Чаще всего при проведении ПЦР с детекцией результата в режиме реального времени нанесение надписей на пробирки недопустимо. В этом
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
467 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.4. ПРОВЕДЕНИЕ ПЦР С ДЕТЕКЦИЕЙ РЕЗУЛЬТАТА В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
случае пробирки расставляются в штативе точно в том порядке, в котором они будут стоять в приборе, и составляется карта расположения образцов.
2.За 20 мин до приготовления рабочей амплификационной смеси извлечь комплект реагентов для ПЦР из морозильника, разморозить содержимое. Пробирки с реакционной смесью и полностью размороженным раствором разбавителя тщательно встряхнуть для перемешивания содержимого. Непрозрачную пробирку с красителем SYBR Green рекомендуется сначала центрифугировать на микроцентрифуге-вортексе, чтобы сбросить капли с крышки на дно, затем встряхнуть для перемешивания содержимого и снова центрифугировать.
3.Из компонентов комплекта приготовить рабочие смеси реагентов для амплификации из расчета на 1 пробу: 17,5 мкл разбавителя, 2,5 мкл реакционной смеси, 0,2 мкл красителя SYBR Green.
0,2 мкл Taq-полимеразы (вносится в последнюю очередь и перед ее внесением смесь рекомендуется немного перемешать)
Готовят две рабочие смеси: с реакционной смесью «норма» и с реакционной смесью «мутация».
Смесь тщательно перемешать пипетированием (если объем <200 мкл) или импульсным вортексированием 15–20 раз.
4.Внести в приготовленные пробирки по 20 мкл полученной рабочей
смеси.
5.Если необходимо, добавить во все пробирки по 20 мкл минерального масла.
6.Внести по 5 мкл образца из обработанной анализируемой пробы (см п. «Выделение ДНК») в пробирку с рабочей амплификационной смесью «норма» и в пробирку с рабочей амплификационной смесью «мутация». В качестве отрицательного контрольного образца вносится разбавитель, в качестве положительного контроля – положительный контрольный образец ДНК в объеме 5 мкл в оба типа реакционной смеси.
7.Пробирки закрыть и центрифугировать в течение 3-5 с при 2250– 4000 g (1500–3000 об/мин) при комнатной температуре на микроцентрифугевортексе (если используются плашки или стрипованные пробирки – на пред-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
468 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.4. ПРОВЕДЕНИЕ ПЦР С ДЕТЕКЦИЕЙ РЕЗУЛЬТАТА В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
назначенной для этого центрифуге; значение угловой скорости (об/мин) в этом случае может отличаться от указанного).
8.Не менее чем за 10 мин до постановки включить систему для проведения ПЦР с детекцией результата в режиме реального времени для прогрева.
9.Перенести пробирки в систему для проведения ПЦР с детекцией результата в режиме реального времени в точном соответствии заданным ранее протоколом расположения образцов. Руководствоваться инструкцией по эксплуатации системы «iCycler iQ5».
Детекция продуктов амплификации осуществляется прибором автоматически в каждом цикле амплификации. На основании этих данных управляющая программа строит кривые накопления флуоресцентного сигнала по каждому из заданных для образцов каналов.
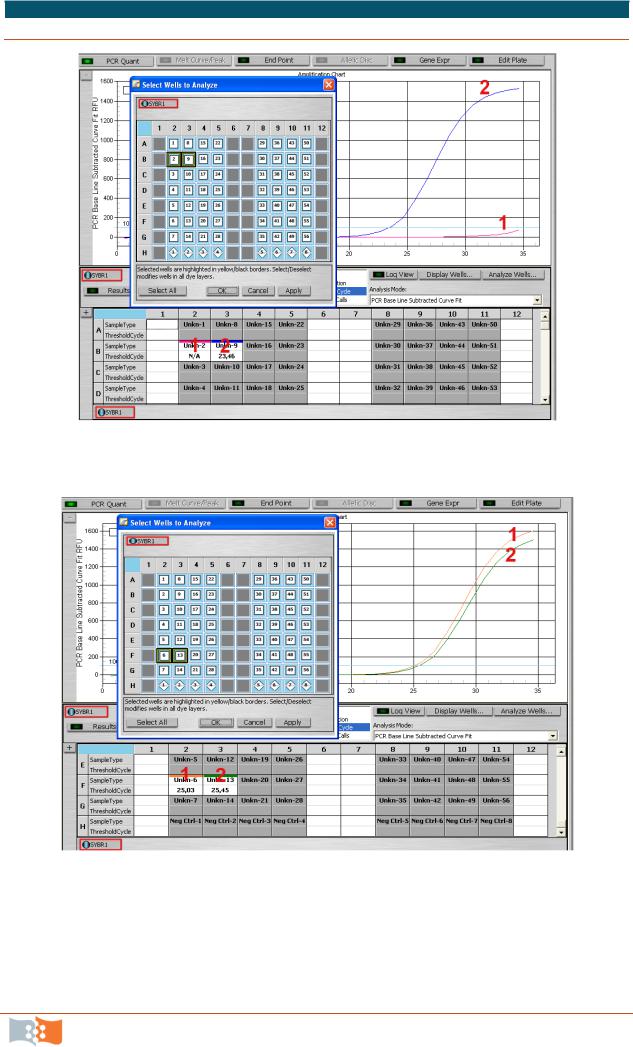
Автоматический анализ результатов выдается в виде грификов (на рис. 10.11–10.13 приведены примеры результатов для различного типа образцов).
Рис. 10.11. Нормальная зигота
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
469 |
РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.4. ПРОВЕДЕНИЕ ПЦР С ДЕТЕКЦИЕЙ РЕЗУЛЬТАТА В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
Рис. 10.12. Мутантная зигота
Рис. 10.13 Гетерозигота
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
470 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
Подраздел10.2. СОВРЕМЕННЫЕАНАЛИТИЧЕСКИЕМЕТОДЫЛАБОРАТОРНОЙ ДИАГНОСТИКИ
 Цель подраздела
Цель подраздела
•ознакомление студентов с новейшим оборудованием, используемым в клинической лабораторной практике для диагностики наиболее распространенных заболеваний, и обучить приемам работы на современной аналитической технике по ключевым направлениям современной лабораторной диагностики (биохимические, гематологические, коагулологические исследования).
 Задачи подраздела
Задачи подраздела
•обучение работе на автоматическом биохимическом анализато-
ре SAPPHIRE 400;
•обучение работе на гематологическом полуавтоматическом анализаторе МЕК-6400J/К;
•обучение работе на автоматическом коагулометре SYSMEX CA500.
 Краткие теоретические сведения
Краткие теоретические сведения
Любое заболевание приводит к различным изменениями в организме человека. В тяжелых случаях эти изменения заметны невооруженным глазом и могут достигать степени анатомических нарушений. Но чаще болезнь начинается на клеточном или даже молекулярном уровне. Необходимость выявления таких изменений привела к появлению особого раздела медицины, называемого лабораторной диагностикой. Объекты исследования лабораторной диагностики – это образцы тканей и жидкостей человеческого организма, либо его выделения.
Раньше всего, еще в ХIX в, для исследований такого рода была применена оптическая микроскопия, позволившая отрыть возбудителей большей части инфекционных болезней и описать на клеточном уровне харатерные изменения при различных патологических процессах. В наше время обычный световой микроскоп по-прежнему необходим для исследования гистологических препаратов и биологических жидкостей. Однако ему на смену постепенно приходят автоматизированные системы, позволяющие значительно
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
471 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
Подраздел 10.2. СОВРЕМЕННЫЕ АНАЛИТИЧЕСКИЕ МЕТОДЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
ускорить анализ и выдающие более объективные данные. Это достигается благодаря новым принципам распознавания форменных элементов. Например, в современных гематологических анализаторах используют два метода детекции, причем, как правило, параллельно:
а) кондуктометрический метод, при котором клетки крови проходят сквозь очень узкие отверстия, меняя их электрическое сопротивление. По величине сигнала различаются эритроциты, тромбоциты и основные формы лейкоцитов;
б) лазерно-импедансный метод, при котором клетки дифференцируются в зависимости от особенностей отражения лазерного луча.
С наступлением ХХ в. в диагностике заболеваний со все большей эффективностью применяют химический анализ биологических проб. Вначале такие определения проводили с помощью простых цветных реакций, дающих возможность качественной идентификации веществ. Но в качественном отношении состав тканей больного и здорового человека меняется крайне незначительно, существенная разница заключается в количественных изменениях. Количественное определение веществ стало возможным благодаря внедрению фотометрического метода, при котором через раствор с окращенным веществом пропускается луч света, а затем по изменению оптической плотности рассчитывают концентрацию. Метод не лишен определенных ограничений, наибольшие трудности связаны с разработкой специфических красителей. Строго говоря, абсолютно специфических красителей не существует, поэтому специфичность любого определения фотометрическим методом относительна. Тем не менее, варьируя состав красителей и подбирая оптимальную длину волны, можно добиться достаточно избирательного определения интересующего вещества. В некоторых анализаторах применяются люминесцентные метки, пришитые к специфическим антителам. Определение части веществ проводят без применения красителей по изменению интенсивности поглощения света коферментами, окисляющимися либо восстанавливающимися в ходе ферментативных реакций. Не требуются красители также при турбидиметрических вариантах детекции. Все это, вкупе с относительной дешевизной и простотой метода, привело к тому, что именно фотометрия используется в биохимических анализаторах и коагулометрах.
При всем многообразии типов современная аналитическая система обязательно включает в себя роботизированные дозирующие механизмы, блок детекции, а также блок управления и блок обработки информации. Для
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
472 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
Подраздел 10.2. СОВРЕМЕННЫЕ АНАЛИТИЧЕСКИЕ МЕТОДЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
увеличения производительности анализаторов используют принтеры, считыватели штрих-кодов, устройства пробоподготовки, сенсорные экраны и встроенные станции промывки кювет. В лабораториях крупных медицинских центров различные анализаторы объединяются в единую технологическую линию, благодаря чему достигается высокая степень автоматизации лабораторных исследований, уменьшается расход реактивов, а в конечном итоге снижается себестоимость анализа. Кроме того, применение анализаторов позволяет значительно ускорить выполнение анализов, повысить качество лабораторных исследований, а также создавать электронные банки данных по конкретным пациентам. В итоге сумма преимуществ, возникающих при использовании автоматизированных аналитических систем, вполне компенсирует их весьма существенную стоимость. На протяжении последних 15 лет количество различных анализаторов в лабораториях медицинских учреждений России увеличилось в несколько раз, и эта тенденция продолжается. Поэтому существует прямая необходимость готовить выпускников ВУЗов к работе на технике подобного рода.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
473 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА10.5. ОЗНАКОМЛЕНИЕСМЕТОДАМИОПРЕДЕЛЕНИЯВЕЩЕСТВ, ИМЕЮЩИХДИАГНОСТИЧЕСКОЕЗНАЧЕНИЕ, СИСПОЛЬЗОВАНИЕМ АВТОМАТИЗИРОВАННОГОБИОХИМИЧЕСКОГОАНАЛИЗАТОРА
 Цель лабораторной работы
Цель лабораторной работы
•формирование навыков оператора современного биохимического анализатора на базе SAPPHIRE 400 – прибора нового поколения, предназначенного для определения ферментов, метаболитов и микроэлементов крови человека.
 Задачи лабораторной работы
Задачи лабораторной работы
•знакомство с органами управления и технологической схемой биохимического анализатора SAPPHIRE 400;
•обучение приемам и методам работы на биохимический автоматическом анализаторе SAPPHIRE 400.
 Краткие теоретические сведения
Краткие теоретические сведения
Уже более 100 лет определение различных компонентов биологических жидкостей человека используется для диагностики различных заболеваний. Основным методом биохимических исследований остаются различные варианты фотометрии. Но на смену простейших фотоэлектроколориметров пришли спектрофотометры и люминометры. В наше время в развитых странах большинство биохимических исследований выполняется с помощью автоматизированных фотометров.
Объект исследования: кровь.
биохимический автоматическом анализаторе SAPPHIRE 400 (рис.10.14).предназначен для фотометрического определения ферментов, метаболитов и микроэлементов в биологических жидкостях (кровь, моча, цереброспинальная жтдкость). Потребность в таких анализах велика и составляет приблизительно 3 исследования на каждого пациента поликлиники и 6 — 8 на каждого пациента медицинского стационара. Для диагностики заболеваний сердца, включая инфаркт миокарда, чаще всего назначают определение активности креатинфосфокиназы-МВ, лактатдегидрогеназы 1 типа и аспартатаминотрансферазы крови. Диагностика заболеваний печени невозможна без определений прямого и общего билирубина, аланинаминотранс-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
474 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.5. ОЗНАКОМЛЕНИЕ С МЕТОДАМИ ОПРЕДЕЛЕНИЯ ВЕЩЕСТВ, ИМЕЮЩИХ ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ
феразы, гамма-глутамилтранспептидазы. Наличие заболеваний почек подтверждается результатми определения креатинина, мочевины, альбуминов и общего белка в крови, а также белка в моче. Болезни поджелудочной железы сопровождаются увеличением активности панкреатической амилазы в крови и моче. Различные формы анемий могут приводить к уменьшению концентрации свободного и связанного железа в крови. Диагностика сахарного диабета невозможен без исследования уровня глюкозы в крови. Степень развития атеросклероза оценивается на основании результатов определения триглицеридов и холестерина липопротеидов различной плотности. Содержание кальция и фосфора в крови является важным критерием для оценки состояния костной системы.
Рис. 10.14. Автоматический биохимический комплекс SAPPHIRE 400 (Boeki Machinery LTD, Япония)
 Материалы и оборудование
Материалы и оборудование
1.Биохимический автоматический анализатор SAPPHIRE 400.
2.Внешний компьютер с пакетом специализированных программ.
3.Одноразовые пластиковые пробирки для образцов.
4.Набор реактивов для определения глюкозы.
5.Стандартный раствор глюкозы.
6.Мультикалибраторы для контроля качества исследований.
7.Набор из трех автоматических пипеток на 2-20 мкл, на 100-1000 мкл и на 1000 — 5000 мкл.
8.Мерные стаканы и колбы, одноразовые наконечники для пипеток.
9.Растворы кислотного и щелочного очистителей кювет.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
475 |

РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
РАБОТА 10.5. ОЗНАКОМЛЕНИЕ С МЕТОДАМИ ОПРЕДЕЛЕНИЯ ВЕЩЕСТВ, ИМЕЮЩИХ ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ
10.Дистиллированная вода.
11.Бумага для встроенного принтера.
12.Холодильник для хранения образцов и реагентов.
13.Одноразовые латексные перчатки.
 Характеристики оборудования
Характеристики оборудования
АнализаторSAPPHIRE 400
Анализатор SAPPHIRE 400 представляет собой автоматизированный фотометр с набором светофильтров для различных длин волн. SAPPHIRE 400 является открытой системой и позволяет использовать реактивы и контрольные материалы различных производителей. Анализатор способен выполнять как кинетические исследования, так и исследования по «конечной точке». Управление осуществляется с внешнего компьютера. Предусмотрена программа контроля качества исследований и контроль срока годности реагентов.
.
Рис. 10.15. Рабочая зона анализатора SAPPHIRE 400
На анализаторе SAPPHIRE 400 можно определять до 90 различных веществ. Реальная производительность прибора составляет до 300 исследований в 1 ч. Конечный объем реакционной смеси составляет 200–400 мкл, объем анализируемого образца 5 — 30 мкл. Температура инкубации 37 °С. Потребле-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
476 |
