
- •Оглавление
- •РАЗДЕЛ 1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ НИЗШИХ ОРГАНИЗМОВ
- •Задание 1.1.1. Выделение плазмидной ДНК
- •Задание 1.2.2. Трансформация клеток E. сoli электропорацией
- •Задание 1.5.1. Приготовление смесей дНТФ/Cy5 ддНТФ
- •Задание 1.5.2. Постановка реакции
- •Задание 1.5.3. Осаждение и нанесение образцов на гель
- •Задание 1.5.4. Заливка геля и постановка электрофореза
- •Задание 1.5.5. Анализ сиквенсов
- •Задание 1.6.1. Выделение ДНК из биомассы водорослей
- •Задание 1.6.3. Проведение секвенирования
- •Задание 1.6.4. Анализ полученных данных
- •РАЗДЕЛ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЫСШИХ РАСТЕНИЙ
- •Задание 2.2.1. Проведение электрофореза выделенной ДНК в агарозном геле
- •Задание 2.2.4. Определение концентрации ДНК с помощью спектрофотометра
- •Задание 2.3.2. Разделение амплифицированных фрагментов ДНК с помощью электрофореза
- •Порядок выполнения работы
- •РАЗДЕЛ 3. БИОЛОГИЯ КЛЕТКИ В КУЛЬТУРЕ. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ ДЛЯ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ
- •Задание 3.5.1 Приготовление питательной среды
- •Задание 3.6.3. Посев клеток на материалах
- •Задание 3.6.5. Подсчет клеток
- •Задание 3.6.6. Процесс трипсинизации клеток
- •Задание 3.8.1. Освоение техники субкультивирования клеток
- •Задание 3.8.2. Замораживание прикрепленных клеток
- •РАЗДЕЛ 4. КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ. Технология микроклонального размножения растений
- •Задание 4.3.1. Выделение и культивирование апикальных меристем картофеля
- •РАЗДЕЛ 5. МЕТОДЫ И АППАРАТУРА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
- •Задание 5.6.1. Определение показателей роста и спорообразования грибных культур поверхностным и глубинным способом
- •Задание 5.8.1. Освоить методы культивирования микроводорослей
- •РАЗДЕЛ 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ И МЕТАБОЛИТОВ
- •Задание 6.10.1. Снятие ИК-спектра полигидроксибутирата
- •РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
- •Задание 7.1.1. Приготовление образцов для исследования.
- •Задание 7.2.1. Приготовление образцов для исследования.
- •Задание 7.2.3. Проверка светорассеяния в исследуемых образцах
- •Составление отчета
- •4. Составление отчета.
- •Задание 7.4.1. Приготовление образцов для исследования.
- •Задание 7.4.2. Исследование спектров люминесценции.
- •Задание 7.5.1. Оценить численность микроорганизмов в водных образцах
- •РАЗДЕЛ 8. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ФОТОСИТЕЗИРУЮЩИХ ОРГАНИЗМОВ
- •РАЗДЕЛ 9. МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •Задание 9.1.3. Определение константы Михаэлиса. Специфичность
- •Задание 9.2.2. Определение типов взаимодействия эффекторов с ферментом по отношению к субстрату
- •РАЗДЕЛ 10. СОВРЕМЕННЫЕ МЕТОДЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
- •Задание 10.3.1. Выделение ДНК из биопроб
- •Задание 10.5.1. Построение абсолютного калибровочного графика зависимости концентрации глюкозы в пробе от изменений оптической плотности
- •Задание 10.7.1. Исследование образца крови на анализаторе МЕК-6400J/К
- •РАЗДЕЛ 11. БИОФИЗИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ
- •Задание 11.4.1. Ознакомление с метордом автоматической фотоколориметрии
- •РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
- •РАЗДЕЛ 1
- •РАЗДЕЛ 2
- •РАЗДЕЛ 3
- •РАЗДЕЛ 4
- •РАЗДЕЛ 5
- •РАЗДЕЛ 6
- •РАЗДЕЛ 7
- •РАЗДЕЛ 8
- •РАЗДЕЛ 9
- •РАЗДЕЛ 10
- •РАЗДЕЛ 11
- •Приложение. Перечень научного оборудования, использованного в лабораторном практикуме

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
Рис. 7.6. Люминесцентный спектрометр Aminco Bowman Series 2 (Thermo Spectronic, США). Материалы Е. В. Немцевой
Управление работой и обработка данных: специализированная компьютерная программа, позволяющая управлять прибором, корректировать данные на спектральную чувствительность установки, проводить математическую обработку спектров.
 Задания на выполнение лабораторной работы
Задания на выполнение лабораторной работы
Задание 7.4.1. Приготовление образцов для исследования.
Порядок выполнения работы
1.Получить порошок белка. Рассчитать, навеску какой массы следует сделать, чтобы получить 2 мл раствора концентрации 1·10-5 М.
2.Проверить расчеты у преподавателя.
3.Приготовить навеску белка и растворите ее в 2 мл фосфатного буфера (рН 7).
4.Дать раствору постоять не менее 20 мин в темном прохладном ме с-
те.
5.Растворы тирозина и триптофана в двух средах получить у препода-
вателя.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
374 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
Задание 7.4.2. Исследование спектров люминесценции.
Порядок выполнения работы
1. Записать спектры испускания люминесценции триптофана (2 10-5 М), тирозина (10-4 М), белка (10-5 М) при двух длинах волн возбуждения 275 и 295 нм и в двух средах – растворе NaOH и фосфатном буфере.
Условия регистрации: диапазон съемки 285–450 нм для λвозб=275 нм, 305–450 нм для λвозб=295 нм, шаг 1 нм, спектральная ширина щелей 4 нм, напряжение на ФЭУ должно быть одинаковым для всех измерений (поэтому первым надо измерять самый яркий образец триптофан). Не забыть откорректировать полученные спектры!
2. Записать спектры возбуждения люминесценции всех образцов в двух средах – растворе NaOH и фосфатном буфере.
Условия регистрации: λрег – 305 нм для тирозина в буфере и 340 нм для всех остальных образцов, диапазон съемки 260-295 нм для тирозина в буф е-
ре и 260-330 нм для всех остальных образцов, шаг 1 нм, спектральная шир и- на щелей 4 нм, напряжение на ФЭУ должно быть одинаковым для всех и з- мерений. Не забудьте откорректировать полученные спектры!
3. Составление отчета
1. Спектры люминесценции трех веществ: белка, тирозина, триптофана (не нормировать, отразить все, как есть):
а) в NaOH, возбуждение 275 нм, б) в NaOH, возбуждение 295 нм,
в) в фосфатном буфере, возбуждение 275 нм, г) в фосфатном буфере, возбуждение 295 нм.
2. Спектры возбуждения люминесценции этих же веществ (не нормировать, отразить все, как есть):
а) в NaOH,
б) в фосфатном буфере.
3. Анализ спектров в виде табл 7.6
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
375 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
Таблица 7.6.
№ образца |
Образец |
Растворитель |
Спектр испускания |
Спектр возбуж- |
|
Стоксов сдвиг, нм |
|||||
|
дения |
|
Q,о.е. |
||||||||
|
|
|
|
|
|||||||
λвозб , |
λфлmax , |
I |
λрег, |
|
λвозбmax |
I max, |
|||||
|
|
|
нм |
нм |
max, |
нм |
|
нм |
о. е |
|
|
|
|
|
о.е |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Трип- |
NaOH |
275 |
… |
… |
340 |
|
… |
|
… |
|
1 |
тофан, |
295 |
… |
… |
|
|
|
||||
|
|
|
|
|
|
|
|||||
2 10-5 |
|
|
|
|
|
|
|
|
|
|
|
фосф. |
275 |
… |
… |
340 |
|
… |
|
… |
|
||
|
М |
буфер |
295 |
… |
… |
|
|
|
|||
|
|
|
|
|
|
|
|||||
2 |
|
|
|
|
|
|
|
|
|
|
|
… |
|
|
|
|
|
|
|
|
|
|
|
При написании выводов следует обратить внимание на следующие вопросы:
1. Схожи ли люминесцентные свойства белка с характеристиками ами-
λфл λвозб
нокислот (по max и/или max )?
2.Где, предположительно, располагаются триптофановые остатки в исследованной белковой глобуле?
3.Какие из исследованных образцов проявляют рН-зависимость спектров люминесценции? Почему?
4.Как изменяются характеристики люминесценции белка при денатурации? Чем это объясняется?
5.Проявляется ли люминесценция тирозиновых остатков в составе
белка?
6.Какой из исследованных объектов обладает наибольшим квантовым выходом?
 Контрольные вопросы
Контрольные вопросы
1.Что такое первичная, вторична, третичная и четвертичная структуры белков? Какими связями эти структуры удерживаются?
2.Какие компоненты в составе белка проявляются в спектрах его люминесценции?
3.Какие эффекты влияют на спектры люминесценции макромолекул?
4.Что такое спектр люминесценции, квантовый выход, стоксов сдвиг?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
376 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.4. ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ БЕЛКОВ
5. Какие задачи решают с помощью люминесцентной спектроскопии белков?
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
377 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА7.5. ОЦЕНКАЧИСЛЕННОСТИМИКРООРГАНИЗМОВВВОДЕМЕТОДОМ ЛЮМИНЕСЦЕНТНОЙМИКРОСКОПИИСПОМОЩЬЮФЛУОРЕСЦЕНТНОГОЗОНДА
DAPI
 Цель лабораторной работы
Цель лабораторной работы
• освоить метод флуоресцентной микроскопии.
 Краткие теоретические сведения
Краткие теоретические сведения
1.Микроорганизмы в водных объектах
Влюбых природных водоемах основную роль в биогеохимическом круговороте вещества составляют микроорганизмы. В водных экосистемах именно микроорганизмы (бактерии и археи, одноклеточные водоросли, простейшие) осуществляют функцию первичной продукции вещества в процесса фотосинтеза (микроводоросли, фотосинтезирующие бактерии). В обратном процессе – разложении отмершей органики – ключевая роль также принадлежит гетеротрофным микроорганизмам (наряду с грибами). В различных условиях численности микроорганизмов в водных экосистемах могут быть разными. Даже в самых чистых ручьях и озерах общая численность микроорганизмов различных групп составляет 103 клеток в 1 мл. В сильно загрязненных водоемах и в некоторых зонах повышенной активности водоемов, концентрация может достигать 108 – 109 кл/мл. Численность микроорганизмов определяется многими процессами и факторами, поэтому Задание описания динамики численности тех или иных специфических групп микроорганизмов в той или иной экосистеме требует комплексного подхода с применением математических моделей и до настоящего времени полностью не решена. Тем не менее, общая численность микроорганизмов является количественным показателем чистоты воды (в том числе, используемой человеком), а также показателем трофического статуса водоема, и оценка этого показателя необходима при исследованиях качества воды как в санитарных целях, так и в экологическом мониторинге и фундаментальных исследованиях биотического круговорота.
2.Методы оценки численностей микроорганизмов
Существуют два основных подхода к оценке численностей микроорганизмов в воде.
Первый – это метод посевов на твердые среды. Суть метода состоит в том, что определенный объем водного образца наносится на поверхность
|
Современные аппаратура и методы исследования биологических систем. Большой практикум.Учебебное пособие |
378 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.5. ОЦЕНКА ЧИСЛЕННОСТИ МИКРООРГАНИЗМОВ В ВОДЕ МЕТОДОМ ЛЮМИНЕСЦЕНТНОЙ МИКРОСКОПИИ
агара, смешанного с питательной средой. Размножаясь за счет потребления компонентов питательной среды (сам агар практически не потребляется большинством организмов), клетки через некоторое время образуют на поверхности агара колонии, видимые невооруженным глазом. Предполагается, что число колоний, выросших на поверхности агара, равно числу клеток, попавших на эту поверхность при посеве, а следовательно, может быть пересчитано с учетом разведений, в концентрацию клеток в исходном образце.
Данный метод больше подходит для оценки численностей определенных специфических групп микроорганизмов в зависимости от состава питательной среды. Однако он имеет ограниченную применимость при оценке общей численности клеток, т.к. трудно подобрать среду, на которой одинаково хорошо росли бы представители разных физиологических групп. Кроме того, неоднократно показано с помощью современных молекулярногенетических методов, что подавляющее большинство (около 99 % видов) бактерий, которые существуют в природных экосистемах, вообще не поддаются культивированию на известных питательных средах. Следовательно, данный метод дает заведомо заниженную оценку численностей, однако позволяет оценивать и изучать специфические группы микроорганизмов.
Вторым методом оценки общей численности микроорганизмов в воде является прямой подсчет клеток на мембранных фильтрах под микро-
скопом. Для этого определенный объем исследуемой воды профильтровывают через фильтр, диаметр пор которого меньше диаметра самых мелких бактериальных клеток (около 0,2 мкм). После фильтрации поверхность фильтра обрабатывается различными красителями, специфически окрашивающими клетки микроорганизмов, после чего фильтр можно рассмотреть под микроскопом и подсчитать среднее количество клеток в поле микроскопа, затем пересчитать эту величину в концентрацию клеток в исходном образце. Данным методом могут быть учтены все клетки, независимо от их видовой принадлежности. Недостаток метода состоит в том, что невозможно отличить живые клетки от мертвых (или неактивных).
В настоящее время широко используются флуоресцентные красители (зонды), которые позволяют с помощью люминесцентного микроскопа видеть исследуемые клетки микроорганизмов в виде светящихся объектов на темном фоне, что дает возможность избегать ошибок и делает изображение клеток отчетливым и легко распознаваемым. В данной работе применяется наиболее современный метод окраски микробных клеток – окраска флуоро-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
379 |
РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.5. ОЦЕНКА ЧИСЛЕННОСТИ МИКРООРГАНИЗМОВ В ВОДЕ МЕТОДОМ ЛЮМИНЕСЦЕНТНОЙ МИКРОСКОПИИ
хромом (зондом) DAPI, который обладает рядом преимуществ перед другими красителями, применявшимися ранее. Данный краситель широко применяется в водной экологии для оценки общей численности микроорганизмов
вобразцах.
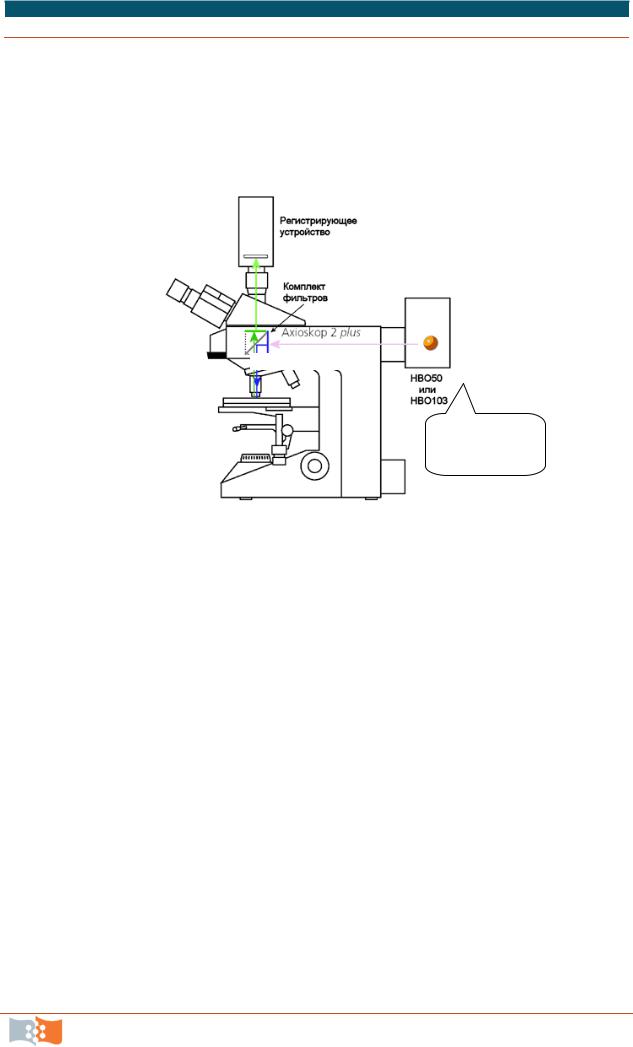
3.Принципы люминесцентной микроскопии (рис. 7.8).
Источник
возбуждающего
излучения
Рис. 7.8. Принципиальная схема устройства люминесцентного микроскопа
Флуоресцирующие красители поглощают свет одной длины волны и излучают свет другой, большей длины волны. Если такое вещество облучить светом, длина волны которого совпадает с длиной волны света, поглощаемого красителем, и затем для анализа использовать фильтр, пропускающий свет с длиной волны, соответствующей свету, излучаемому красителем, флуоресцирующую молекулу можно выявить по свечению на темном поле. Высокая интенсивность излучаемого света является характерной особенностью таких молекул. Применение флуоресцирующих красителей для окраски клеток предполагает использование специального флуоресцентного микроскопа (рис. 7.8). Такой микроскоп похож на обычный оптический, но свет от мощного осветителя проходит через два набора фильтров – один для задержания части излучения осветителя перед образцом и другой для фильтрации света, полученного от образца. Первый фильтр выбран таким образом, что он пропускает лишь свет длины волны, возбуждающей определенный флуоресцирующий краситель; в то же время второй фильтр блокирует этот па-
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
380 |

РАЗДЕЛ 7. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
РАБОТА 7.5. ОЦЕНКА ЧИСЛЕННОСТИ МИКРООРГАНИЗМОВ В ВОДЕ МЕТОДОМ ЛЮМИНЕСЦЕНТНОЙ МИКРОСКОПИИ
дающий свет и пропускает свет длины волны, излучаемой красителем при его флуоресценции.
 Материалы и оборудование
Материалы и оборудование
1.Люминесцентный микроскоп
2.Воронка Зейтца, колба Бунзена, насос-компрессор, фильтры поликарбонатные с диаметром пор 0,2 мкм, стекла предметные, стекла покровные, масло иммерсионное.
 Характеристики оборудования
Характеристики оборудования
 Люминесцентныймикроскоп
Люминесцентныймикроскоп
Технические характеристики люминесцентного микроскопа Axioskop 40
(CarlZeiss, Германия):
•увеличение 400-1500 раз;
•содержит четыре набора светофильтров с соответствующими светоделительными пластинами, позволяющие наблюдать флюоресценцию во всем видимом диапазоне;
•источники света: лампа накаливания для наблюдения в проходящем свете и ртутная лампа (время работы 200 ч) для возбуждения флуоресценции.
|
Современные аппаратура и методы исследования биологических систем. Большой практикум. Учебебное пособие |
381 |
