
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Основные неисправности свинцовых кислотных аккумуляторов.
Коррозия решеток положительных пластин, идущая вследствие термодинамической неустойчивости свинца при высоких анодных потенциалах (при перезарядах). Выделяющийся наPbO2кислород входит в виде сверхстехиометрических атомов в кристаллическую решетку PbO2и может окислить оголившиеся участки решетки. Защита от коррозии проводится легированием сплаваPb-Sb, из которого отливают решетки пластин, добавками серебра (до 3%), мышьяка (0,1 – 0,3%), кальция, таллия и др. Добавки модифицируют структуру металла, делают ее более мелкозернистой, так что продукты коррозии полностью экранируют межкристаллитное пространство от коррозионно-активных веществ, предохраняя металл от дальнейшей коррозии.
Деформация решеток положительных пластин, происходящая вследствие разбухания и сжатия активных масс при циклировании, предотвращается плотной сборкой блока пластин, выбором соответствующей, более жесткой конструкции решеток овального сечения, введением в сплав добавок серебра.
Оплывание положительной активной массы(отрыв мельчайших – до 0,1 мкм – частиц активной массы и оседание ее на дне сосуда в так называемом шламовом пространстве), которое зависит от структуры активной массы и уменьшается при низких плотностях тока разряда, при повышении температуры и понижении концентрацииH2SO4. Оплывание резко увеличивается (происходит «вынос активной массы») при попадании в активную массу положительной пластины даже следовBaSO4. В силу изоморфности кристалловPbSO4иBaSO4при разрядеPbO2на центрах кристаллизации – вкрапленияхBaSO4– растут «друзы» кристаллов сульфата свинца. Кристаллы оксида свинца опадают на дно аккумулятора и не участвуют в последующем токообразующем процессе.
Оплывание положительной активной массы предотвращают разделением линий производства положительных и отрицательных пластин (во избежание попадания в массу расширителя BaSO4), плотной сборкой блока пластин, а также введением в электролит добавок сернокислого гидроксиламина (до 1%) либо NH4VO3 или (NH4)2Cr2O7в концентрациях ~ 0,03 моль/л.
Вредная сульфатация отрицательных пластинпроявляющаяся в том, что аккумулятор «не держит емкость» при разряде (рис. 5.2, кривая 2), а при заряде (кривая 1 там же) газовыделение на электроде (плато на зарядной кривой) наблюдается уже при напряжении 2,3 – 2,4 В. Отрицательные пластины покрываются при этом сплошным твердым слоемPbSO4,белесого цвета. След от проведения по такой пластине неметаллическим предметов «аморфен», не имеет металлического блеска
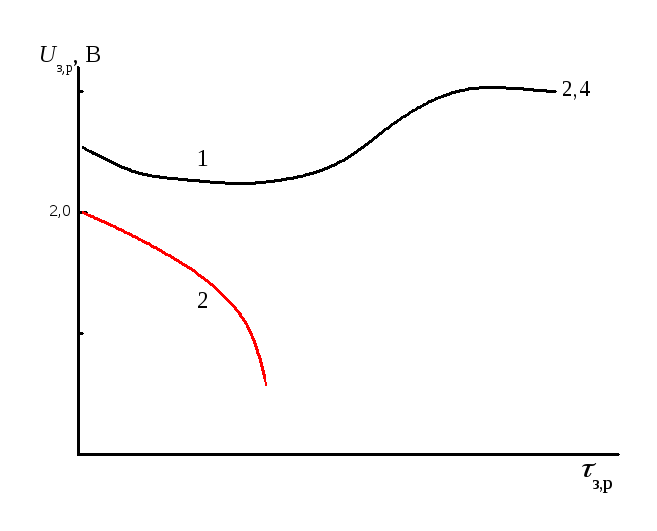
Рис. 5.2 Зарядно-разрядные кривые для отрицательных пластин кислотных свинцовых аккумуляторов
Причиной вредной сульфатации свинцовых пластин считают их поляризацию вследствие адсорбции поверхностно-активных загрязнений при длительном стоянии незаряженного аккумулятора. Вредной сульфатации способствуют также неполная формировка пластин, систематические недозаряды аккумулятора, повышенный саморазряд. Лечение засульфатированных пластин заключается в длительных, многократно повторяющихся зарядах малыми токами в разбавленной серной кислоте.
Короткие замыканияположительных и отрицательных пластин, предотвращающиеся применением мелкопористой сепарации, примерно на 0,5 см выступающей за края пластин (иногда применяется конвертирование пластин), а также созданием на дне аккумуляторных емкостей шламового пространства (в стартерных аккумуляторах пластины устанавливают на призмы дна сосуда).
Саморазрядсвинцовых кислотных аккумуляторов достигает 30% в месяц и происходит вследствие самопроизвольно идущих при стоянии аккумулятора химических реакций
Pb + H2SO4 → PbSO4 + H2 (5.г)
2Pb + 2H2SO4 + O2 → 2PbSO4 + 2H2O (5.д)
и в меньшей степени:
2PbO2 + 2H2SO4 → 2PbSO4 + 2H2O + O2 (5.е)
Саморазряд увеличивается в присутствии добавок (Ag,Sb), снижающих перенапряжение выделения газов на электродах. Поэтому легирование решеток пластин серебром используют при производстве стартерных (работающих в режиме подзаряда) аккумулятора. Способствуют саморазряду возникновение в аккумуляторах коротких замыканий, присутствие в электролите легко восстанавливающихся и окисляющихся ионов, напримерFe3+/Fe2+(поэтому недопустимо использование для добавки электролита недистиллированной воды).
Хранение аккумуляторов и уход за ними должны проводиться с учетом необходимости предотвращения заболеваний аккумуляторов и повышения их саморазряда. Хранение загерметизированных новых сухих аккумуляторов не должно превышать 3 года, а залитых электролитом – 0,5 года при 5 – 30С. Необходимо следить за чистотой контактов и вентильных отверстий в пробках банок стартерных и тяговых аккумуляторов, чтобы обеспечить свободное газовыделение при саморазряде и при заряде ХИТ. Залитые кислотой аккумуляторы необходимо заряжать ежемесячно, систематически проверять уровень электролита и плотность кислоты в каждой банке аккумуляторной батареи. При снижении уровня электролита, который должен быть на 115 – 120 мм выше верхнего края пластины, в аккумулятор доливают нужное количество дистиллированной воды (либо при необходимости раствора серной кислоты “чда” или “для аккумуляторов” требуемой плотности). При эксплуатации батарей с последовательным соединением аккумуляторов необходимо систематически проверять напряжение на каждой банке, используя для этого нагрузочную вилку. Это вызвано тем, что при неисправности пластин аккумулятора и резком снижении напряжения на таком отстающем аккумуляторе может произойти переполюсовка его пластин за счет “навязывания” им соответствующих потенциалов от соседних аккумуляторов (рис. 5.3).

Рис. 5.3 Переполюсовка пластин свинцового аккумулятора
