
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Первичные хит с магниевыми и литиевыми анодами
Сухие первичные ХИТ с магниевымианодами, вместо электроотрицательного
цинка, выпускались в габаритах
стаканчиковых МЦ элементов, но не
получили широкого распространения,
несмотря на хорошие эксплуатационные
характеристики. Так марганцево-магниевые
элементы системы![]()
 имеют пологие разрядные характеристики,
очень малый саморазряд, вдвое большие,
чем у МЦ ХИТ коэффициенты использования
активных масс. Элементы работоспособности
при низких (до - 40С)
температурах, сохранность через два
года 85 – 90%, удельная энергия при
непрерывном разряде до 1,25В составляет
120 (Вт·ч/кг) или 200 (кВт∙ч/м3). Однако
эти преимущества элементов с магниевыми
анодами сохраняются только при непрерывном
разряде не очень малыми токами, что
обусловлено необходимостью активировать
магниевые аноды (амальгамированием,
добавками в электролитCl-,
имеют пологие разрядные характеристики,
очень малый саморазряд, вдвое большие,
чем у МЦ ХИТ коэффициенты использования
активных масс. Элементы работоспособности
при низких (до - 40С)
температурах, сохранность через два
года 85 – 90%, удельная энергия при
непрерывном разряде до 1,25В составляет
120 (Вт·ч/кг) или 200 (кВт∙ч/м3). Однако
эти преимущества элементов с магниевыми
анодами сохраняются только при непрерывном
разряде не очень малыми токами, что
обусловлено необходимостью активировать
магниевые аноды (амальгамированием,
добавками в электролитCl-,![]() или
или![]() - ионов) в начальный период разряда, так
как при включении ХИТ наблюдается
“провал” в начале разрядной кривой,
вызванный пассивацией магния. Магний
бурно реагирует с кислотами, выделяя
по экзотермической реакции водород,
пассивируется, покрываясь плотной
пленкой гидроксида, в щелочной среде.
- ионов) в начальный период разряда, так
как при включении ХИТ наблюдается
“провал” в начале разрядной кривой,
вызванный пассивацией магния. Магний
бурно реагирует с кислотами, выделяя
по экзотермической реакции водород,
пассивируется, покрываясь плотной
пленкой гидроксида, в щелочной среде.
Однако в слабощелочной и солевой средах образующаяся на металле пористая пленка Mg(OH)2, не препятствует работе магниевого анода. В солевых электролитах магнию присущ так называемый отрицательный дифференц-эффект – увеличение объема выделяющегося водорода вместо его уменьшения с ростом анодной плотности тока. Эффект объясняется “дополнительным” выделением водорода на механически оголяемых (незапассивированных) участках анода, либо стадийным механизмом разряда: на электроде адсорбируютсяMg+ионы, часть которых затем взаимодействует с водой, выделяя водород, а часть окисляется на электроде доMg2+. При работе элемента теряется 40 – 50% металла. Используют элементы главным образом для питания военной аппаратуры связи (США).
Первичные хит с литиевыми анодами
Первичные ХИТ с литиевымианодами считаются в настоящее время наиболее перспективными. ВXXIвеке, они могут вытеснить все другие ХИТ аналогичного назначения.
Литий обладает высоким электроотрицательным потенциалом (- 3,045 В) и наименьшим теоретическим расходом металла на А·ч емкости (0,259 г/А∙ч). Литий очень легкий и мягкий металл с низким удельным сопротивлением (~10-8Ом∙м) и высокой химической активностью. Он корродирует в газовой среде, энергично разлагая даже следы воды:
2Li+ 2H2O=LiOH+H2
В сухом воздухе поверхность лития покрывается слоем оксида (во влажном – гидроксида) и пассивируется. Чистый металл может реагировать с большинством способных восстанавливаться органических и неорганических веществ. Все это налагает ограничения на выбор активных масс, электролитов, конструкции литиевых элементов и условия их производства.
Для работы с литием обычно используют атмосферу сухого инертного газа или воздуха с содержанием воды не выше 0,3 г/м3. Необходим надежный контроль влажности атмосферы и содержания воды в обычно используемых для приготовления растворов электролитов апротонных растворителях (пропиленкарбонат (ПК), ацетонитрил (АН), γ-бутиролактон, тетрагидрофуран, диметилдисульфоксид, тионилхлорид и др). Требуется также тщательная очистка растворителей и солей, используемых в качестве электролита (LiClO4,LiAlCl4,AlCl3, фторбораты и гексафторарсенаты лития, с оптимальной концентрацией ~1 моль/л). В ХИТ с литиевыми анодами применяют также расплавленные электролиты, содержащиеLiCl(чаще всего эвтектическая смесьLiCl+KClс температурой плавления 400 - 600С).
В качестве катодной активной массы в литиевых ХИТ используют оксиды металлов (MnO2,V2O5,MoO3,WO3,CuO,TiO2) и некоторых неметаллов (SO2,SOCl2), а также халькогениды, сульфиды железа, титана, меди, фториды углерода. Процессы восстановления активной массы, как правило, происходят в твердой фазе. Литий ведет себя как электрод первого рода.
Механизм восстановления оксидов в апротонных безводных растворителях отличается от процессов восстановления в водной среде тем, что роль протона играют катионы лития, которые внедряются в кристаллическую решетку оксида, образуя новые соединения, например:
Li + MnO2
+
![]() →MnOOLi;(4.и)
→MnOOLi;(4.и)
xLi + V2O5 → LixV2O5.
При этом внедрение катиона лития в нестехиометрические оксиды происходит без нарушения строения кристаллической решетки. Для оксидов с объемом элементарной ячейки кристалла меньше 6∙10-3мкм3внедрениеLi+ сопровождается ее разрушением:
2Li + CuO → Li2O + Cu
12Li + Bi2O3 → 2Li3Bi + 3Li2O3 (4.к)
На процессы электровосстановления катодных материалов оказывает влияние природа растворителя.
Выпускаемые промышленностью элементы
на основе апротонных (АПР) растворителей,
в которых используется MnO2(ДМД элементы)![]()
 дисковой (пуговичной), либо цилиндрической
с электродами рулонного типа конструкций
массой от 0,8 до 13 г, получили широкое
распространение и используются в
малогабаритной вычислительной и
радиоэлектронной аппаратуре. При
напряжении ~ 3В они имеют малый саморазряд
и хорошую сохранность, работают в широком
диапазоне температур, удельная энергия
достигает 200 Вт∙ч/кг при небольшой
удельной мощности, так как плотности
тока разряда не превышают 1 мА/см2.
дисковой (пуговичной), либо цилиндрической
с электродами рулонного типа конструкций
массой от 0,8 до 13 г, получили широкое
распространение и используются в
малогабаритной вычислительной и
радиоэлектронной аппаратуре. При
напряжении ~ 3В они имеют малый саморазряд
и хорошую сохранность, работают в широком
диапазоне температур, удельная энергия
достигает 200 Вт∙ч/кг при небольшой
удельной мощности, так как плотности
тока разряда не превышают 1 мА/см2.
Универсальными являются ХИТ системы
![]()
![]() герметичной конструкции со спиральными
элетродами из прокатанной литиевой
фольги. Токообразующая реакция в элементе
герметичной конструкции со спиральными
элетродами из прокатанной литиевой
фольги. Токообразующая реакция в элементе
2Li+ 2SO2→Li2S2O4, (4.л)
Uрц= 3В;Wуд= 330 – 340 Вт∙ч/кг или 530 – 560 Вт∙ч/дм3;Руд= 100 Вт/кг или 200 Вт/дм3. Элементы работоспособны в широком интервале температур (-60…+60°С), при этом сохраняются их разрядные характеристики (рис. 4.3). Эти ХИТ используют в военной и космической технике, для питания аппаратуры метеозондов, в радиосвязи и охранной сигнализации.

Рис. 4.3 Разрядные характеристики ХИТ с литиевыми анодами
Лучшие показатели у ХИТ системы
![]() Li|LiAlCl4|SOCl2|C,
в которой протекает реакция:
Li|LiAlCl4|SOCl2|C,
в которой протекает реакция:
2SOCl2 + 4Li → 4LiCl + SO2 + S. (4.м)
Элементы обладают стабильными разрядными характеристиками, Uр≈ 3,5В,Wуд= 600 Вт∙ч/кг и 1100 Вт∙ч/дм3; при Uр= 3В плотность тока разряда 10-2А/см2,Руд= 30 – 50 Вт/кг. Работоспособны в интервале температур -70…+70°С, сохранность при комнатной температуре 5 – 10 лет, используются в космической и специальной технике. Преимущества литиевых ХИТ по сравнению с МЦ элементами иллюстрирует график зависимостиWудот температуры эксплуатации (рис. 4.4). Эффективность характеристик наиболее часто применяемых первичных ХИТ с литиевыми анодами снижается в зависимости от используемых катодных активных масс в ряду:
Li|SOCl2>Li|SO2>Li|MnO2>Li|(CFx)n.
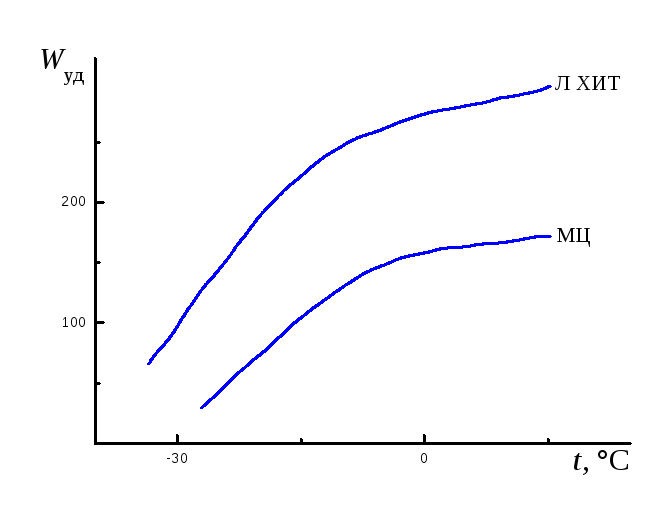
Рис. 4.4 Зависимость удельной мощности литиевых ХИТ и марганцево-цинковых (МЦ) элементов
