Ответы на экзаменационные вопросы
.doc|
1. Строение атома. Модели атомы (Морозова, Резерфорда, Бора) Атом – это наименьшее кол-во вещества, обладающее хим. св-вами. Атом –исходное состояние для хим. превращений.
1790-1815 гг. – открыты
осн. законы химии 1882 г. – Морозов
предложил след. модель строения атома:
атом он представлял в форме куба,
внутри кот. находится + q,
в узлах – отриц. 1897 г. – Дж. Томсон
открыл
1910
г. – в лаборатории Э.
Резерфорда
в опытах по бомбардировке металлического
фольги
|
2. Постулаты Бора, радиус, энергия, уравнение Бора Постулаты Бора:
|
3. Квантово-механические представления об атоме. = h/ (vm) – урав Де Бройля. Орбиталью наз-ся область пространства, в кот-м наиболее вероятно нахождение электрона. Т.к. электрон несет отриц. Заряд, то его орбиталь представляет собой определенное распределение заряда, кот-е получило название электронного одлака. Эйнштейн : Любое излучение представляет собой поток квантов энергии, наз-мых фотонами. Квант – это порция энергшии. => все квантовые числа х-зуют энергию электрона на энергет. Уровнях и подуровнях. Для х-ки поведения электрона в атоме введены квантовые числа : главное, орбитальное, магнитное и спиновое.
|
4.Волновые и корпускулярные свойства микрочастиц, е. 1905 Эйнштейн: излучение представляет собой поток квантов Е, называемых фотонамисвет имеет двойственную природу. 1924 Луи де Бройль: Всем
частицам, обладающим большой V
и min
m
присуща двойственность.
Электрон
Корпускула волна
Е=mc2 Е=hс/
mc2=hс/,
=h/mc=1/mv |
5. Принцип неопределенности Гейзенберга. Волновая функция. Волновое ур-е Шредингера
Принцип
неопределенности Гейзенберга
(1927 г.): невозможно утверждать, что e,
имеющий определенную скорость,
находится в той или иной точке
пространства. Вероятность нахождения
электрона в определенной области
пространства описывается волновой
функцией
x, y, z – координаты электрона m – масса электрона Е – полная энергия U – потенциальная энергия
|
|
|||||||||||||||||
|
6. Квантовые числа и их физический смысл
I.
Главное
квантовое число
(совпадает с номером периода): n=1,
2, 3, 4, …,
Характеризует: 1) номер энергетического уровня, равный номеру периода 2) энергию электрона на уровне
3) радиус ядра,
т.е. степень удаления от ядра:
4) максимальное число электронов на энергетическом уровне: N = 2n2 II. Орбитальное квантовое число: ln=0, 1, 2, 3, …, n-1 Характеризует: 1) энергию электрона на подуровне 2) форму электронной орбитали: l=0, то s-орбиталь; l=1, то p-орбиталь; l=2, то d-орбиталь; l=3, то f-орбиталь III. Магнитное квантовое число: m = –1, 0, 1 Характеризует: 1) энергию электрона в энергетическом состоянии 2) ориентацию электронной орбитали в пространстве 3) проекцию орбитального момента на направление поля IV. Спиновое квантовое число: ms = ½, – ½ Орбитальное и магнитное квантовые числа зависят от значения главного квантового числа. В атоме не может существовать двух электронов, у которых все 4 квантовых числа одинаковые.
13. Параметры химической связи. Энергия связи-кол-во энергии, выделяющейся при образовании ХС.[кДж/моль] С ↑кратности связи Есв ↑, а её длина . Для многоатомных соединений с однотипными связями за Есв принимают её ср значение, рассчитанное делением Е образ соединения из атомов на число связей. Чем Есв ↑, тем молекулы устойчивее. Длина связи-межъядерное расстояние. Зависит от размеров эл оболочек и степени их перекрывания. С lсв ↑Есв и ↑ устойчивость молекул. Прочность связи хар-ся lсв и Есв. Гибридизация эл орбиталей (валентные углы). Идея Полинга: Если у атома, вступающего в ХС имеются разные атомные орбитали, то в процессе образования ХС происходит смешение АО, т.е. из разных АО образуются одинаковые АО. Гибридные АО образуются у 1 атома, имеющего разные орбитали. Гибридизация происходит у орбиталей, имеющих близкие значения Е. Форма гибридной АО отлич от формы исходной АО. В гибридной АО Электронная смещена в 1 сторону от ядра при её взаим с АО др атомов происходит мах перекрывание , кот йприводит к ↑Есв. Это повышение компенсирует Е, требуемую на образование гибр орбитали. Нарисовать из тетр (*)!!!!!!!! |
7. Атомный спектр водорода. При нагреве в-во испускает лучи(излучение). Если излучение имеет одну длину волны, то оно наз-ся монохроматическим. В большинстве же случаев излучение х-ся неск=кими длинами волн. При разложении излучения на монохроматические компоненты получают спектр излучения, где отдельные его составные части выражаются спектральными линиями. Спектры, получающиеся при излучении свободными или слабо связанными атомами(н-р, в газах или парах), наз-ся атомными спектрами. Длины волн, соответствующие атомному спектру водорода, опред-ся уравнением Бальмера: 1/ = R(1/n^2 – 1/m^2)
17. Метод молекулярных орбиталей Согласно методу МО электроны в молекулах распределены по молекулярным орбиталям, кот подобно атомным орбиталям (АО) характеризуются определенной энергией (энергетическим уровнем) и формой. В отличие от АО молекулярные орбитали охватывают не 1 атом, а всю молекулу, т.е. являются двух- или многоцентровыми. В методе МО молекула рассматривается как единая система. Правила метода МО: 1. Число МО равно общему числу АО, из которых комбинируются МО 2. Энергия одних МО оказывается выше, других – ниже энергии исходных АО. Средняя энергия МО, полученных из набора АО, приблизительно совпадает со средней энергией этих АО. 3. Электроны заполняют МО, как и АО, в порядке возрастания энергии, при этом соблюдается принцип запрета Паули и правило Гунда 4. Наиболее эффективно комбинируются АО с теми ОА, которые характеризуются сопоставимыми энергиями и соответствующей симметрией. 5. Прочность связи пропорциональна степени перекрывания атомных орбиталей.
|
18. Метод валентных связей Метод ВС впервые был использован в 1927 г. В. Гейтлером и Ф. Лондономв методе ВС предполагается, что атомы в молекуле сохраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома. Гейтлер и Лондон показали, что при сближении 2 атомов водорода с антипараллельными спинами происходит энергии системы, что обусловлено ↑ электронной плотности в пространстве между ядрами взаимодействующих атомов. При сближении атомов с параллельными спинами энергия системы ↑ и молекула не образуется. Основные положения метода ВС: 1. Хим. связь между двумя атомами возникает в результате перекрывания атомных орбиталей с образованием электронных пар 2. Атомы, вступающие в хим. связь, обмениваются между собой электронами, которые образуют связывающие пары. 3. В соответствии с принципом Паули хим. связь образуется лишь при взаимодействии электронов с антипараллельными спинами 4. Характеристики хим. связи (энергия, длина, полярность и др.) определяются типом перекрывания атомных орбиталей Согласно теории ВС, ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей реагирующих атомов. Следует отметить, что электронная структура молекулы значительно отличается от электронной структуры образующих ее атомов.
19.Ионная связь. ИС-связь м/у ионами, осуществляемая электростатическим притяжением. ИС возникает при большой разности атомов, н-р м/у катионами s-металлов 1 и 2 групп и анионами неметаллов 6 и 7 групп(К2О,LiF,CsCl). NaCl: атомы с незавершёнными внешними электронными уровнями. Для заверения вн уровня Na легче отдать 1е, чем присоединить 7, а Cl легче присоединить 1е, чем отдать 7: Na-e=Na+, Cl+e=Cl-.Между Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется NaCl. Молекулы тлк в парообразном состоянии. в твёрдом состоянии ионные соединения состоят из закономерно расположенных + и – ионов. Молекулы в этом случае отсутствуют. Т.к. электрическое поле иона имеет сферический характер, то не свойственна направленность. Ненасыщаемость, т.к. ион способен взаимодействовать со многими соседними ионами противоположного знака, число кот зависит от зарядов ионов и соотношений геом размеров. Т.к. Iиониз>Есродства к е, то полного перехода е не бываетчисто ионной связи не существует. Доля ионоости.=2-связь ионная. |
9. ПСХЭ Д.И.Менделеева. Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от q ядер их атомов. Период-последовательный ряд элементов, размещённых в порядке ↑q атомов, электронная конфигурация кот изменяется от ns1 до ns2np6 (или до ns2 у первого периода). Периоды начинаются с s-элемента и заканчиваются р-элементом (у 1-го периода-s-элементом). Малые периоды содержат по 2 и 8 элементов, большие-18 и 32, 7 период не завершён. Каждый период, кроме 1, начинается щелочным металлом и заканчивается благородным газом. В ПСХЭ имеется 8 групп, что соответствует max числу е во внешних подоболочках. Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Группы делятся на главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами. К главным подгруппам (А) относятся подгруппы элементов второго периода: Li,Be,B,C,N,O,F и подгруппа благородных газов. К побочным (В) принадлежат d- и f-элементы. Первые шесть d-элементов (от Sc до Fe) начинают соответствующие подгруппы от подгр. III (Sc) до подгр.VIII (Fe). В подгр. VIII также включаются все элементы семейства железа (Fe, Co, Ni) и их аналоги-платиновые металлы. Медь и ее аналоги, имеющие во внешней s-оболочке по 1е, образуют первую побочную подгруппу. Лантаноиды и актиноиды (f-элементы) называют семейством и не относят к какой-л группе. Хим свойства элементов главных и побочных групп значительно различаются. Н-р, в VII группе главную подгруппу составляют неметаллы F,Cl,Br,I,At, побочную-металлы Мn,Tc,Re. Т.о., подгруппы объединяют наиболее сходные м/у собой элементы. Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
12. Свойства ковалентной связи: насыщаемость, направленность, гибридизация, кратность Особенностями ковалентной химической связи являются ее направленность и насыщаемость. Т.к. атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых веществах. Насыщаемость ковалентной связи называется ограничением числа e, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи. Число связей между атомами в методе валентных связей называется кратностью связи. Молекула с кратными связями имеет 2 или 3 общие электронные пары. Если у атома, вступающего в хим связь, имеются разные атомные орбитали (s, p, d или f), то в процессе образования химической связи происходит гибридизация (смещение) атомных орбиталей, т.е. из разных атомных орбиталей образуются одинаковые (эквивалентные) атомные орбитали. Гибридные атомные орбитали образуются у одного атома, имеющего разные орбитали. |
10. Периодичность изменения свойств элементов, радиусов, потенциалов ионизации, восстановительная способность окислителей, сродство к электрону, электроотрицательность
В периодах атомные
R
по мере ↑ заряда ,
т.к. при одинаковом числе электронных
слоев возрастает q
ядра, а следовательно, притяжение им
e.
Т.е. в периодах R
↑ слева направо. В пределах каждой
подгруппы элементов радиусы атомов
↑ сверху вниз, т.к. возрастает число
электронных уровней. Потенциал
ионизации
– энергия, кот необходимо применить
к атому, чтобы оторвать 1-ый, 2-ой и т.д.
ЭО по периоду -> увел, в группе умен.
21.Донорно-акцепторная связь. Комплексообразователь, его заряд, заряд комплексного иона. Электролитическая диссоциация. Комплексные соединения. Если одна из двух молекул(акцептор) имеет атом со свободными орбиталями, а другая(донор)-атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
где N
в соединении Донорно-акцепторная связь имеет место в комплексных соединениях.
Комплексные
соединения - сложные
соединения, у которых имеются ковалентные
связи, образованные по донорно-акцепторному
механизму.
Н-р:
КС состоят из
внутренней (в квадратных скобках) и
внешней (за скобками) сфер. Внутренняя
сфера наз-ся комплексным ионом.
Центральное место в комплексном ионе
занимает комплексообразователь(в
данном примере это
Электролитическая диссоциация. Пример:
|
||||||||||||||||||
|
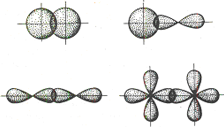
16.
Связь, образованная
перекрывание атомных орбиталей по
обе стороны линии, соединяющей ядра
атомов (боковые перекрывания), называется
Связь, образованная
перекрывание атомных орбиталей по
линии, соединяющей ядра соответствующих
атомов, называется
При наложении
При наложении
двух
|
22.Термодинамические параметры. 1854 Томсон понятие ТД. ТД изучает взаимное превращение Q в др виды Е. ТД имеет 2 особенности: изучает процессы вне пространства и времени; из немногочисленных общих положений методом дедукции получает опред соотношения, относящиеся к данному явлению. Е-общая мера кол-ва движения и взаимод всех видов материи. ТДС-мысленно выделенная из среды совокупность материальных объектов, где происходит обмен m и Е. Открытая-обмен m и Q; закрытая-телообмен,массы обмена нет; изолир. Т-интенсивность теплового движения микрочастиц, образующих систему, тепловое состояние системы. Q-мера Е, переданная от 1 тела к др за счёт разности tº. А-мера Е, переданная от 1 тела к др за счёт перемещения масс под действием сил. Р-параметр состояния системы, зависящий от внутр свойств состояния системы. Определяется натиском молекул на заключающий газ сосуд.[Р=F/S] f(T,P,V)=0-уравнение состояния системы. ТД параметры : на экстенсивные(зависят от m) и интенсивные(не зависят от m). При проведении ХР меняется U. U включает все виды энергии системы, кроме Ек движения системы, как целого, и Еп её положения. U хар-ет запас Е изолированной системы, зависит от состояния системы. U нельзя измерить. U представляет собой способность системы к совершению А или передаче Q. U можно определить при переходе из 1 состояния в др: U=U2-U1. U можно измерить с помощью А и Q, т.к. система может обмениваться с окруж средой веществом или Е в форме Q и А. U-экстенсивная ф-я(зависит от m).Физич смысл U: U=-Q (тепловой эффект при V=const, взятый с обратным знаком) |
23. Первый закон термодинамики в применении к изобарному, изохорному, изотермическому, адиабатическому процессам I закон термодинамики: теплота, подведенная к системе, тратится на изменение внутренней энергии и на работу расширения газа
1) изобарный процесс: Р=const
2) изохорный процесс: V=const
3) изотермический процесс: T=const
4) адиабатический
процесс:
Изменение внутренней энергии происходит за счет работы расширения газа |
26.Энтропия. Самопроизвольное протекание процессов. Энтропия-ТД ф-я, определяющая меру беспорядка в системе. Логарифмическая ф-я вероятности существования системы.S1=k•lnW1 S2=k•lnW2. S=k•ln(W2/W1). W-число микросостояний, в кот осуществляется данное макросостояние; вероятность упорядоченной системы. k-const Больцмана.[S=Дж/(моль•К)] Sг>Sж>Sтв. Чем S, тем вещество твёрже. Чем ↑молярная масса, тем ↑беспорядок, тем ↑S. аА+вВlL+dD+S298 хр S298 хр=(lS298 обр L + dS298 обр D)-(aS298 обр A + bS298 обр B) Самопроизвольные процессы-процессы, протекающие без подвода Е от вн источника. СП в обратном направлении не могут протекать самопроизвольно. Многие ХР протекают самопроизвольно(образование ржавчины, растворение соли в Н2О, диффузия). Большинство экзотермических р-й (Н<0) протекают самопроизвольно. Но условие Н<0 не явл критерием самопроизвольного течения ХР, т.к. самопроизвольные эндотермич ХР, у кот Н>0(растворение некоторых солей в Н2О). Движущей силой самопроизвольного течения процесса явл стремление частиц к хаотичному движению, а системы- к переходу от более упорядоченного состояния к менее упорядоченному. Н-р, если 2 сосуда с индивидуальными жидкостями соединить друг с другом через отверстие, то через некоторое время произойдёт смешение жидкостей, система из более упорядоченного состояния перейдёт в менее упорядоченное(смесь жидкостей). Процесс идёт самопроизвольно, если S>0, G<0. Самопр идут проц в сторону ↑ беспор в системе.
|
27. Энергия Гиббса, Гельмгольца. II закон термодинамики. Энергия Гиббса - критерий самопроизвольного протекания ХР. G=Н-ТS, где Н-теплота, подведённая к системе; ТS- (энтропийный фактор) бесполезное тепло, тепло, кот переходит к холодильнику. ХР возможна, если G<0. G>0-р-я не может протекать самопроизвольного. G=0-р-я обратима. G зависит от хар-ра р-ии(Н и S), от Т. Изменение эн Гиббса системы при образовании 1 моль вещ-ва В из простых в-в, устойчивых при 298К, наз-ся энерг Гиббса образования вещ-ва В. DGобр прост вещ-ва=0. Энергия Гиббса ХР: aA(тв)+bB(тв)lL(ж)+dD(г)+DG298 хр DG298хр=(lDG298обрL(ж)+dDG298обрD(г))- (aDG298обрa(тв)+bDG298обрB(тв)) Энергия Гельмгольца: DF=DН-TDS. Хар-ет направление и предел самопроизвольного течения ХР при изохорно-изотермических условиях, кот возможно при DF<0. II закон термодинамики: Томсон: невозможно Q какого-л тела превратить в А, не произведя никакого др действия кроме охлаждения этого тела. В изолированных системах самопроизвольно идут только такие процессы, еот сопровождаются ↑энтропии: DS>0. |
|
|||||||||||||||||