
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Модельные представления о строении двойного электрического слоя.
1. Первой моделью двойного электрического слоя была модель, предложенная Г.Гельмгольцем (1853 г.). Он предположил, что двойной электрический слой представляет собой конденсатор, расстояние между обкладками которого, равно радиусу иона. Эта модель правильно предсказывала ёмкость двойного электрического слоя, объясняла форму электрокапиллярных кривых, но не могла объяснить зависимости ёмкости и пограничного натяжения от концентрации раствора, напряжения и температуры.
2. Теория Ж.Гюи (1910г) и Д.Чапмэна (1913г) (теория диффузного двойного слоя). Согласно этой теории нескомпенсированные заряды размываются вследствие теплового движения. Теория частично соответствует современным представлениям, однако получаемые с её помощью значения ёмкости отличается на 6 – 7 порядков величины.
3. Теория О.Штерна (1924г). Согласно этой
теории двойной слой состоит из двух
частей: плотной (толщиной X1)
(внутренняя плоскость Г Гельмгольца,
радиус специфически адсорбированного
иона), и слоя толщинойX2(внешняя плоскость Г.Гельмгольца, радиус
гидратированного иона). Общая толщина
слояX2приблизительно 3 – 4![]() .
В слоеX2имеет место ориентация диполей
растворителя, как под действием
электрического поля растворителя, так
и в результате специфического
взаимодействия с металлом. За пределами
внешней плоскости Г.Гельмгольца находится
диффузная часть двойного слоя,
обусловленная наличием различных
зарядов вследствие теплового движения.
Эта часть простирается до расстояний
приблизительно в 10
.
В слоеX2имеет место ориентация диполей
растворителя, как под действием
электрического поля растворителя, так
и в результате специфического
взаимодействия с металлом. За пределами
внешней плоскости Г.Гельмгольца находится
диффузная часть двойного слоя,
обусловленная наличием различных
зарядов вследствие теплового движения.
Эта часть простирается до расстояний
приблизительно в 10![]() .
.
Электрическое поле существует только в двойном электрическом слое, но это электрическое поле чрезвычайной высокой напряжённости 107В/м. Такие напряжённости107В/м. являются следствием очень малых размеров двойного электрического слоя. Однако существуют растворы, в которых размеры двойного слоя велики и могут измеряться в миллиметрах и даже в сантиметрах. Это растворы очень слабо проводящих жидкостей (масла, органические жидкости и т.д.).
Вопросы и задачи
Используя справочные данные, определить напряжение ячейки, состоящей из кадмиевого электрода в 0,001М растворе NaFи насыщенного хлорсеребряного электрода, при котором поверхностный заряд кадмиевого электрода будет отсутствовать.
Используя справочные данные, определить знак (положительный или отрицательный) заряженной поверхности ртути в 1М растворе KClпри потенциале – 1,0В относительно насыщенного хлорсеребряного электрода.
Определить знак заряда поверхности платины в 0,002М растворе Na2SO4приpHи потенциале 0В относительно насыщенного каломельного электрода.
Определить напряжение ячейки, включающей насыщенный каломельный электрод и платиновый электрод, находящийся в равновесии с системой Co3+/Co2+при эквивалентных концентрациях окисленной и восстановленной форм.
Определить напряжение ячейки, включающей кадмиевый электрод в растворе его соли с концентрацией, равной 0,1 г-ион/л и насыщенный хлорсеребряный электрод.
Лекция 9. Поляризация и перенапряжение
Методы измерения потенциала под током. Гальваностатический (гальванодинамический) и потенциостатический (потенциодинамический) методы получения поляризационной кривой. Стадии гетерогенной реакции. Понятие лимитирующей стадии. Классификация перенапряжений.
Ранее был рассмотрен медно-цинковый гальванический элемент с напряжением U≈ 1,1 В. Как изменится измеренное значение напряжения этого элемента, если его измерить приборами с разными входными сопротивлениями? При проведении измерений прибором с высоким входным сопротивлением (например, мостом постоянного тока или ламповым вольтметром) и вольтметром с низким входным сопротивлением мы получим разные значения напряжений. Если в системе протекает ток, то потенциал будет смещаться от равновесного значения (рис. 9.1). В.Нернстом было введено понятиеперенапряжения(overpotential). Перенапряжениеопределяется как разность между потенциалом под током(i) и равновесным потенциалом, который определяется по уравнению В. Нернста. Потенциал под током всегда будет отличаться от равновесного значенияр, причем чем больше будет величина проходящего тока, тем больше будет отличие (и наоборот).
Таким образом, можно записать:
![]() , (9.1)
, (9.1)
где
![]() - перенапряжение.
- перенапряжение.

Рис. 9.1. Изменение потенциала под током.
Разница между потенциалом под током и потенциалом обесточенного электрода называется поляризацией. Зависимость тока (плотности тока) от потенциала или перенапряжения называется поляризационной зависимостью. Обычно эта зависимость нелинейна (рис. 9.2).

Рис. 9.2. Различные формы поляризационных кривых.
Для того чтобы измерить потенциал (перенапряжение) необходимо измерить потенциал под током или ток при определённом потенциале. Приборы, которые позволяют осуществить подобные измерения, называются потенциостатами (гальваностатами). При использовании потенциостатического метода измерений задаётся потенциал электрода относительно стандартного электрода сравнения и измеряется ток (плотность тока) рабочего (исследуемого) электрода. Такой метод называется потенциостатическим. Возможен и другой метод, при котором задается ток (плотность тока), а измеряется потенциал. Такой метод называется гальваностатическим. В том случае, когда потенциал или ток электрода изменяются с определённой скоростью, метод измерений носит название потенциодинамического (гальванодинамического) метода.
Подобные измерения важны потому, что в одних и тех же условиях гальваностатический (гальванодинамический) и потенциостатический (потенциодинамический) методы могут давать разные результаты.
Например: в случае поляризационной кривой, изображенной на рис. 9.3 одной величине тока i1соответствуют, как минимум, три значения получаемых потенциалов.

Рис. 9.3. Возможность получения различных значений потенциалов при гальваностатическом методе измерения зависимости плотности тока от потенциала
Совершенно очевидно, что в этих условиях приемлемым методом является только потенциостатический или потенциодинамический метод. Очевидно также, что и потенциостатический и гальваностатический методы можно использовать только при применении трёхэлектродной ячейки. Один из электродов при этом является рабочим (анодом или катодом), а другой – электродом сравнения (водородный, хлорсеребряный, каломельный и др.). Третьим же электродом является вспомогательный электрод, обеспечивающий прохождение тока через ячейку. При этом разница потенциалов под током между рабочим электродом и электродом сравнения измеряется прибором с высоким входным сопротивлением (высокоомным вольтметром). Это означает, что ток в цепи рабочего электрода и электродов сравнения пренебрежимо мал по сравнению с током между рабочим электродом и вспомогательным. Меняя ток или потенциал между рабочим электродом и электродом сравнения (вспомогательным электродом) и измеряя ток (потенциал), можно получить зависимость плотности тока от перенапряжения, т.е. зависимость скорости электродной реакции и соответственно скорости, например, электрохимической обработки от потенциала.
Сам электрохимический процесс состоит из нескольких стадий, однако, как правило, только одна из стадий (самая медленная) определяет скорость реакции. Такая стадия носит название лимитирующей. Именно она определяет общую скорость электрохимического процесса.
Чтобы увеличить скорость процесса необходимо, прежде всего, воздействовать на лимитирующую стадию.
В электрохимических процессах лимитирующими могут быть следующие стадии:
Стадия перехода (переноса заряда).
Стадия химической реакции (которая предшествует или следует после стадий переноса заряда).
Стадия диффузии (конвективной диффузии) – подвод или отвод реагента (продуктов реакции) от (к) поверхности электрода.
Стадия кристаллизации (при электроосаждении или образовании кристаллических анодных пленок).
Стадия адсорбции.
Если какая-либо из этих стадий будет определять скорость всей (общей) реакции, то тогда перенапряжение будет определяться этой стадией. Поэтому для стадии 1 -это перенапряжение перехода (переноса заряда). Для стадии 2 -это перенапряжение реакции. Для стадии 3 -это перенапряжение диффузии. Соответственно перенапряжение кристаллизации и адсорбционное перенапряжение. Сумма перенапряжений реакции и диффузии (конвективной диффузии) носит название концентрационного перенапряжения.
Для каждого из видов перенапряжения характерны свои особенности, и их надо знать, чтобы иметь возможность воздействовать на лимитирующую стадию и тем самым управлять скоростью электрохимической реакции.
Лекция 10 Диффузионная кинетика.
Распределение концентраций в пограничном слое. Стационарная диффузия в условиях естественной и вынужденной конвекции. Вращающийся дисковый электрод и его применение. Вращающийся цилиндрический электрод и другие системы с известным распределением концентраций в пограничном слое.
Ранее было показано, что электрохимическая ячейка или электрохимическая цепь может работать либо как электролизёр, либо как источник тока.
В первом случае электрическая энергия, поступающая от внешнего источника тока, затрачивается на проведение каких - либо электрохимических реакций. Благодаря ним могут осуществляться электрохимическая размерная обработка металлов, электроосаждение слоёв на поверхности какого - либо изделия, электрохимический синтез каких - либо материалов, электролитическое получение газов (водорода, кислорода, хлора и других).
Во втором случае происходит использование электрохимических реакций с целью получения электрического тока, т.е. электрохимические реакции, происходящие на границе электрод – электролит могут использоваться как генераторы электроэнергии (батареи, аккумуляторы, топливные элементы).
Под током общее напряжение ячейки всегда отличается от напряжения в отсутствие тока, т.е.:
![]() (10.1)
(10.1)
В первом случае, т.е. когда электрохимическая ячейка работает как электролизёр:
![]() (10.2)
(10.2)
Во втором случае (ячейка является источником тока):
![]() (10.3)
(10.3)
То есть реализуемая мощность источника тока всегда меньше его теоретической мощности:
![]() (10.4)
(10.4)
Для случая, когда система работает как электролизёр, можно записать:
![]() (10.5)
(10.5)
Таким образом, всегда есть дополнительное падение напряжения, необходимое для того, чтобы можно было осуществить реакцию с конечной скоростью. И это дополнительное падение напряжения тем больше, чем больше величина плотности тока на электроде, и связана она, как ясно из вышеприведённого, с перенапряжением.
Первый вид перенапряжения, которое будет рассмотрено, это - перенапряжение, обусловленное разницей концентраций на поверхности электрода и в объёме раствора. Разница концентраций всегда приводит к наличию переноса массы (массопереноса).
Существуют три механизма массопереноса:
молекулярная диффузия; движущая сила этого процесса – разница (градиент) концентрации;
миграция (перенос в электрическом поле);
Конвекция (перенос частиц в связи с движением раствора, его перемешиванием); в условиях отсутствия перемешивания перенос осуществляется посредством естественной конвекции, обусловленной градиентом плотности раствора.
В случае наличия градиента концентрации возникает поток диффузии jD, обусловленный разницей концентрации:
![]() (первый закон Фика) (10.6)
(первый закон Фика) (10.6)
Подставляя в уравнение для закона Фарадея это соотношение, покажем, что в том случае, когда скорость электрохимической реакции определяется диффузией (т.е. лимитирующей стадией суммарного электрохимического процесса является диффузия), мы можем написать:
![]() (10.7)
(10.7)
Уравнение (10.7) - основное уравнение
диффузионной кинетики, т.е. такого
электрохимического процесса, который
определяется скоростью диффузии. При
этом все его стадии предполагаются
равновесными, а неравновесной является
только диффузионная стадия. В этом
случае должен существовать некоторый
слой толщиной
![]() ,
в котором будет наблюдаться разность
концентраций (см. рис. 10.1). Поверхностная
концентрация
,
в котором будет наблюдаться разность
концентраций (см. рис. 10.1). Поверхностная
концентрация![]() будет
изменяться при изменении потенциала,
потому что будет увеличиваться скорость
окисления (восстановления) при росте
потенциала.
будет
изменяться при изменении потенциала,
потому что будет увеличиваться скорость
окисления (восстановления) при росте
потенциала.
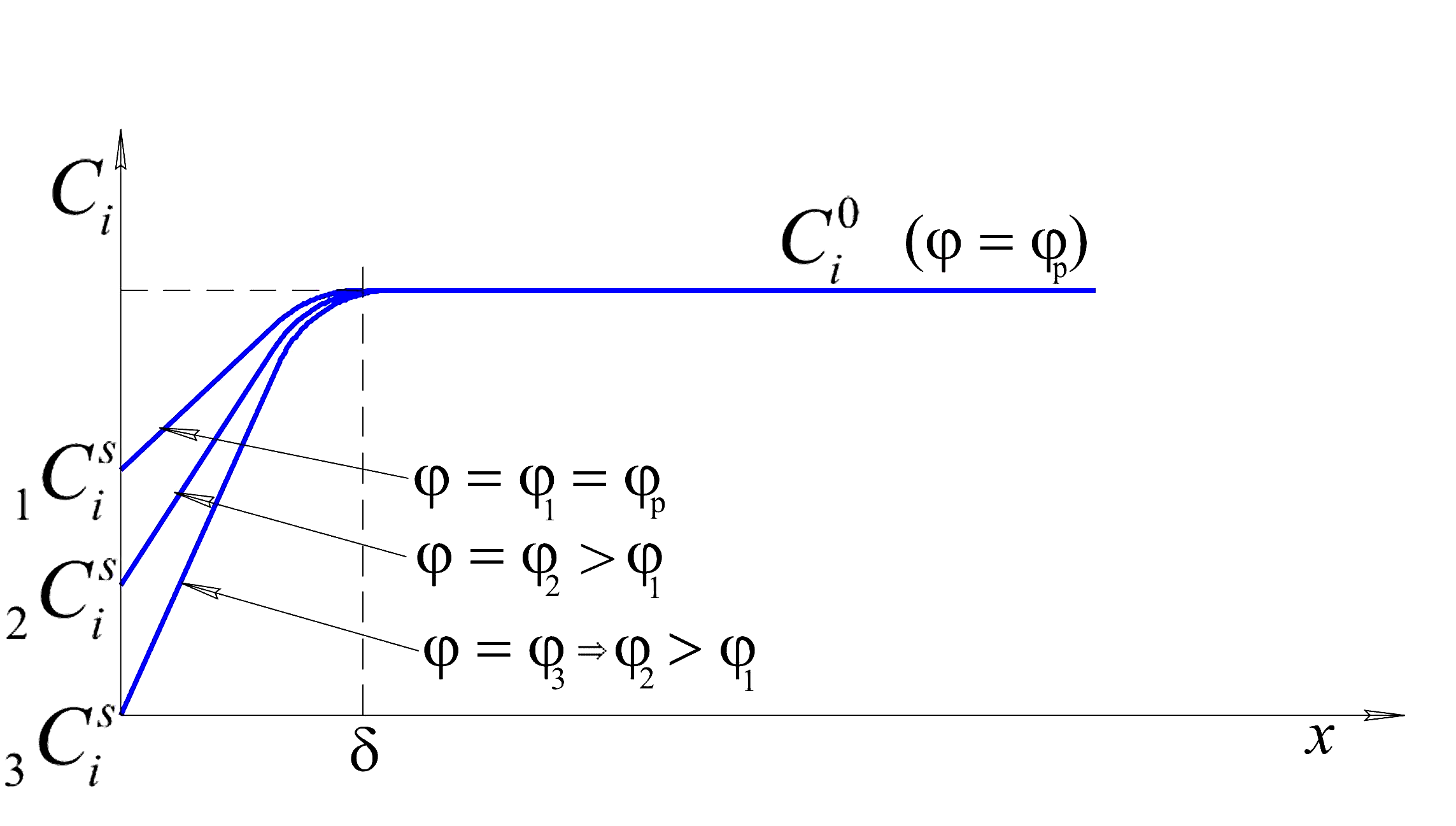

Рис. 10.1 Распределение
концентрации у поверхности
электрода,![]() -объёмная
концентрация компонента электролита,
который восстанавливается или окисляется
на поверхности электрода.
-объёмная
концентрация компонента электролита,
который восстанавливается или окисляется
на поверхности электрода.![]() -поверхностная
концентрация того же компонента,
зависящего от приложенного потенциала
-поверхностная
концентрация того же компонента,
зависящего от приложенного потенциала
Для этой концентрации по уравнению
Нернста может быть рассчитан равновесный
потенциал. В отсутствие тока никаких
изменений концентрации происходить не
будет. При появлении тока в процессе
электроосаждения непосредственно на
поверхности концентрация снизится,
потому что часть ионов перейдёт в
металлическую фазу. Область, в которой
будет наблюдаться это изменение,
обозначается буквой
![]() и
носит название диффузионного пограничного
слоя. Этот процесс будет происходить
при
и
носит название диффузионного пограничного
слоя. Этот процесс будет происходить
при![]() .
.
Очевидно, что:
всегда будет существовать некий слой, величиной
 ,который
называется диффузионным пограничным
слоем, внутри которого концентрация
будет отличаться от объёмной;
,который
называется диффузионным пограничным
слоем, внутри которого концентрация
будет отличаться от объёмной;градиент концентрации будет тем выше, чем в большей степени потенциал будет отличаться от равновесного или, чем большую плотность тока мы будем пропускать через ячейку;
должно существовать предельное состояние, при котором, как видно из рис. 10.1, поверхностная концентрация (концентрация на поверхности
 )
станет равной нулю.
)
станет равной нулю.
Понятие о диффузионном слое впервые было введено В.Нернстом. Учитывая вышеизложенное и уравнение (10.7), можно записать:
![]() (10.8)
(10.8)
или в предельном случае при
![]() ,
получим:
,
получим:
![]() (10.9)
(10.9)
Из уравнения (10.8) и (10.9) следует, что величина диффузионного тока (плотности тока) обратно пропорциональна толщине диффузионного слоя. В общем случае толщина диффузионного слоя зависит от температуры и вязкости раствора, от скорости его перемешивания и от координаты на поверхности электрода, т.е. его толщина может быть различной для разных точек поверхности электрода.
В том случае, если происходит анодное растворение металла, поверхностная концентрация будет более высокой, чем объёмная концентрация, поскольку ионы не будут успевать отводиться от поверхности (рис. 10.2).
1
![]()
Рис. 10.2 Распределение концентраций в диффузионном слое при растворении электрода (увеличение поверхностной концентрации при увеличении потенциала).
Согласно уравнению (10.9) предельное значение плотности тока связано с установлением на поверхности таких условий, когда достигается предельное значение поверхностной концентрации ионов. При электроосаждении это нулевая концентрация. При анодном растворении это очень часто концентрация насыщения, определяемая достижением произведения растворимости.
