
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Экспериментальное определение электропроводности.
Значение электропроводности нельзя определять аналогично тому, как она определяется в проводниках первого рода (металлах). Связано это с тем, что необходимо создавать условия, при которых gradi= 0. Это обусловлено наличием градиента химического потенциала, который обязательно вызовет дополнительную диффузию ионов, не связанную с электропроводностью. Поэтому для экспериментального измерения электропроводности используется переменный ток при частоте от 1 кГц и выше. Диффузией при измерениях электропроводимости можно пренебречь, если использовать мостовую схему, приведённую на рисунке 6.1.

Рис. 6.1 Схема моста переменного тока.
В состоянии баланса (при отсутствии
напряжения на нуль – индикаторе)
выполняется соотношение
![]() .
.
Состояние баланса достигается варьированием сопротивлением RMпри постоянных значенияхR1 иR2(Rx –это сопротивление исследуемого электролита). Как и для обычных металлических проводников, сопротивление растворов можно рассчитать по формуле:
![]() , (6.9)
, (6.9)
- удельное сопротивление материала; l– длина проводника;S– площадь поперечного сечения. В случае измерения электропроводности растворовS– площадь электродов, аl расстояние между ними (рис. 6.2).

Рис. 6.2 Схема ячейки для измерения электропроводности
Таким образом, определив значение Rx по данной схеме и используя уравнение(6.9), можно рассчитать величину удельного сопротивления электролита. Обычно в справочниках приводится обратная величина- удельная электропроводимость электролита.
.
![]() (6.10)
(6.10)
Из (6.9) и (6.10) получаем:
![]() (6.11)
(6.11)
Размерность удельной электропроводности Ом-1см-1или Смм-1(См – сименс).
Удельная электропроводность – это электропроводимость раствора, заключённого между двумя параллельными электродами, имеющими площадь 1м2и расположенными на расстоянии 1м друг от друга.
Если с использованием схемы, приведённой на рис. 6.1, определить удельные электропроводности различных растворов в зависимости от их концентрации, то можно наблюдать следующую зависимость (рис. 6.3).
При максимальном разбавлении раствора величина его удельной электропроводности стремится к удельной электропроводности чистой воды (~ 10-5См/м).
Как видно из рисунка 6.3 зависимость электропроводности от концентрации, как правило, имеет максимум. Вследствие ион – ионного взаимодействия ее величина снижается при высоких концентрациях. Наличие такой аномальной зависимости делает неудобным использование величин удельной электропроводности, поэтому целесообразно ввести понятие эквивалентной электропроводности, которое обозначается буквой и определяется соотношением:
![]() (6.12)
(6.12)
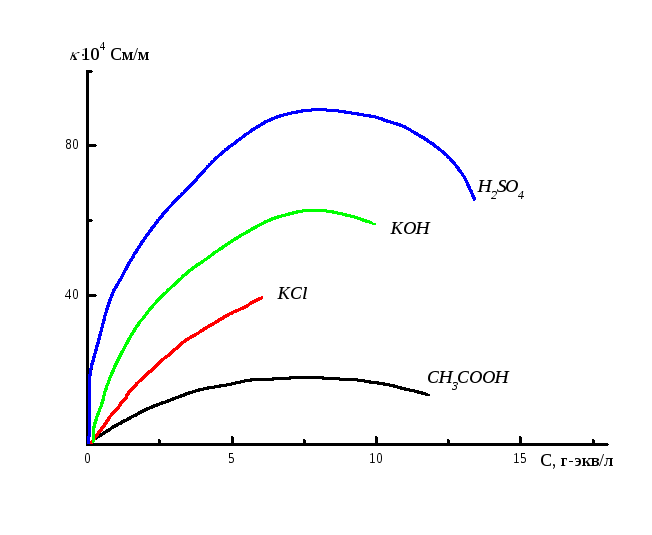
Рис. 6.3 Зависимость удельной электропроводности от концентрации растворов.
Согласно (6.12) эквивалентная электропроводность является удельной электропроводностью отнесенной к единице концентрации раствора. Она представляет собой электропроводность объёма электролита, содержащего 1г - эквивалент растворённого вещества, находящегося между двумя параллельными электродами, расположенными на расстоянии 1м друг от друга (размерность м 2/Омг - экв.).
Если бы потоки миграции не зависели от ион – ионного взаимодействия, то сохраняло бы постоянство при всех концентрациях. Однако при высоких концентрациях эквивалентная электропроводность не постоянна (рис. 6.4). При бесконечном разбавлении раствора, она стремится к своему постоянному значению.

Рис. 6.4 Зависимость эквивалентной электропроводности от разбавления.
Существует связь между эквивалентной электропроводностью и абсолютной скоростью движения ионовUi.
![]() , (6.13)
, (6.13)
где - степень
диссоциации и![]() ,
аU+, U-- абсолютные подвижности катиона и
аниона.
,
аU+, U-- абсолютные подвижности катиона и
аниона.
Величины +и-носят названияподвижностей ионов.Для сильных электролитов (= 1):
![]() (6.14)
(6.14)
При бесконечном разбавлении:
![]() , (6.15)
, (6.15)
где
![]() и
и![]() - предельные подвижности ионов.
- предельные подвижности ионов.
Таблица 6.1
Предельные подвижности ионов в воде при различных температурах.
|
Ион |
| ||||
|
0С |
18С |
25С |
45С |
100С | |
|
Li+ Na+ K+ [(CH3)4N]+ [(C2H5)4N]+ |
19,4 26,5 40,7 24,4 16,4 |
32,8 42,8 63,9 40 28,2 |
38,7 50,1 73,5 44,9 32,7 |
58 73,7 103,5 - - |
115 145 195 - - |
|
F– Cl– Br– I- CH3COO- |
- 41 42,6 41,4 20,1 |
47,3 66 68 66,5 35 |
65,4 76,4 78 76,8 40,9 |
- 108,9 110,7 108,6 - |
- 212 - - - |
Из приведенных в таблице 6.1 значений подвижностей ионов следует, что наблюдается:
увеличение подвижности ионов с увеличением температуры (в отличие от металлов);
увеличение подвижности ионов с ростом кристаллографических радиусов ионов, однако, разветвленное строение иона приводит к ее снижению.
Противоречие между увеличением подвижности иона и величиной его кристаллографического радиуса чисто кажущееся. Если рассматривать поведение гидратированного иона по аналогии с шаром в жидкости, то согласно закону Стокса скорость его движения обратно пропорциональна радиусу
![]() , (6.16)
, (6.16)
где P– давление;- динамическая вязкость иr– радиус шара.
Кроме того, чем меньше радиус иона, тем большее поле он создаёт, а, следовательно, больше гидратирован. Таким образом, совместное влияние уравнения (6.16) и гидратации иона имеет в качестве своего следствия наличие максимальной электропроводности у ионов большего кристаллографического радиуса. Для многих растворов характерно эмпирическое правило Вальдена – Писаржевского.
![]() (6.17)
(6.17)
