
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Лекция 11 Теория замедленного разряда.
Стадия массопереноса присуща любым гетерогенным реакциям, но в электрохимических процессах происходит еще и переход заряженных частиц через границу раздела. Если эта стадия является лимитирующей, то соответствующее этому процессу перенапряжение называется перенапряжением перехода (перенапряжение разряда - ионизации). В этом случае замедленной является собственно электрохимическая стадия.
Долгое время считалось, что скорость переноса заряда (электрона) не может быть замедленной, поскольку ее скорость всегда существенно выше, чем скорость любой другой стадии всего процесса. Только в 1930г. М.Фольмер (Германия) и Т.Эрдей - Груз (Венгрия) сформулировали теорию замедленного разряда, позволяющую объяснить такую возможность. В 1933г. эта теория была усовершенствована А.Н.Фрумкиным, который учёл влияние электрического поля двойного слоя на перенос заряженных частиц.
Рассмотрим электрохимическую реакцию восстановления:
![]() (11.а)
(11.а)
Общий ток (плотность тока, скорость реакции)будет определяться уравнением(11.1)
![]()
![]() (11.1)
(11.1)
При равновесном потенциале
![]() ,
следовательно:
,
следовательно:
![]() (11.2)
(11.2)
Этот ток (плотность тока)
![]() носит название тока обмена (точнее,
плотности тока обмена). Это одна из
важнейших характеристик электрохимической
реакции. Чем выше плотность тока обмена,
тем с большей скоростью происходит как
прямая реакция (восстановление) так и
обратная (окисление), т.е. быстро
восстанавливается равновесие. Реакции
с высокими плотностями тока обмена
называются обратимыми в отличие от
реакции с низкими плотностями тока
обмена, которые называются необратимыми.
носит название тока обмена (точнее,
плотности тока обмена). Это одна из
важнейших характеристик электрохимической
реакции. Чем выше плотность тока обмена,
тем с большей скоростью происходит как
прямая реакция (восстановление) так и
обратная (окисление), т.е. быстро
восстанавливается равновесие. Реакции
с высокими плотностями тока обмена
называются обратимыми в отличие от
реакции с низкими плотностями тока
обмена, которые называются необратимыми.
При лимитирующей стадии разряда – ионизации (реакция 11.а) нарушается само электродное равновесие и уравнение Нернста, которое справедливо для равновесных процессов, не может быть использовано для расчёта электродных потенциалов.
М.Фольмер и Т.Эрдей – Груз показали, что в этом случае величина плотности тока (скорости реакции) определяется следующим соотношением:
![]() , (11.3)
, (11.3)
где
![]() и
и![]() -
константы скорости прямой и обратной
реакции, соответственно катодной
(восстановления) и анодной (окисления),
-
константы скорости прямой и обратной
реакции, соответственно катодной
(восстановления) и анодной (окисления),![]() и
и![]() -
концентрации восстановленной формы и
окисленной формы,
-
концентрации восстановленной формы и
окисленной формы,![]() - коэффициент переноса.
- коэффициент переноса.
Для обычных реакций
![]() ,
однако, этот коэффициент зависит от
перенапряжения и при высоких или низких
значениях этого параметра он может
принимать значения от 0 до 1. Учитывая,
что в состоянии равновесия:
,
однако, этот коэффициент зависит от
перенапряжения и при высоких или низких
значениях этого параметра он может
принимать значения от 0 до 1. Учитывая,
что в состоянии равновесия:
![]() (11.4)
(11.4)
и, что:
![]()
![]() (11.5)
(11.5)
получим из (11.3):
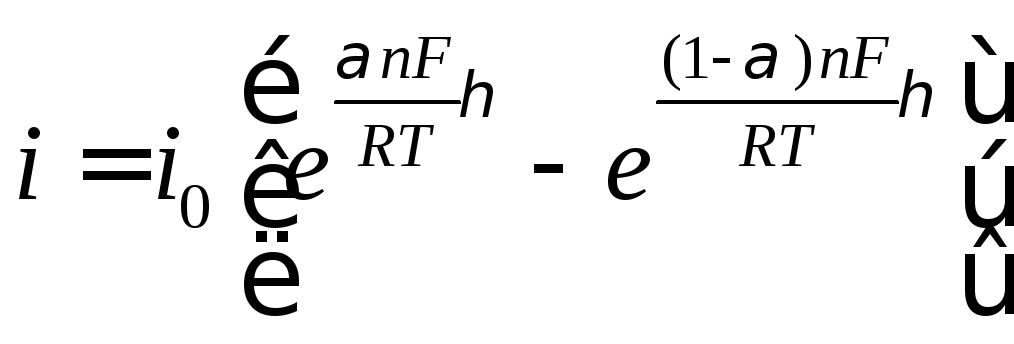 (11.6)
(11.6)
Из уравнения (11.6) следует, что скорость
электрохимической реакции прямо
пропорциональна плотности тока
обмена и разнице двух экспоненциальных
членов, содержащих перенапряжение. То
есть, скорость электрохимической реакции
определяется: плотностью тока обмена,
перенапряжением и коэффициентом
переноса. Соотношение (11.6) справедливо,
если
![]() и
и![]() не
зависят от плотности тока или потенциала,
т.е. в отсутствие замедленности стадии
массопереноса.
не
зависят от плотности тока или потенциала,
т.е. в отсутствие замедленности стадии
массопереноса.
Свойства уравнения теории замедленного разряда.
1.
![]() .
В этом случае:
.
В этом случае:
![]() (11.7)
(11.7)
или
![]() (11.8)
(11.8)
Уравнение (11.7) следует из уравнения (11.6) при малых перенапряжениях. В этом случае соответствующая экспоненциальная зависимость примерно может быть заменена линейной, типа (11.7) из которой следует (11.8).
Из уравнения (11.7) и (11.8) следует, что при малых перенапряжениях поляризационная характеристика при замедленности стадии переноса заряда линейна, а величина
![]() (11.9)
(11.9)
носит название сопротивления стадии
разряда - ионизации. Как видно, оно тем
меньше, чем выше плотность тока обмена.
При плотности тока обмена
![]() мы имеем, так называемый, идеально
неполяризуемый электрод, но только за
счёт стадии разряда - ионизации. При
мы имеем, так называемый, идеально
неполяризуемый электрод, но только за
счёт стадии разряда - ионизации. При![]() электрод будет идеально поляризуемым.
Потенциал такого электрода может быть
смещён от равновесного значения
чрезвычайно малым током.
электрод будет идеально поляризуемым.
Потенциал такого электрода может быть
смещён от равновесного значения
чрезвычайно малым током.
Электроды сравнения обычно изготавливаются таким образом, чтобы при изменении плотности тока потенциал не изменялся, не отличался от своего равновесного значения, иными словами, они изготавливаются на основе систем с большими плотностями тока обмена.
На рисунке 11.1 показаны схематически системы с большими плотностями тока обмена (1) и малыми (2).

Рис. 11.1 Зависимость между плотностью тока и перенапряжением для идеально неполяризуемого (1) и идеально поляризуемого (2) электродов
2.
![]() В этом случае можно пренебречь скоростью
обратной электрохимической реакцией,
и записать:
В этом случае можно пренебречь скоростью
обратной электрохимической реакцией,
и записать:
![]() (11.10)
(11.10)
Из (11.10) получаем:
![]() , (11.11)
, (11.11)
откуда следует, что:
![]() (11.12)
(11.12)
Если ввести обозначения, что
![]() ,
а
,
а![]() ,
получим, что:
,
получим, что:
![]() (11.13)
(11.13)
Уравнения типа (11.13) называются уравнениями Тафеля. И.Тафель впервые в 1905г экспериментально получил зависимость (11.13) для реакции выделения водорода.
Как видно, подобная зависимость может
быть следствием замедленности стадии
переноса заряда. Константа bпоказывает насколько нужно сместить
потенциал электрода, чтобы увеличить
скорость реакции на порядок. Одновременно,
зная коэффициентa,
можно определить плотность тока обмена.
Из уравнения (11.13) следует, что при
замедленности стадии переноса заряда
зависимость плотности тока от
перенапряжения будет линейной в
полулогарифмических координатах![]() .
Обычно поляризационные кривые строятся
именно таким образом.
.
Обычно поляризационные кривые строятся
именно таким образом.
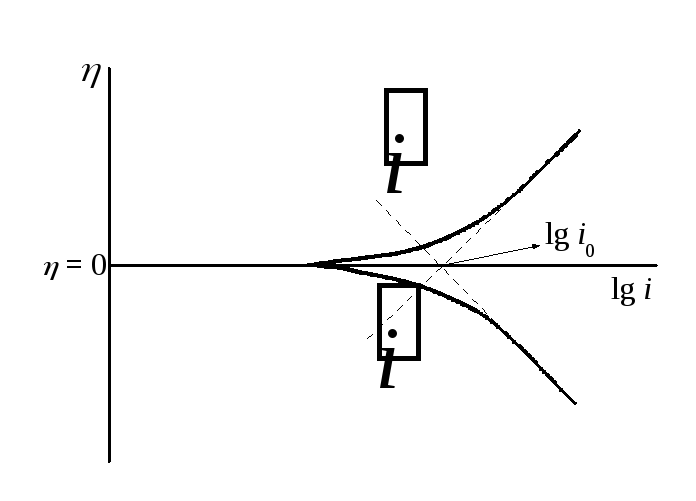
Рис. 11.2 Поляризационные кривые для стадии разряда ионизации в полулогарифмических координатах
Из рис. 11.2 видно, что плотность тока
обмена можно получить экстраполяцией
анодной и катодной тафелевских кривых
при равновесном потенциале
![]() .
Из этого же графика видно, что скорость
реакции при заданном перенапряжении
будет тем больше, чем меньше наклон
поляризационной кривой относительно
оси перенапряжения. В пределе может
быть достигнута предельная скорость
процесса, не зависящая от перенапряжения.
Это связано с изменением коэффициента
переноса
.
Из этого же графика видно, что скорость
реакции при заданном перенапряжении
будет тем больше, чем меньше наклон
поляризационной кривой относительно
оси перенапряжения. В пределе может
быть достигнута предельная скорость
процесса, не зависящая от перенапряжения.
Это связано с изменением коэффициента
переноса![]() .
.

Рис. 11.3 Поляризационная кривая в широком интервале перенапряжения. I - область безбарьерного разряда, II -область обычного разряда, III -область безактивационного разряда.
Таким образом, существует три типа
электродных процессов, медленной стадией
которых является стадия разряда:
безборьерные
![]() ,
обычные
,
обычные![]() и безактивационные
и безактивационные![]() .
.
Как видно из рис. 11.3, область безактивационного разряда – ионизации наблюдается при очень высоких плотностях тока. Экспериментально такие процессы не были зарегистрированы. Однако регистрация процессов с низкими значениями была зафиксирована в экспериментах, что косвенно подтверждает возможность существования и безактивационных процессов.
В последнем случае изменением перенапряжения нельзя увеличить скорость реакции. Представление поляризационных зависимостей в форме, показанной на рис. 11.2 и рис. 11.3, на которых функцией является lgi, а аргументом перенапряжение не является общепринятым. Часто можно использовать обратную зависимость, при которой функцией является перенапряжение, а аргументомlgi. Как правило, выбор подобных зависимостей определяется тем, что задаётся в эксперименте: плотность тока или перенапряжение, т.е какой метод используется: потенциостатический (потенциодинамический) или гальваностатический (гальванодинамический).
