
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Классификация основных процессов переноса при химической и электрохимической технологии
Электрохимические технологии могут рассматриваться, как часть химических технологий или разновидность металлообработки, методов органической или неорганической химии и др.
В зависимости от основных законов, определяющих скорость протекания процессов, различают:
механические процессы: основой их является механическое воздействие на исходный материал, как в промежуточных процессах, так и на конечной его стадии (например, грубое и тонкое шлифование, удаление окалины, механическое дробление руды и др.); описываются законами механики твёрдого тела;
гидромеханическиепроцессы, скорость которых определяется законами гидродинамики - науки о движении газов и жидкостей; движущей силой является гидростатическое и гидродинамическое давление; к гидромеханическим процессам относятся циркуляция, перемешивание жидкостей (о которых говорилось выше), разделение жидких неоднородных систем под действием сил тяжести (применяется в станках ЭХРО) и др.;
массообменные процессы; движущая сила – разность концентраций; разделяются молекулярная диффузия (это диффузия в пористых электродах и в приэлектродных слоях), конвективная диффузия и диффузия при естественной конвекции;
теплообменные процессыопределяются законами теплопередачи – науки о закономерностях распределении тепла; движущая сила – разность температур. Скорость тепловых процессов зависит от гидродинамических условий;
химические процессы; определяются законами химической кинетики – науки о скоростях химических реакций; движущая сила – разность химических потенциалов реагирующих веществ;
электрохимические процессы;определяются законами электрохимической кинетики, о которых столько говорили ранее; движущая сила – разность электрохимических потенциалов.
Во всех этих системах осуществляются процессы переноса, и поэтому основой химических и электрохимических технологий является, прежде всего, наука о процессах переноса. Многие уравнения, описывающие их, аналогичны. Например, существует аналогия между тепло - и массообменном.
Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
При протекании электрохимических реакций в условиях различных технологических процессов скорость электрохимической реакции может быть различной на различных участках электрода. В значительной степени это определяется распределением тока (плотности тока) по поверхности электрода. В свою очередь от плотности тока в соответствии с законом Фарадея зависит и скорость электрохимической реакции.
Распределение тока далеко не всегда равномерно. Это приводит к тому, что на различных участках поверхности могут достигаться различные значения потенциалов. Кроме того, когда скорость обработки определяется концентрационными ограничениями (в условиях замедленности стадии массопереноса) при различной толщине диффузионного слоя на разных участках поверхности достигаются различные значения плотности тока, а, следовательно, и скорости обработки.
В пределе это может приводить к такому положению, что определённые участки поверхности будут обрабатываться, т.е. на них будет протекать электрохимическая реакция, а на других нет. В таком случае говорят об электродах с неравнодоступной поверхностью или о системе с распределенными параметрами. Важно подчеркнуть, что в таких случаях могут наблюдаться размерные эффекты, т.е. свойства (например, возможность осуществления той или иной электрохимической реакции или изменение выхода по току) будут зависеть от размеров электродной поверхности.
В условиях электроосаждения (при использовании гальванических ванн) речь идёт о высокой или низкой рассеивающей способности электролитов. При высокой рассеивающей способности электролита электрод покрывается более равномерно, при низкой - происходит локализация процесса. В условиях ЭХРО электрохимический процесс должен быть максимально локализован, в то время как во многих гальванических процессах, наоборот, необходима высокая равномерность растворения. Иногда для описания этих процессов используется понятие кроющей способности электролита, которая измеряется в процентах и показывает какая доля поверхности электрода покрывается осадком.
Распределением тока, а, следовательно, рассеивающей и кроющей способностью электролитов необходимо управлять. Ниже будут изложены теоретические основы методов изучения распределения тока и управления им.
В общем случае подаваемое напряжение согласно закону Ома будет складываться из:
![]() , (2.1)
, (2.1)
в котором
![]() и
и![]() - равновесные потенциалы для анодного
и катодного процессов соответственно,
- равновесные потенциалы для анодного
и катодного процессов соответственно,![]() и
и![]() - перенапряжения анодного
- перенапряжения анодного![]() и катодного
и катодного![]() процессов,IR– омическое
падение напряжения между электродами.
процессов,IR– омическое
падение напряжения между электродами.
Уравнение (2.1) показывает, что общее падение напряжения складывается из омического падения напряжения и падения напряжения в приэлектродных слоях.
Рассмотрим ванну или электрохимическую ячейку:
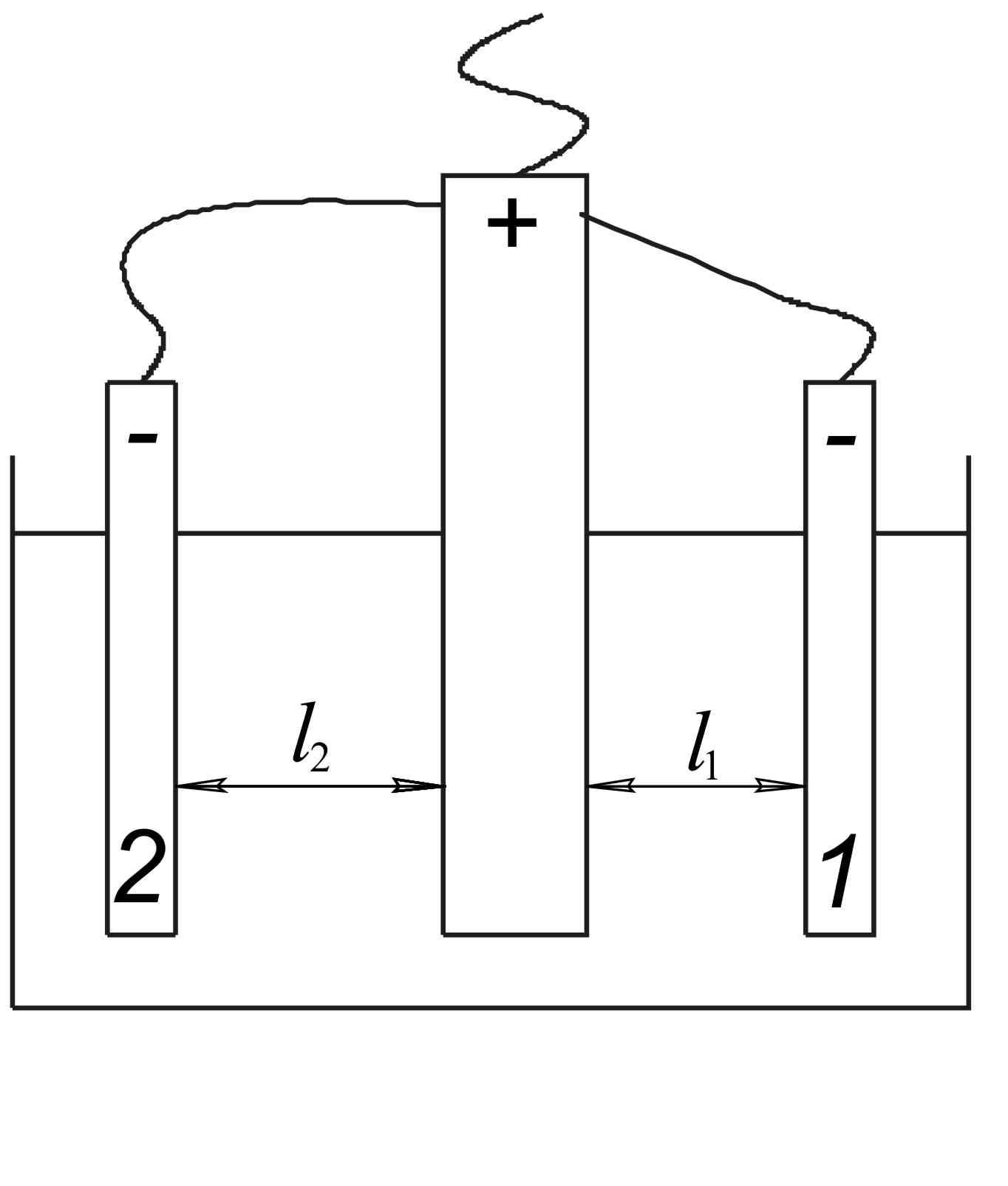
Рис. 2.1 Ванна с электродами, расположенными на разных расстояниях от анода (l2 > l1).
Будем считать, что напряжение постоянно, а электроды 1 и 2 включены параллельно. Примем также для простоты линейную зависимость поляризации (перенапряжения) от плотности тока.
![]() (2.2)
(2.2)
Омическое падение напряжения будет
определяться следующим образом:
![]() ,
где
,
где![]() - удельная электропроводность электролита.
Учитывая равенство напряжений, получаем:
- удельная электропроводность электролита.
Учитывая равенство напряжений, получаем:
![]() , (2.3)
, (2.3)
в котором i1иi2плотности тока на электродах 1, расположенном на расстоянииl1от анода и 2, расположенном на расстоянииl2от анода, соответственно.
Из (2.3) получаем:
![]() . (2.4)
. (2.4)
Если
![]() ,
тогда:
,
тогда:
![]() (2.5)
(2.5)
т.е. в данном случае распределение плотностей тока обратно пропорционально расстоянию между электродами. Чем больше расстояние от электрода, тем меньше плотность тока.
Когда
![]() получим, что
получим, что
![]() ,
т.е. плотность тока не зависит от
межэлектродного расстояния. Иными
словами, в тех случаях, когда поляризационное
сопротивление существенно больше
омического, должна наблюдаться
максимальная равномерность распределения
тока в электрохимической ячейке. Именно
в этих случаях должна наблюдаться
максимальная рассеивающая способность
электролита, поскольку скорость процесса
(плотность тока) не зависит от
межэлектродного расстояния, а определяется
только состоянием поверхности.
,
т.е. плотность тока не зависит от
межэлектродного расстояния. Иными
словами, в тех случаях, когда поляризационное
сопротивление существенно больше
омического, должна наблюдаться
максимальная равномерность распределения
тока в электрохимической ячейке. Именно
в этих случаях должна наблюдаться
максимальная рассеивающая способность
электролита, поскольку скорость процесса
(плотность тока) не зависит от
межэлектродного расстояния, а определяется
только состоянием поверхности.
Рассмотренный выше случай является частным случаем линейной зависимости поляризации от плотности тока. Для более общего случая запишем уравнение тафелевской зависимости:
![]() (2.6)
(2.6)
Значение производной
![]() теперь не постоянно, а является функцией
плотности тока.
теперь не постоянно, а является функцией
плотности тока.
Параметр, который определяет тип распространения плотности тока, называется параметром Вагнераи определяется соотношением:
![]() (2.7)
(2.7)
При выполнении (2.6) параметр Вагнера имеет вид:
![]() (2.8)
(2.8)
Рассмотрим случаи, соответствующие различным значениям безразмерного параметра Вагнера:
если
![]() ,
то это означает что
,
то это означает что
![]() и тогда
и тогда![]() ;
;
если
![]() при
при
![]() ,тогда
,тогда![]() .
.
Таким образом, параметр Вагнера количественно определяет тип распределения тока и, зная его величину, можно предложить возможные методы управления локализацией или равномерностью растворения (осаждения), в зависимости от типа распределения тока.
