
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Методы расчёта распределения тока.
Первичное распределение тока при определённых граничных условиях может быть рассчитано. В основе метода расчёта лежит решение уравнения Лапласа.
![]() (2.10)
(2.10)
Это уравнение, дополненное начальными и граничными условиями, в отдельных случаях допускает аналитическое решение. В настоящее время возможно его численное решение практически для любых условий. На основе этого решения можно получить зависимость размеров осадка или толщины растворённого слоя по поверхности электрода и от времени. В качестве примера можно привести решение этого уравнения для вращающегося дискового электрода. Оно имеет вид:
![]() , (2.11)
, (2.11)
где R– радиус дискового электрода,r- текущий радиус.
Из уравнения (2.11) следует, что при первичном распределении тока, плотность тока в центре диска будет равна половине от средней плотности тока (см. рис. 2.2).
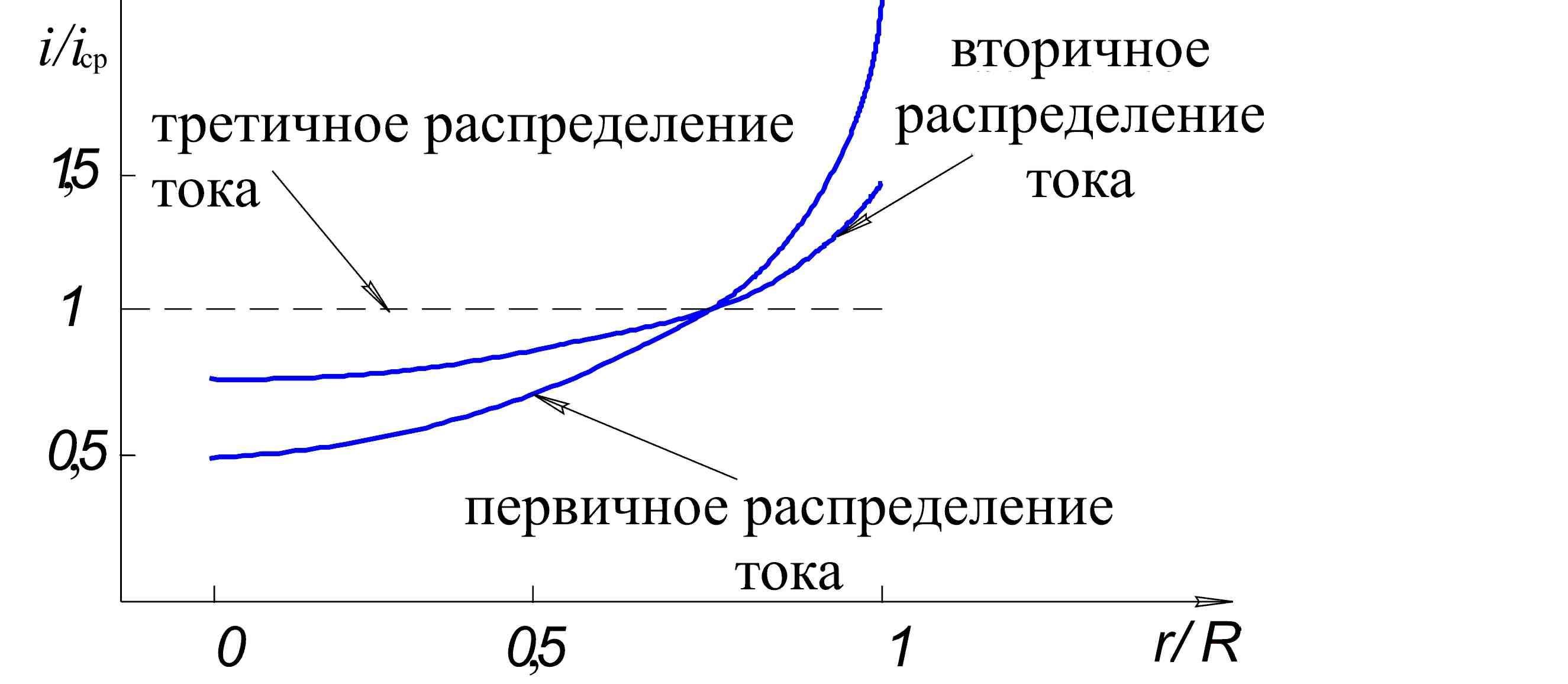
Рис. 2.2 Первичное, вторичное и третичное распределение тока на вращающемся дисковом электроде.
То, что третичное распределение тока на вращающемся дисковом электроде является равномерным, обусловлено равнодоступностью поверхности вращающегося дискового электрода в отношении процессов массопереноса.
Методы экспериментального определения рассеивающей (локализующей) способности электролита
Под рассеивающей способностью электролита (РС) обычно понимается способность электролита (вернее, границы раздела в широком смысле, включая и диффузионные слои) менять первичное распределение тока, обусловленное только геометрическими параметрами. В целом ряде случаев расчёт распределения тока является затруднительным, и поэтому требуется его экспериментальное определение.
Разработаны различные методы (ячейки) для определения РС. Наибольшее распространение из них получили следующие методы: 1) Херинга – Блюма; 2) Хулла; 3) Мёллера (по фамилиям авторов, впервые предложивших эти методы).
Метод Херинга – Блюма основан на измерении разницы толщины осадков на электродах, расположенных на различном расстоянии от анода (см. рис. 2.1). Метод Хулла использует электроосаждение на угловом катоде.
Метод Мёллера использует измерение распределения толщин осадков в ячейке со щелевым анодом (анод в виде щели).
Для определения РСпри интенсивных режимах электролиза, можно использовать ячейку Хулла с вращающимся цилиндрическим электродом.
В общем случае метод экспериментального определения РСможно пояснить с помощью рис. 2.3. КриваяАВ– кривая первичного распределения тока. ПрямаяMN– прямая равномерного распределения тока. КриваяСD– экспериментально определяемое распределение тока (металла).РСможно экспериментально определить, используя уравнение:
![]() (2.12)
(2.12)

Рис. 2.3 Схема определения рассеивающей способности электролита.
При
первичном распределении тока Спереходит вА,Dпереходит вВ,![]() и
и![]() .
При равномерном распределении тока
.
При равномерном распределении тока![]() и
и![]() (100%). Экспериментально определяяРСс использованием уравнения 2.12 можно
прогнозировать равномерность (локализацию)
распределения плотностей тока и локальных
скоростей обработки.
(100%). Экспериментально определяяРСс использованием уравнения 2.12 можно
прогнозировать равномерность (локализацию)
распределения плотностей тока и локальных
скоростей обработки.
Лекция 3. Химические источники тока (хит). Основные характеристики хит
Химическими источниками тока называют устройства, в которых химическая энергия пространственно разделенных окислительно-восстановительных реакций преобразовывается в электрическую. Электрическая энергия возникает при замыкании электродов ХИТна внешнее сопротивление (нагрузку), благодаря превращению активных веществ, определенный запас которых создается в электродах, при изготовленииХИТ.
По характеру работы ХИТ различают: 1) первичные источники тока, активные вещества которых используют однократно; 2) вторичные ХИТ, или аккумуляторы, у которых израсходованные при разряде активные вещества могут быть регенерированы путем заряда от внешнего источника постоянного тока; 3) топливные элементы, или электрохимические генераторы, для непрерывной работы которых необходимо обеспечить подвод соответствующих веществ к электродам ХИТ.
Как всякая электрохимическая система,
ХИТ характеризуется электродвижущей
силой (ЭДС),определяемой
разностью равновесных потенциалов,
соответствующих реакциям, протекающим
на электродах данного источника тока.
Так, при работе серебряно-цинкового
гальванического элементаZn|KOH|Ag2O![]() (рис. 3.1) токообразующие процессы и
соответствующие равновесные потенциалы
для положительного цинковогои отрицательного серебряного
(рис. 3.1) токообразующие процессы и
соответствующие равновесные потенциалы
для положительного цинковогои отрицательного серебряного![]() электродов
могут быть записаны уравнениями:
электродов
могут быть записаны уравнениями:
Ag2O
+ H2O
+ 2![]() = 2Ag +
2OH-, (3.а)
= 2Ag +
2OH-, (3.а)
Zn + 2OH-
= ZnO
+ H2O
+ 2![]() , (3.б)
, (3.б)
После сложения частных электродных реакций получаем суммарную токообразующую реакцию:
Ag2O + Zn = ZnO + 2Ag. (3.в)
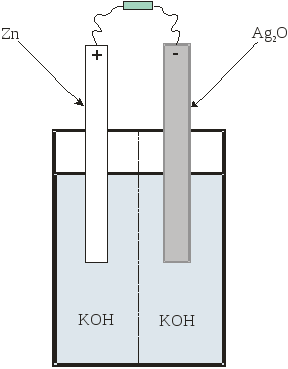
Рис. 3.1 Схема серебряно – цинкового гальванического элемента
ЭДС ХИТ зависит от природы и активности участников токообразующего процесса и от температуры и не зависит от межэлектродных расстояний, размеров электродов и других конструкционных параметров ХИТ.
Для характеристики ХИТ обычно применяют близкое к ЭДС напряжение разомкнутой цепиUрц, представляющее собой разность между стационарными потенциалами электродов неработающего ХИТ, которая зависит также от степени разряженности ХИТ к моменту измеренияUpц.
Ниже будут рассмотрены основные характеристики ХИТ на примере работы вторичных источников тока (аккумуляторов).
Напряжение на клеммах работающего ХИТ зависит от проходящего через электрохимическую систему электрического тока, что иллюстрируется так называемыми вольтамперными кривыми (рис. 3.2). Напряжение при разрядевсегда меньше, а при заряде (аккумулятора)U3– большеUразна падение напряжения за счет омических потерь IRи поляризации положительного (η+) и отрицательного (η-) электродов при работе ХИТ в неравновесных условиях. Упрощенно это может быть выражено линейными уравнениями:
Uр =Uрц- [IрRом+ (η++η-)], (3.1)
U3 = Uрц + [IзRом + (η+ + η-)]. (3.2)
Сумма (η++η-), обозначаемая условно какЕп(напряжение поляризации), пропорциональна току разряда, либо заряда:Еп=RпI.

Рис. 3.2 Вольтамперная характеристика ХИТ
Коэффициент пропорциональности, называемый сопротивлением поляризации Rп, имеет размерность омического сопротивления, однако в широком интервале изменения токаRп не подчиняется закону Ома. После подстановки значенийЕпв уравнения (3.1) и (3.2) получим:
Uр=Uрц-Iр(Rом+Rп) = Uрц - IpRвн, (3.3)
Uз=Uрц+Iз(Rом+Rп) = Uрц + IзRвн, (3.4)
где Rвн=Rом+Rп -полное
внутреннее сопротивлениеХИТ. Таким
образом, при разряде![]() ,
а при заряде
,
а при заряде![]() .
.
На основании рис. 3.2 для данного интервала нагрузки
![]() ,
либоRвн=tg, (3.5)
,
либоRвн=tg, (3.5)
где – угол наклона касательной к вольтамперной кривой при силе токаI.
Полное внутреннее сопротивление возрастает с увеличением степени разряженности ХИТ (при этом увеличиваются обе составляющие Rом иRп) и уменьшается с ростом температуры.
Большую роль в формировании требуемых параметров ХИТ играет поляризация электродов. Основными причинами ее возникновения являются:
концентрационные изменения в растворе вблизи поверхности электрода (либо в твердой фазе) при прохождении тока, которые вызывают затруднения доставки активного вещества (диффузионное перенапряжение или концентрационная поляризация);
замедленность собственно электрохимической реакции, связанная с переходом заряда через фазовую границу, что требует повышения разности потенциалов для активации процесса (электрохимическое перенапряжение, или активационная поляризация);
образование первых зародышей кристаллов при восстановлении оксидных электродов до металлов (кристаллизационная поляризация).
Пассивация электродов(чаще всего наблюдаемая при анодном растворении металлических электродов), связанная с изменением структуры активной массы при работе ХИТ, образованием на поверхности металлов плотных оксидных слоев, экранирующих и изолирующих ее, либо с адсорбцией на поверхности электрода кислорода или других веществ. При этом электрохимические свойства электрода могут измениться таким образом, что скорость реакции (ток) резко уменьшится, хотя запас активного вещества еще не исчерпан. Склонность к пассивации особенно возрастает при понижении температуры.
В некоторых случаях вследствие увеличения поляризации электрода (если при помощи внешних устройств силу разрядного тока поддерживать постоянной) на запассивированном электроде может начаться другая реакция, например, выделение кислорода вместо анодного растворения металла. Соответственно уменьшается и разрядное напряжение ХИТ.
График изменения Uрза время разряда ХИТри измененияUзза время его зарядазпри постоянной силе тока называют разрядно-зарядной характеристикой аккумулятора (рис. 3.3). Сняв зарядно-разрядные кривые, можно определить соответствующие значения емкости, энергии, коэффициента полезного действия ХИТ при его эксплуатации в данном режиме. Так как перепад значений начальногоUрниUркнапряжений разряда, которые определяются электрохимической системой ХИТ и потребителем, может быть достаточно большим (рис. 3.3), для расчетов используютсредние напряжения разрядаUср.р. Эту величину определяют либо интегрированием разрядной кривой (рис. 3.3) от 0 до, либо как среднее арифметическое изnнапряжений, измеренных через равные промежутки времени.

Рис. 3.3 Зарядно – разрядная характеристика ХИТ
Напряжение разряда ХИТ зависит от конструкции, режима разряда, температуры, технологических особенностей и других факторов.
РазряднойемкостьюQр(А·ч) называют количество электричества, отдаваемое ХИТ во внешнюю цепь при данных режимах разряда, а зарядной емкостьюQз– количество электричества, которое необходимо сообщить разряженному аккумулятору для восстановления запаса активных веществ.
В общем случае
![]() . (3.6)
. (3.6)
При конечных значениях времени и напряжения разряда при Iр=const
Qр=Iрр, (3.7)
а при R=const(если разряд ХИТ вести на постоянное внешнее сопротивление)

или
![]() (3.8)
(3.8)
Емкость, гарантируемая заводом-изготовителем при нормальном режиме работы ХИТ, называется номинальной емкостью Qн. В связи с необходимостью учета саморазряда ХИТ его фактическая емкостьQсрпревышаетQнна 10 – 20%.
Теоретическая емкостьQт– емкость, которую данный ХИТ мог бы отдать, если бы коэффициент используемых активных веществ, участвующих в токообразующем процессеКиавбыл равен 100%. Его рассчитывают по закону Фарадея: при участии в электрохимической реакции 1/nмолей вещества может быть получена емкость, равная 26,8 А·ч (объединенный закон Фарадея):
![]()
Коэффициент использования активных веществможет быть определен отношением:
Киав=gr /g, (3.9)
где gr - количество активного вещества, принимающего участие в токообразующей реакции в соответствии с законом Фарадея, г
gr =CQ, (3.10)
g– фактически израсходованное при разряде доUркколичество активного вещества, г;C– электрохимический эквивалент, (г/А·ч):
Значение gпревышает значениеgт, что обусловлено протеканием на электродах ХИТ побочных процессов, а также тем, чтоUрк≠ 0. В силу этих же причин количество электричества, полученное при разряде заложенной в ХИТ активной массы, меньше теоретической емкости, иКиав, который может быть также рассчитан по уравнению
Киав =Q/Qr (3.11)
как правило, меньше единицы.
Возможность полного использования активных веществ ограничивается рядом причин, например, образованием не проводящих ток продуктов реакции, закупоркой пор пластин нерастворимыми соединениями, неравномерным использованием активных веществ по глубине пластины, увеличением электросопротивления электролита и т.п. Также как и емкость, КиавХИТ определяется его конструкцией, режимами эксплуатации и хранения.
СаморазрядХИТ – самопроизвольная потеря емкости при его хранении – обусловлен протеканием побочных химических реакций с участием активных веществ электродов и электролита. Саморазряд выражают в процентах (долях) относительного снижения емкости за время хранения ХИТτпо уравнению
S =Q-Qф/Q, (2.12)
где Qф– емкость после хранения ХИТ в течение времени τ (сутки, месяцы, годы).
Энергия W(Дж или Вт·ч), отдаваемая ХИТ потребителю при определенных режимах разряда (либо потребляемая аккумулятором при его заряде), может быть рассчитана по уравнениям:
при Iр(з)=constWр(з)=Qр(з)Uср.р(з)=Iр(з)р(з)Uср.р(з), (3.13)
при R =constWр=
![]() (3.14)
(3.14)
Для сравнения энергетических характеристик
различных систем ХИТ используют величины
теоретической удельной энергии![]() –
энергии, отнесенной к единице массы,
либо объема активных веществ при
коэффициенте их использования, равном
единице. Величина
–
энергии, отнесенной к единице массы,
либо объема активных веществ при
коэффициенте их использования, равном
единице. Величина![]() постоянна для данной электрохимической
системы. Практически получаемая удельная
энергия всегда меньше теоретической и
зависит от конструкции и режима
эксплуатации ХИТ.
постоянна для данной электрохимической
системы. Практически получаемая удельная
энергия всегда меньше теоретической и
зависит от конструкции и режима
эксплуатации ХИТ.
МощностьХИТР(Вт) – работа, производимая за единицу времени, - определяется уравнениемРр=IрUср.р, а теоретическая мощность – уравнениемРт=IUрц.
Мощность тратится на преодоление
сопротивления внешней цепи (полезная
мощность Рпол) и на преодоление
полного внутреннего сопротивления
самого источника тока. Следовательно,
полезная мощностьРпол=IUрц.
-I2Rвн.
Зависимости Rпол
отR иRполотIпроходят через максимум. Для нахождения
максимальной полезной мощности![]() следует продифференцировать
Рполпо току (либо по
сопротивлению) и приравнять производную
нулю.
следует продифференцировать
Рполпо току (либо по
сопротивлению) и приравнять производную
нулю.
![]() во внешней цепи можно получить при
условии равенства сопротивления внешней
цепи полному внутреннему сопротивлению
ХИТ.
во внешней цепи можно получить при
условии равенства сопротивления внешней
цепи полному внутреннему сопротивлению
ХИТ.
В момент отдачи максимальной полезной мощности напряжение ХИТ Uрц= Uрц/2, а сила токаI = Uрц/2Rвн.
Удельные характеристикиХИТ (емкость, энергия или мощность на единицу массы или объема данного источника тока) используют для сопоставления различных ХИТ.
Весьма важными для характеристики ХИТ являются такие показатели как сохранность(максимальный срок хранения, после которого ХИТ еще отдает обусловленную техническими условиями емкость) исрок службы(ресурс). Для аккумуляторов ресурс определяется количеством циклов заряд - разряд, после которых емкость снижается не больше, чем на 20 - 25%Qp.
При последовательном соединении ХИТ в батарею разрядное напряжение батареи равно сумме Uротдельных ее элементов, в то время как ток разряда (и емкость) батареи определяются соответствующими величинами отдельного элемента. При параллельном соединении ХИТ напряжение на клеммах батареи равноUр отдельного элемента, аIриQpсоответственно суммируются. Количество энергии, отдаваемой батареей ХИТ,Wp= Qp Uрне зависит от способа их включения.
