
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Методы защиты от коррозии.
Кинетическая теория коррозии позволяет предложить электрохимические методы уменьшения скорости коррозии. Все методы борьбы с коррозией можно разделить на два типа:
неэлектрохимические методы; к этим методам относятся все методы, обеспечивающие защиту поверхности металла от воздействия окружающей среды (краска, нанесение специальных плёнок, эмалирование поверхности и др.);
электрохимические методы предполагают следующие методы снижения коррозии:
катодная защита – в этом случае защищаемый металл делается катодом, при этом скорость его коррозии резко снижается;
протекторная защита – защищаемый металл соединяется с другим металлом (протектором), который в ряду напряжений расположен левее (например, магний), при этом протектор будет растворяться (будет анодом, а основная конструкция – катодом);
анодная защита – защищаемая конструкция делается анодом, но ему задается потенциал в области пассивности (см. ниже), при котором скорость растворения резко снижается;
ингибиторы коррозии (вещества снижающие скорость коррозии).
Ингибиторы коррозии бывают трёх типов:
ингибитор катодного типа;
ингибитор анодного типа;
ингибитор смешенного типа.
Ингибитор катодного типа (рис. 15.6а)
увеличивает перенапряжение восстановления
окислителя (кривая 2’ на рис. 15.6а) и
тем самым снижает скорость коррозии
(![]() ).
).
Ингибитор анодного типа (рис. 15.6б) увеличивает перенапряжение анодного растворения металла (для сравнения кривые 1 и 1на рис.15.6б), и тем самым снижает скорость коррозии.
Ингибитор смешенного типа (рис. 15.6в) увеличивает перенапряжение и растворение металла, восстановления окислителя, а, следовательно, снижает скорость коррозии.
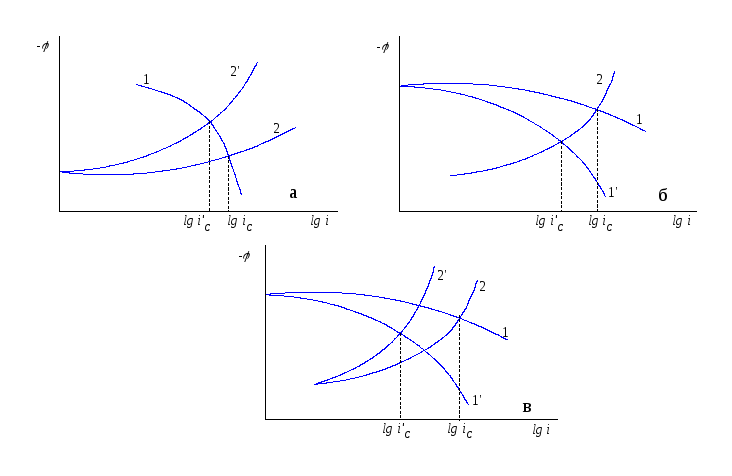
Рис. 15.6 Действие ингибиторов катодного (а), анодного (б) и смешанного типа (в).
К электрохимическим методам защиты от коррозии следует отнести также электрохимическое осаждение на поверхности металла более благородных металлов, которые в меньшей степени подвергаются коррозии, например: никелирование, хромирование, цинкование и др.
Катодная защита основана на искусственном уменьшении потенциала защищаемого изделия, при котором скорость коррозии может снижаться в несколько десятков раз. Это может достигаться с помощью станций катодной защиты, т.е. подключение защищаемого изделия таким образом к источнику тока, что защищаемые изделия становятся катодом, а анодом (подвергающимся растворению) служит какой – либо металлический лом. Методы анодной защиты будут рассмотрены в следующем разделе.
Пассивность металлов.
Форма поляризационной кривой, при которой увеличение анодного потенциала всегда увеличивает скорость электрохимической реакции, наблюдается не всегда. В некоторых, достаточно распространённых случаях, при достижении определённого потенциала наблюдается существенное снижение скорости анодной реакции. Такой потенциал называется Фладе-потенциаломили потенциалом пассивации. Рассмотрим поляризационные кривые, представленные на рис. 15.7.
Поляризационная кривая типа 1 характеризуется тем, что при достижении Фладе-потенциалаFнаблюдается резкое (в несколько десятков раз) снижение скорости электрохимической реакции. В этой области (при потенциалах, превышающихF, рис. 15.7) металл пассивен.
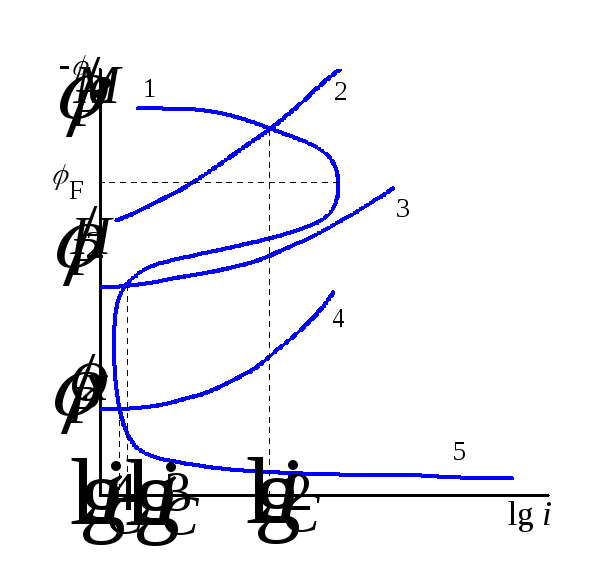
Рис. 15.7 Поляризационные кривые и коррозионные диаграммы при наличии анодной пассивности металла.1 – поляризационная кривая пассивирующегося металла; 2 – выделение водорода на металле; 3 – выделение водорода на благородном металле; 4 – восстановление кислорода или, какого – либо другого окислителя; 5 – транспассивное растворение метала.
Как правило, достижение пассивности связано с образованием оксидных плёнок (MeOn), которые и защищают поверхность металла от взаимодействия с окружающей средой. При рассмотрении различных вариантов в поведении системы можно выделить несколько случаев:
восстановление водорода происходит с низким перенапряжением так, что потенциал коррозии соответствует активному растворению металла (кривая 2, высокая скорость коррозии
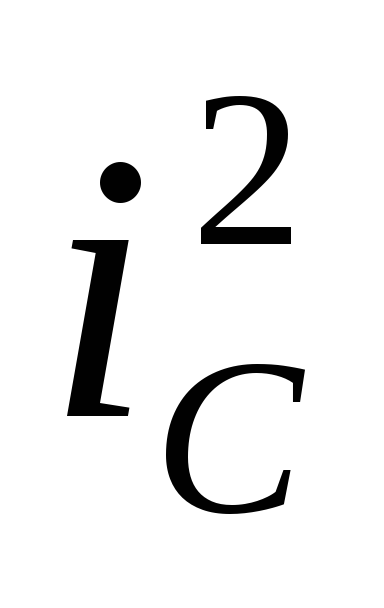 );
);при низком перенапряжении выделения водорода коррозионный потенциал может сместиться в область анодной пассивности, при этом происходит резкое смещение скорости коррозии (кривая 3, скорость коррозии
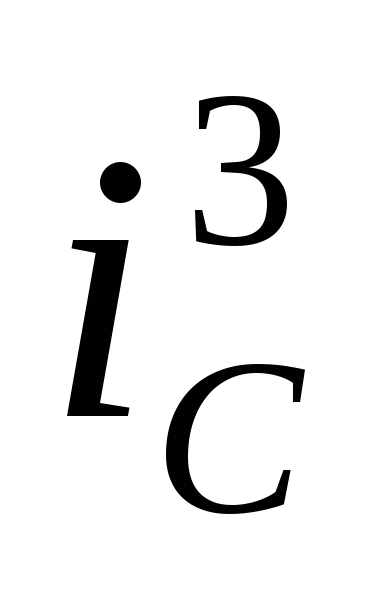 );
);любой другой окислитель также при определённой его концентрации может давать коррозионный потенциал в области пассивности металла (кривая 4, скорость коррозии
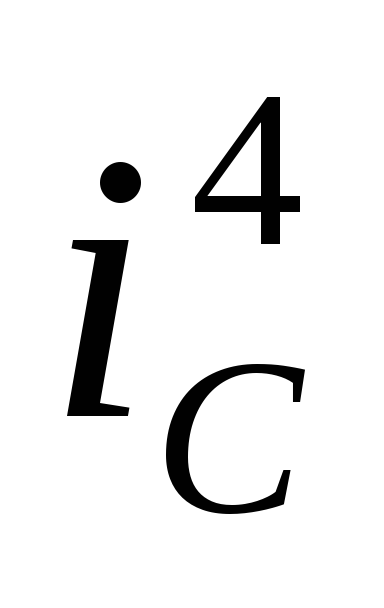 ).
).
Таким образом, если коррозионный потенциал находится в области пассивности металла, наблюдается резкое снижение скорости коррозии. Однако, это возможно только в определённой области потенциалов, соответствующей пассивности. Дальнейшее увеличение анодного потенциала может привести к увеличению скорости коррозии и переходу в так, называемое транспассивное растворение (растворение за областью пассивности, кривая 5).
Пассивация широко применяется в технике. Так, например, концентрированную азотную кислоту можно перевозить в железной таре, потому что достигаемый при этом коррозионный потенциал находится в области пассивности металла, и скорость коррозии чрезвычайно мала. Наличие области пассивации позволяет осуществить анодную защиту металлов от коррозии. При этом защищаемым изделиям задается такой потенциал, который позволяет поддерживать изделия в области пассивности, т.е. резко снизить скорость коррозии.
