
- •Курс физики
- •Механика глава 1. Кинематика и динамика частицы § 1. Путь и перемещение
- •§ 2. Скорость и ускорение
- •§ 3. Сила и работа
- •Глава 2. Кинематика и динамика вращения твердого тела § 4. Угловая скорость и угловое ускорение
- •§ 5. Средняя скорость и среднее ускорение
- •§ 6. Момент силы
- •Глава 3. Законы сохранения § 7. Механическая энергия. Закон сохранения механической энергии
- •§ 8. Импульс. Закон сохранения импульса
- •§ 9. Момент импульса. Закон сохранения момента импульса
- •Глава 4. Механические колебания § 10. Гармонические колебания
- •§ 11. Затухающие колебания
- •§ 12. Вынужденные колебания
- •Глава 5. Механические волны § 13. Гармонические волны
- •§ 14. Плоская гармоническая волна
- •Экзаменационные вопросы 1
- •Контрольные задания 1 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Приложение а
- •Молекулярная физика глава 6. Кинетическая теория газов § 15. Уравнение состояния идеального газа
- •§ 16. Внутренняя энергия идеального газа
- •§ 17. Распределение Максвелла
- •§ 18. Барометрическая формула
- •§ 19. Распределение Больцмана
- •§ 20. Явления переноса
- •Глава 7. Термодинамика § 21. Термодинамическая система и термодинамический процесс
- •§ 22. Первый закон термодинамики
- •§ 23. Теплоемкость идеального газа
- •§ 24. Адиабатический процесс
- •§ 25. Энтропия
- •§ 26. Второй и третий законы термодинамики
- •Глава 8. Реальные газы § 27. Силы межмолекулярного взаимодействия в газах
- •§ 28. Агрегатное состояние вещества
- •§ 29. Уравнение Ван-дер-Ваальса
- •§ 30. Внутренняя энергия реального газа
- •Экзаменационные вопросы 2
- •Контрольные задания 2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Приложение б
- •Электромагнетизм глава 9. Электрическое поле в вакууме § 31. Напряженность поля
- •§ 32. Поток вектора
- •§ 33. Теорема Гаусса для поля вектора
- •§ 34. Циркуляция вектора
- •§ 35. Потенциал поля
- •§ 36. Связь между φ и
- •Глава 10. Электрическое поле в диэлектрике § 37. Диполь в электрическом поле
- •§ 38. Поляризация диэлектрика
- •§ 39. Вектор
- •Глава 11. Энергия электрического поля § 40. Электроемкость
- •§ 41. Электроемкость плоского конденсатора
- •§ 42. Энергия электрического поля
- •Глава 12. Электрический ток § 43. Электрический ток
- •§ 44. Закон Ома для проводника
- •§ 45. Обобщенный закон Ома
- •§ 46. Закон Джоуля – Ленца
- •Глава 13. Магнитное поле в вакууме § 47. Магнитная индукция
- •§ 48. Закон Био – Савара
- •§ 49. Теорема Гаусса для поля вектора
- •§ 50. Теорема о циркуляции вектора
- •§ 51. Магнитное поле в соленоиде
- •§ 52. Закон Ампера
- •Глава 14. Магнитное поле в веществе § 53. Контур с током в магнитном поле
- •§ 54. Намагничивание магнетика
- •§ 55. Вектор
- •Глава 15. Энергия магнитного поля § 56. Индуктивность
- •§ 57. Электромагнитная индукция
- •§ 58. Энергия магнитного поля
- •Глава 16. Электромагнитные волны § 59. Вихревое электрическое поле
- •§ 60. Ток смещения
- •§ 61. Система уравнений Максвелла
- •§ 62. Электромагнитные волны
- •Глава 17. Волновая оптика § 63. Свет
- •§ 64. Интерференция света
- •§ 65. Дифракция света
- •§ 66. Поглощение света
- •§ 67. Рассеяние света
- •§ 68. Поляризация света
- •§ 69. Закон Малюса
- •§ 70. Вращение плоскости поляризации
- •Контрольные задания 3 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Экзаменационные вопросы 3
- •Приложение в
- •Квантовая физика глава 18. Квантовая оптика § 71. Тепловое излучение
- •§ 72. Закон Кирхгофа
- •§ 73. Законы теплового излучения черного тела
- •§ 74. Формула Планка
- •§ 75. Фотоэффект
- •§ 76. Формула Эйнштейна для фотоэффекта
- •§ 77. Фотон
- •§ 78. Эффект Комптона
- •Глава 19. Квантовая механика § 79. Волны де Бройля
- •§ 80. Волновая функция
- •§ 81. Соотношение неопределенностей Гейзенберга
- •§ 82. Уравнение Шредингера
- •§ 83. Микрочастица в потенциальном ящике
- •Глава 20. Атомная физика § 84. Атом водорода
- •§ 85. Излучение и поглощение света атомом водорода
- •§ 86. Пространственное квантование
- •§ 87. Принцип Паули
- •Глава 21. Зонная теория твердых тел § 88. Металлы, полупроводники и диэлектрики
- •§ 89. Электронно-дырочная проводимость полупроводников
- •§ 90. Примесные полупроводники
- •Глава 22. Ядерная физика § 92. Строение атомного ядра
- •§ 93. Энергия связи ядра
- •§ 94. Радиоактивность
- •Контрольные задания 4 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Экзаменационные вопросы 4
- •Приложение г
- •Оглавление
§ 28. Агрегатное состояние вещества
Получим
выражение для взаимной потенциальной
энергии П двух молекул газа. Воспользуемся
связью между работой и потенциальной
энергией. Элементарная работа, совершаемая
результирующей силой
![]() межмолекулярного взаимодействия при
увеличении расстояния между молекулами
на
межмолекулярного взаимодействия при
увеличении расстояния между молекулами
на
![]()
(![]() 28.1)
28.1)
равна убыли потенциальной энергии молекул:
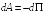
от
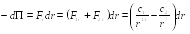
(28.2)
(см § 27).
Интегрируя
выражение (28.2) по
![]() до
до
![]() ,
имеем
,
имеем
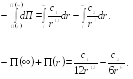
Полагая
![]() окончательно получаем
окончательно получаем

(28.3)
где
![]() и
и
![]()
Выражение
(28.3) называют формулой
Леннарда – Джонса.
Изобразим
зависимость (28.3) П от
![]() графически (рис.
28.1).
графически (рис.
28.1).
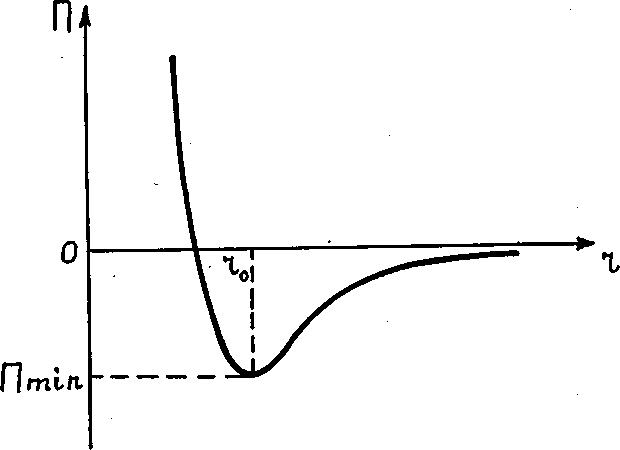
Из
рис. 28.1
видно, что при
![]() взаимная потенциальная энергия молекул
минимальна. Расстояние
взаимная потенциальная энергия молекул
минимальна. Расстояние
![]() соответствует равновесному расстоянию
между молекулами при отсутствии теплового
движения.
соответствует равновесному расстоянию
между молекулами при отсутствии теплового
движения.
Зависимость П(r), изображенная на рис. 28.1, аналогична для молекул жидкостей и твердых тел. Глубина потенциальной ямы Пmin определяет величину работы, которую нужно совершить против сил притяжения для того, чтобы молекулы, находящиеся в состоянии равновесия, развести на бесконечно большое расстояние.
Агрегатное
состояние вещества зависит от соотношения
между Пmin
и кинетической энергией теплового
движения молекул, имеющей порядок
![]() :
:
1)
если
![]() мало,
мало,
![]() то молекулы располагаются в определенном
порядке — твердое
тело;
то молекулы располагаются в определенном
порядке — твердое
тело;
2)
если
![]() велико,
велико,
![]() то тепловое движение препятствует
сближению молекул, приводящему к
образованию устойчивых структур, —
газ;
то тепловое движение препятствует
сближению молекул, приводящему к
образованию устойчивых структур, —
газ;
3)
при
![]() молекулы перемещаются, но расстояние
между ними мало отличается от
молекулы перемещаются, но расстояние
между ними мало отличается от
![]() — жидкость.
— жидкость.
Следовательно, в зависимости от температуры вещество может находиться в различных агрегатных состояниях.
§ 29. Уравнение Ван-дер-Ваальса
Уравнение состояния идеального газа (уравнение Клапейрона – Менделеева)
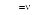
(29.1)
было
получено в предположении, что молекулы
газа имеют пренебрежимо малый собственный
объем, не взаимодействуют друг с другом
на расстоянии и сталкиваются между
собой как упругие шарики. Очевидно,
такое допущение можно делать только
для газов при небольших давлениях (~1
атм), когда расстояния между молекулами
газа таковы, что силами межмолекулярного
взаимодействия можно пренебречь (при
![]() м).
м).
Модель газа, отличная от модели идеального газа, была предложена Ван-дер-Ваальсом. Согласно этой модели, молекулы газа имеют собственный объем, взаимно притягиваются друг к другу и сталкиваются между собой как упругие шарики. Такая модель позволила получить уравнение состояния газа, более соответствующее свойствам реальных газов, чем уравнение Клапейрона – Менделеева. Это уравнение, называемое уравнением Ван-дер-Ваальса, имеет вид
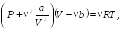
(29.2)
где
![]() и
и
![]() — постоянные для данного газа величины,
которые определяют опытным путем.
— постоянные для данного газа величины,
которые определяют опытным путем.
Уравнение
(29.2) отличается от уравнения (29.1) двумя
поправками:
![]() и νb.
Поправка
и νb.
Поправка
![]() учитывает действие молекулярных сил
притяжения, которое эквивалентно
действию дополнительного давления,
испытываемого газом. Величина этого
дополнительного давления
учитывает действие молекулярных сил
притяжения, которое эквивалентно
действию дополнительного давления,
испытываемого газом. Величина этого
дополнительного давления
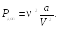
(29.3)
Поправка νb учитывает собственный объем молекул. Она равна учетверенному собственному объему всех молекул газа.
