
- •Курс физики
- •Механика глава 1. Кинематика и динамика частицы § 1. Путь и перемещение
- •§ 2. Скорость и ускорение
- •§ 3. Сила и работа
- •Глава 2. Кинематика и динамика вращения твердого тела § 4. Угловая скорость и угловое ускорение
- •§ 5. Средняя скорость и среднее ускорение
- •§ 6. Момент силы
- •Глава 3. Законы сохранения § 7. Механическая энергия. Закон сохранения механической энергии
- •§ 8. Импульс. Закон сохранения импульса
- •§ 9. Момент импульса. Закон сохранения момента импульса
- •Глава 4. Механические колебания § 10. Гармонические колебания
- •§ 11. Затухающие колебания
- •§ 12. Вынужденные колебания
- •Глава 5. Механические волны § 13. Гармонические волны
- •§ 14. Плоская гармоническая волна
- •Экзаменационные вопросы 1
- •Контрольные задания 1 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Приложение а
- •Молекулярная физика глава 6. Кинетическая теория газов § 15. Уравнение состояния идеального газа
- •§ 16. Внутренняя энергия идеального газа
- •§ 17. Распределение Максвелла
- •§ 18. Барометрическая формула
- •§ 19. Распределение Больцмана
- •§ 20. Явления переноса
- •Глава 7. Термодинамика § 21. Термодинамическая система и термодинамический процесс
- •§ 22. Первый закон термодинамики
- •§ 23. Теплоемкость идеального газа
- •§ 24. Адиабатический процесс
- •§ 25. Энтропия
- •§ 26. Второй и третий законы термодинамики
- •Глава 8. Реальные газы § 27. Силы межмолекулярного взаимодействия в газах
- •§ 28. Агрегатное состояние вещества
- •§ 29. Уравнение Ван-дер-Ваальса
- •§ 30. Внутренняя энергия реального газа
- •Экзаменационные вопросы 2
- •Контрольные задания 2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Приложение б
- •Электромагнетизм глава 9. Электрическое поле в вакууме § 31. Напряженность поля
- •§ 32. Поток вектора
- •§ 33. Теорема Гаусса для поля вектора
- •§ 34. Циркуляция вектора
- •§ 35. Потенциал поля
- •§ 36. Связь между φ и
- •Глава 10. Электрическое поле в диэлектрике § 37. Диполь в электрическом поле
- •§ 38. Поляризация диэлектрика
- •§ 39. Вектор
- •Глава 11. Энергия электрического поля § 40. Электроемкость
- •§ 41. Электроемкость плоского конденсатора
- •§ 42. Энергия электрического поля
- •Глава 12. Электрический ток § 43. Электрический ток
- •§ 44. Закон Ома для проводника
- •§ 45. Обобщенный закон Ома
- •§ 46. Закон Джоуля – Ленца
- •Глава 13. Магнитное поле в вакууме § 47. Магнитная индукция
- •§ 48. Закон Био – Савара
- •§ 49. Теорема Гаусса для поля вектора
- •§ 50. Теорема о циркуляции вектора
- •§ 51. Магнитное поле в соленоиде
- •§ 52. Закон Ампера
- •Глава 14. Магнитное поле в веществе § 53. Контур с током в магнитном поле
- •§ 54. Намагничивание магнетика
- •§ 55. Вектор
- •Глава 15. Энергия магнитного поля § 56. Индуктивность
- •§ 57. Электромагнитная индукция
- •§ 58. Энергия магнитного поля
- •Глава 16. Электромагнитные волны § 59. Вихревое электрическое поле
- •§ 60. Ток смещения
- •§ 61. Система уравнений Максвелла
- •§ 62. Электромагнитные волны
- •Глава 17. Волновая оптика § 63. Свет
- •§ 64. Интерференция света
- •§ 65. Дифракция света
- •§ 66. Поглощение света
- •§ 67. Рассеяние света
- •§ 68. Поляризация света
- •§ 69. Закон Малюса
- •§ 70. Вращение плоскости поляризации
- •Контрольные задания 3 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Экзаменационные вопросы 3
- •Приложение в
- •Квантовая физика глава 18. Квантовая оптика § 71. Тепловое излучение
- •§ 72. Закон Кирхгофа
- •§ 73. Законы теплового излучения черного тела
- •§ 74. Формула Планка
- •§ 75. Фотоэффект
- •§ 76. Формула Эйнштейна для фотоэффекта
- •§ 77. Фотон
- •§ 78. Эффект Комптона
- •Глава 19. Квантовая механика § 79. Волны де Бройля
- •§ 80. Волновая функция
- •§ 81. Соотношение неопределенностей Гейзенберга
- •§ 82. Уравнение Шредингера
- •§ 83. Микрочастица в потенциальном ящике
- •Глава 20. Атомная физика § 84. Атом водорода
- •§ 85. Излучение и поглощение света атомом водорода
- •§ 86. Пространственное квантование
- •§ 87. Принцип Паули
- •Глава 21. Зонная теория твердых тел § 88. Металлы, полупроводники и диэлектрики
- •§ 89. Электронно-дырочная проводимость полупроводников
- •§ 90. Примесные полупроводники
- •Глава 22. Ядерная физика § 92. Строение атомного ядра
- •§ 93. Энергия связи ядра
- •§ 94. Радиоактивность
- •Контрольные задания 4 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Экзаменационные вопросы 4
- •Приложение г
- •Оглавление
Глава 7. Термодинамика § 21. Термодинамическая система и термодинамический процесс
До
сих пор мы изучали свойства тела (газа)
исходя из молекулярно-кинетической
теории. Мы установили, что параметры
состояния тела, как давление
![]() ,
температура
,
температура
![]() ,
объем
,
объем
![]() ,
являются суммарным результатом
хаотического теплового движения большого
числа молекул, из которых состоит тело.
Теперь мы отвлечемся от рассмотрения
характера движения молекул. Измеряя
соответствующими приборами параметры
состояния, можно определить, например,
количество тепла, полученное телом,
изменение его внутренней энергии,
работу, совершаемую телом, при различных
условиях перехода тела из одного
состояния в другое. На основе этих
измерений можно установить законы,
которые позволят изучать физические
свойства тела при самых разнообразных
процессах, в которых оно участвует.
Раздел физики, в котором таким образом
изучают свойства тел, называют
термодинамикой.
,
являются суммарным результатом
хаотического теплового движения большого
числа молекул, из которых состоит тело.
Теперь мы отвлечемся от рассмотрения
характера движения молекул. Измеряя
соответствующими приборами параметры
состояния, можно определить, например,
количество тепла, полученное телом,
изменение его внутренней энергии,
работу, совершаемую телом, при различных
условиях перехода тела из одного
состояния в другое. На основе этих
измерений можно установить законы,
которые позволят изучать физические
свойства тела при самых разнообразных
процессах, в которых оно участвует.
Раздел физики, в котором таким образом
изучают свойства тел, называют
термодинамикой.
Назовем термодинамической системой или просто системой мысленно выделенную часть тела, одно целое тело или совокупность нескольких тел. Все тела, не входящие в систему, будут внешними телами или внешней средой.
Назовем
термодинамическим
процессом или
просто процессом
изменение
состояния системы, которое определяют
по изменению параметров состояния. Если
система переходит из одного равновесного
состояния в другое через непрерывную
последовательность промежуточных
равновесных состояний, то такой процесс
называют равновесным.
На диаграмме
![]() или
или
![]() равновесные состояния системы изображают
точками, а равновесный процесс —
кривой, проходящей через эти точки (рис.
21.1).
равновесные состояния системы изображают
точками, а равновесный процесс —
кривой, проходящей через эти точки (рис.
21.1).
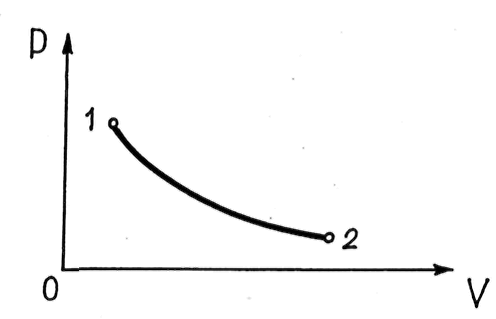
Рис. 21.1
Процесс, при котором система возвращается в исходное состояние, называют круговым процессом или циклом. Графически цикл изображают замкнутой кривой (рис. 21.2).
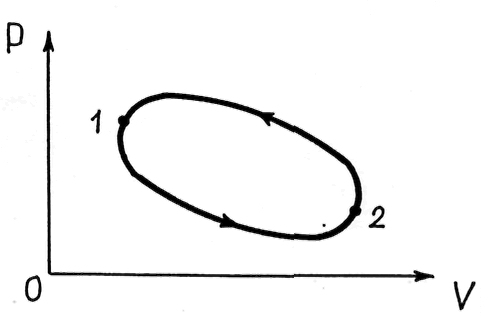 Рис.
21.2
Рис.
21.2
Если равновесный процесс может быть проведен в обратном направлении через ту же самую последовательность промежуточных равновесных состояний, что и в прямом направлении, то такой процесс называют обратимым. Все количественные выводы термодинамики строго применимы только к равновесным обратным процессам.
Простейшими термодинамическими процессами являются изохорический, проходящий при постоянном объеме (V = const), изобарический, происходящий при постоянном давлении (P = const), изотермический, при котором температура системы не изменяется (T = const).
На
диаграмме
![]() графиком
изохорического процесса является прямая
(V
= const),
называемая изохорой;
графиком изобарического процесса —
прямая P
= const,
называемая изобарой;
графиком изотермического процесса —
гипербола
графиком
изохорического процесса является прямая
(V
= const),
называемая изохорой;
графиком изобарического процесса —
прямая P
= const,
называемая изобарой;
графиком изотермического процесса —
гипербола
![]() называемая изотермой
(рис.
21.3).
называемая изотермой
(рис.
21.3).
На
диаграмме
![]() графиком изохорического процесса
является прямая V =
const
(изохора); графиком изобарического
процесса — прямая
графиком изохорического процесса
является прямая V =
const
(изохора); графиком изобарического
процесса — прямая
![]() (изобара); графиком изотермического
процесса — прямая T
= const
(изотерма) (рис.
21.4).
(изобара); графиком изотермического
процесса — прямая T
= const
(изотерма) (рис.
21.4).
На
диаграмме
![]() графиком изохорического процесса
является прямая
графиком изохорического процесса
является прямая
![]() (изохора); графиком изобарического
процесса — прямая P
= const
(изобара); графиком изотермического
процесса — прямая T
= = const
(рис. 21.5).
(изохора); графиком изобарического
процесса — прямая P
= const
(изобара); графиком изотермического
процесса — прямая T
= = const
(рис. 21.5).
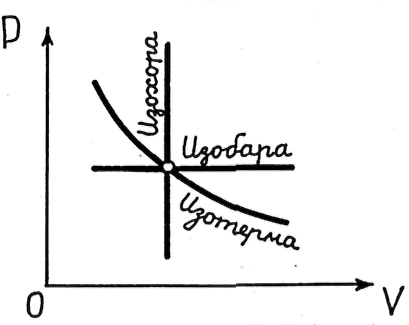
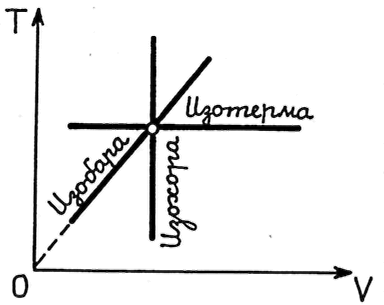
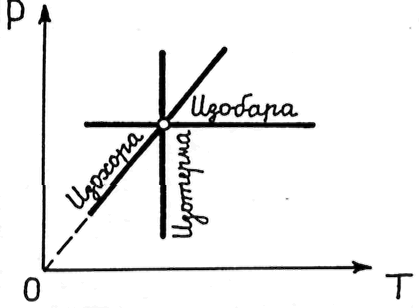
Рис. 21.5
